甲醇對丙烷/氧氣混合氣爆炸極限的影響
于瑞廣,劉杰,馬彪
(1北京交通大學機械與電子控制工程學院,北京100044;2北京交通大學新能源汽車動力總成技術重點實驗室,北京100044)
引 言
柴油及汽油燃料是多種烴類的復雜混合物,其中柴油中的烴類組分超過100種,汽油中的烴類組分超過150種[6],因此通常采用一種或幾種燃料的混合物作為實際燃料的替代燃料進行研究。實際燃料的一個典型特征是其在特定溫度區間內具有負溫 度 系 數(negative temperature coefficient,NTC)特性,同時具有低溫及高溫兩段著火特性。丙烷(C3H8)是具有負溫度系數的最小鏈烷烴[7],且丙烷與柴油都有著低溫燃燒特性[8]。丙烷含有的正丙基具有大烴烷基點火過程的所有關鍵特征[9],因此丙烷也被稱為大分子碳氫燃料的原型燃料[10]。丙烷作為液化石油氣的重要組成部分,是石油類替代燃料的研究熱點[11-12],研究表明在冷焰區域中出現的NTC現象主要由高烷烴的低溫氧化動力學主導[13-14]。此外,研究發現NTC現象主要由過氧類化學反應決定[15]。關于丙烷在不同條件下的NTC現象有很多研究,如在反應器內溫度區間為633~655 K[16],10~15 atm(1 atm=101325 Pa)下的高壓射流反應器[17-18],快速壓縮機[19],以及1200 K下的烯丙烷混合物中都發現了NTC現象[20]。據最新研究表明,在丙烷/氧氣的S形冷焰爆炸極限曲線同樣出現了NTC現象[21]。NTC響應的傾斜程度隨濃度比的增加逐漸降低,而惰性氣體的添加會引起NTC位置的平移,對NTC的傾斜程度影響較小。丙烷的爆炸極限曲線中的NTC現象主要受丙烷的低溫反應控制,其低溫反應中兩次生成的OH能夠明顯提高反應系統的活性[22]。此外,添加一定量的臭氧能夠使得丙烷/氧氣的冷焰區域向低溫、低壓區域擴展,同時NTC現象隨臭氧的增加呈現出先增強后逐漸消失的現象[23]。作為含氧燃料的甲醇,其著火過程是由鏈式反應動力學決定[24-25]。但是由于甲醇分子可以與高碳氫燃料低溫反應產生的OH反應,從而延長混合燃料的著火時間[26]。碳氫燃料的爆炸極限是由活性離子的鏈分支及鏈終止反應的競爭決定,因此甲醇的添加勢必會影響碳氫燃料的爆炸極限。然而,目前關于甲醇對高碳氫燃料的爆炸極限的研究較少,亟須開展相關研究。
本文以丙烷/甲醇混合燃料作為研究對象,研究甲醇對丙烷/氧氣混合氣爆炸極限的影響規律。通過定義冷焰爆炸極限及熱焰爆炸極限曲線的拐點,探究甲醇對爆炸極限曲線NTC響應的影響。通過提取三個不同著火狀態(非爆炸工況、冷焰工況以及熱焰工況)下的溫度、壓力以及主要物質變化規律,研究甲醇對混合氣反應過程的影響。此外通過開展丙烷/甲醇/氧氣混合氣反應過程的路徑分析,研究主要反應路徑的變化規律。最后通過對爆炸極限曲線拐點的敏感性分析獲得影響爆炸極限的主要基元反應。本研究在促進替代燃料的開發與應用,以及研制穩定高效的動力裝置方面提供了理論支持。同時,有助于進一步理解丙烷摻混甲醇二元混合氣的化學反應動力學特性,從而進一步控制丙烷/氧氣混合氣的燃燒進程,為開發先進燃燒模式以及其在雙燃料發動機的實際應用提供理論基礎。
1 數值方法
丙烷/氧氣混合氣的溫度-壓力爆炸極限采用SENKIN程序進行計算[27]。其中爆炸極限的判據為在特定壓力下10 s內系統溫度上升超過50 K[28]。爆炸極限的計算壓力范圍為(3.2~3.5×107)Pa,爆炸極限的溫度計算范圍為300~2500 K,涵蓋了典型內燃機的工作范圍。
研究中使用了四個詳細的化學動力學機理模型,包括KAUST異辛烷模型[29]、Aramco2.0模型[30]、UCSD模型[31]和愛爾蘭國立大學(NUIG)的Methane/Propane模型[32]。KAUST和Aramco 2.0模型都包含較大的烴類分子,本研究只使用其中的C3亞種群物種以及相應的反應。由于只有少量到達壁面的活性離子被吸附,因此假定活性離子到壁面的擴散速度遠遠大于壁面對活性離子的吸附速度[33]。此外,假設在壁面上活性離子的濃度與氣相中的濃度是一致的,因此假設反應系統是空間均勻的[29]。
活性離子在壁面上通過式(1)反應被吸附
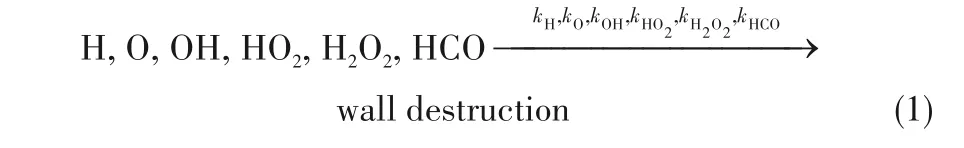
單位體積的等效反應速率常數kH,kO,kOH,kHO2,kH2O2和kHCO由式(2)確定

式中,vˉ=(8kBT/πm)1/2是活性離子在溫度T下的熱運動平均速度;m是摩爾質量;kB是玻爾茲曼常數。黏附系數ε表示與壁面碰撞時的吸附速率,通常玻璃或石英容器材料的ε≈10-5~10-2[33]。
控制系統是否爆炸的主要參數有燃燒室的形狀和大小,活性離子的黏附系數,氣體總濃度、溫度,燃料和氧氣的摩爾分數等因素。在本文中采用球形燃燒室,其直徑為2r=0.074 m,表面積與體積比S/V=3/r。
根據《中醫臨床診療術語證候部分》[11] 中所羅列的如對火熱證、血虛證、氣虛證、陽虛證等各證候的表現,由2名中醫專業研究生對篩選出的500例郁證病歷進行中醫證候要素的提取。
2 結果與分析
2.1 爆炸極限的驗證與計算
為確定數值計算中采用的化學動力學模型,將SENKIN程序計算的丙烷/氧氣混合氣的爆炸極限與Newitt等[34]實驗數據進行對比,如圖1所示。此外,由于實驗數據采集時間較長(大部分在30~150 s之間),因此為與實驗數據采集時間保持一致,圖1中的計算反應時間設置為60 s。實驗和計算結果表明,爆炸壓力隨溫度的升高呈現出非單調下降的趨勢。在溫度范圍為580~750 K,出現負溫度系數特性。爆炸極限曲線的計算結果與實驗結果略有偏差,主要是由于實驗中的爆炸判據是基于甲醛(CH2O)的化學發光,而計算中的爆炸判據為溫度的升高量。如圖1所示,以爆炸極限曲線上的兩個拐點為邊界,C3H8/O2混合氣在溫度區間內共有三個爆炸極限。對于C3H8/O2混合氣的第三爆炸極限即低溫區域,臨界壓力隨溫度的升高而單調降低,主要由于隨著溫度的升高鏈分支反應增強。然而在中溫區域,即第二爆炸極限,隨著混合氣溫度的增加,觸發爆炸需要較高的臨界反應物濃度(較高的壓力),即在中溫度區域存在NTC行為。可以看出四種反應機理預測的爆炸極限均出現了NTC現象,且第一與第三爆炸極限有著相同的變化趨勢。由于Aramco 2.0與KAUST機理C3高壓反應速率常數幾乎相同,因此在中低溫區域兩個機理計算的爆炸極限基本保持一致,但是計算的爆炸極限始終高于實驗值。UCSD機理與Methane/Propane機理計算的第二爆炸極限值略低于實驗值,UCSD機理與Methane/Propane機理計算的第二爆炸極限與第三爆炸極限拐點的溫度分別為600和585 K,實驗值為581 K。與Aramco 2.0機理、KAUST機理以及UCSD機理的計算結果相比,Methane/Propane機理在接下來主要研究的第二爆炸極限處的計算誤差較小。此外,Methane/Propane化學反應機理在甲烷/丙烷混合氣的不同組分下,計量比從稀混合氣(計量比為0.5)到化學計量比以及濃混合氣(計量比為3.0),壓力區間為5.3~31.4 atm(1 atm=101325 Pa)的綜合條件下對滯燃期進行驗證,結果取得了計算與實驗的一致準確性[32],且涵蓋了本文的主要工況。因此,下文中將采用Methane/Propane機理展開研究。
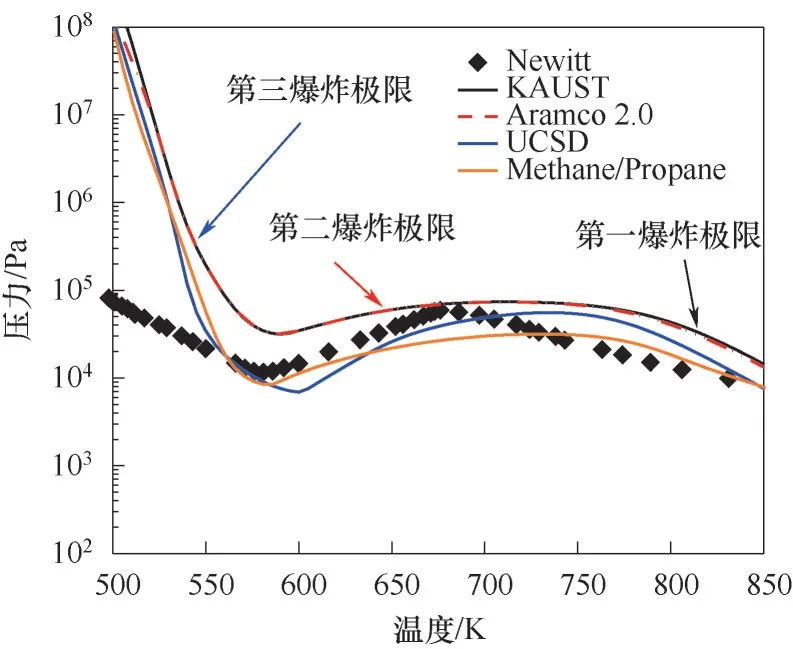
圖1 等分子的丙烷/氧氣冷焰爆炸極限機理驗證Fig.1 Comparison of the calculated and experimental cool flame explosion limit of equimolecular C3H8/O2 mixtures
2.2 化學反應時間對丙烷爆炸極限的影響
為探究化學反應時間對C3H8/O2混合氣冷焰爆炸極限的影響,計算了在化學計量比下的C3H8/O2混合氣在不同反應時間的冷焰爆炸極限,如圖2所示。隨著化學反應時間的增加,C3H8/O2混合氣爆炸極限整體向低壓、低溫區域移動。當化學反應時間在前120 s內時,隨著化學反應時間的增加,爆炸極限的壓力及溫度降低趨勢較為明顯。當化學反應時間為150 s以上時,爆炸極限的壓力及溫度的變化較為緩慢。同時,反應時間為150與180 s的爆炸極限曲線幾乎重合,表明反應時間對爆炸極限的影響幾乎消失。此外,在低溫區域,壓力的降幅明顯要大于中溫區域。隨著化學反應時間的增加,NTC區域的下拐點(第二爆炸極限與第三爆炸極限分界點)逐漸向低溫、低壓區域移動,而NTC區域上拐點(第一爆炸極限與第二爆炸極限分界點)的溫度與壓力的變化較小。當化學反應時間在60 s內時,NTC區域上拐點的溫度幾乎沒有發生變化,但隨著反應時間的增加向低壓區域移動。當化學反應時間在90 s以上時,NTC區域上拐點的溫度與壓力基本保持穩定。整體看來,隨著化學反應時間的增加,C3H8/O2混合氣的NTC區域呈現出不斷增大的趨勢。雖然反應時間的增加會引起爆炸極限的移動,但是由于實際反應裝置中混合氣的反應時間較短,10 s的反應時間與實際化學反應特征時間相比已經足夠大,為充分研究其化學反應進程,因此在后文的研究中化學反應時間均設置為10 s。
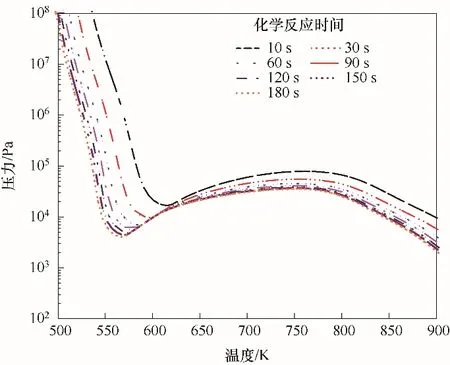
圖2 反應時間對化學計量比下C3H8/O2混合氣冷焰極限的影響Fig.2 Effect of induction period on the cool flame limits of stoichiometric C3H8/O2 mixtures
2.3 甲醇對丙烷爆炸極限的影響
如圖3所示為化學計量比下C3H8/O2混合氣的冷焰爆炸極限及熱焰爆炸極限隨甲醇摩爾分數的變化規律。其中熱焰爆炸的判斷標準為在反應時間10 s內混合氣溫度能夠升高400 K的工況[23],冷焰爆炸的判斷標準為在反應時間10 s內混合氣溫度能夠升高50 K的工況。圖3中定義(P1,T1)為冷焰第一爆炸極限和第二爆炸極限的分界點,(P11,T11)為熱焰第一爆炸極限和第二爆炸極限的分界點,(P2,T2)為冷焰第二爆炸極限和第三爆炸極限的分界點,(P22,T22)為熱焰第二爆炸極限和第三爆炸極限的分界點,統稱(P1,T1)和(P11,T11)為上拐點,(P2,T2)和(P22,T22)為下拐點。對于冷焰爆炸極限,隨著添加CH3OH摩爾分數的增加,其爆炸極限曲線向高壓區域移動。在NTC區域,當添加CH3OH摩爾分數低于10%時,下拐點的壓力升高量較小。當添加CH3OH摩爾分數高于20%時,下拐點的壓力升高量開始逐漸增大。但下拐點的溫度變化較小。然而上拐點的溫度與壓力隨著CH3OH摩爾分數的增加幾乎沒有變化,即CH3OH的摩爾分數對上拐點的位置變化基本上是沒有影響的。整體看來,隨著CH3OH摩爾分數的增加,C3H8/CH3OH/O2混合氣的NTC區域是不斷減小的。對于熱焰爆炸極限,其變化規律與冷焰爆炸極限的一致,其上拐點隨CH3OH摩爾分數增加保持不變,但是其下拐點隨著添加CH3OH摩爾分數的增加溫度增加的趨勢較為明顯。
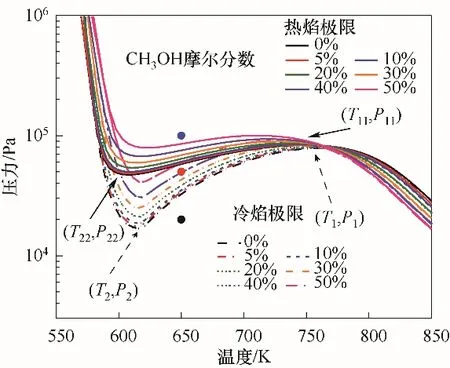
圖3 甲醇對化學計量比下的C3H8/O2混合氣冷焰和熱焰極限的影響Fig.3 Effect of methanol on the cool flame and hot flame limits of stoichiometric C3H8/O2 mixtures
為進一步分析不同爆炸區域的反應過程,沿650 K等溫線,選取壓力為2×104、5×104和105Pa的工況點,在圖3中分別由黑色、紅色、藍色點標記,分別代表無爆炸、冷焰和熱焰三種工況,并分別提取三種工況下的溫度及壓力變化數據。如圖4(a)和(b)所示為C3H8/(30%)CH3OH/O2混合氣在三種典型工況下的溫度和壓力變化規律。對于非爆炸工況,在反應時間內未能進行快速反應,因此溫度和壓力曲線變化較為平緩。在冷焰區,壓力和溫度曲線呈現緩慢上升的趨勢,但整體升高量均比較小,在反應時間10 s內混合氣的溫度升高為71 K。此外,熱焰工況下,混合氣的溫度和壓力曲線具有典型的兩段著火特性,如圖4(a)和(b)所示。在0.9 s左右出現第一階段的溫度及壓力升高現象,在3.06 s左右出現第二階段的溫度及壓力急劇升高現象。
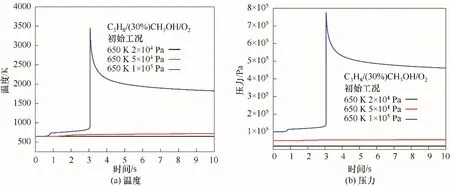
圖4 無爆炸、冷焰和熱焰區域的溫度與壓力對比Fig.4 Comparison of the temperatures and pressures under non-explosion,cool flame and hot flame regions
圖5為無爆炸、冷焰和熱焰三個典型工況下丙烷、甲醇和甲醛在反應過程中的摩爾分數變化情況。在非爆炸工況下初始壓力較低,在反應時間內反應較為緩慢,因此丙烷和甲醇的消耗較小,幾乎沒有甲醛生成。對于冷焰工況下,丙烷在1 s以后的消耗較為明顯,在10 s的反應時間內被消耗掉約7%。同時,甲醇也在1 s左右開始參與反應,在反應時間內的消耗量約為9%。此外,在反應開始1 s后,逐漸有甲醛生成,整體生成量較少(約為0.01 mol)。對于熱焰工況下,在反應第一階段0.85 s前約有0.01mol的丙烷參與反應,在0.85~3.0 s內丙烷的消耗量約為15%,在3 s左右,由于出現熱焰現象,剩余的丙烷被快速消耗。甲醇的反應進程基本與丙烷的反應進程保持一致。在0.85 s產生少量的甲醛,此后甲醛生成量急劇增長,并在3.07 s附近達到其峰值(約為0.0236 mol)。但由于第二階段反應溫度較高,甲醛隨即被完全消耗。
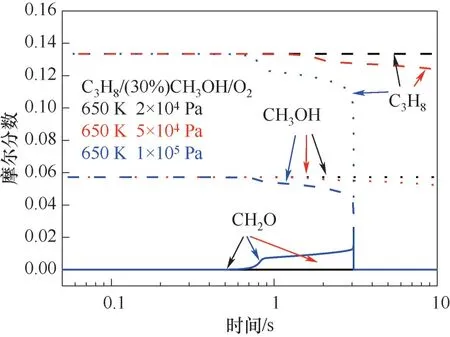
圖5 無爆炸、冷焰和熱焰區域的主要組分含量對比Fig.5 Mole fractions of the main species under non-explosion,cool flame and hot flame regions
圖6對比了C3H8/(30%)CH3OH/O2混合氣中冷焰和熱焰工況下主要的產熱反應。在這兩種工況下,放熱反應主要是丙烷的低溫反應,包括丙烷與OH自由基的脫氫反應、i-C3H7O2的分解反應以及n-C3H7O2的異構化反應。在冷焰工況下,還包括CH3和CH3O的加氧反應,如圖6(a)所示。此外關于熱焰工況,高壓環境下CH3OH的鏈傳遞反應加劇,首先CH3OH與HO2反應生成CH2OH,CH2OH的加氧反應生成CH2O,CH2O進一步與HO2反應生成HCO與H2O2,HCO的加氧反應生成CO和HO2,如圖6(b)所示。此外,對比分析圖6(a)、(b)可知,在熱焰工況下相同反應的熱釋放率遠遠高于冷焰工況下的熱釋放率。
為進一步驗證CH3OH是否能夠改變C3H8/O2的反應路徑,降低C3H8/O2混合氣中溫條件下的反應活性,針對圖6中出現的CH3OH的鏈傳遞的相關放熱反應中HO2的主要生成與消耗反應的正向與反向速率比進行計算分析,反應初始條件為650 K,5×104Pa下的C3H8/O2和C3H8/(30%)CH3OH/O2混合氣,如圖7所示。從圖7可知,CH3OH在該溫度區間下的鏈傳遞反應即R94:CH3OH+HO2CH2OH+H2O2;R71:CH2OH+O2CH2O+HO2;R47:CH2O+HO2HCO+H2O2;R27:HCO+O2CO+HO2。在反應初始時刻正反應速率遠遠大于逆反應速率,隨著反應的進行,正、逆反應的速率比逐漸趨于常數。其中,在甲醇的鏈傳遞反應中,C3H8/(30%)CH3OH/O2混合氣中的HO2消耗反應R94、R47的反應速率比略大于C3H8/O2的速率比,但兩種混合氣中兩個反應的最終反應速率比基本一致。特別注意的是,關于HO2的生成反應R71,在C3H8/O2中僅在反應初始時刻速率比小于1,隨后速率比等于1。而在C3H8/(30%)CH3OH/O2混合氣中,在反應初始時刻R71的反應速率比較大,伴隨著反應的進行正逆反應速率比逐漸降低并趨于穩定,在反應進程趨于穩定時,正逆反應的速率比仍為70左右。即在甲醇的鏈傳遞反應中,HO2的生成量遠大于其消耗量。同樣對于HO2的生成反應R27,C3H8/(30%)CH3OH/O2混合氣在反應時間1 s后的反應速率比始終大于C3H8/O2混合氣的反應速率比。這表明,混合氣添加的甲醇促進了HO2的生成,從而增加了丙烷與HO2反應比例。
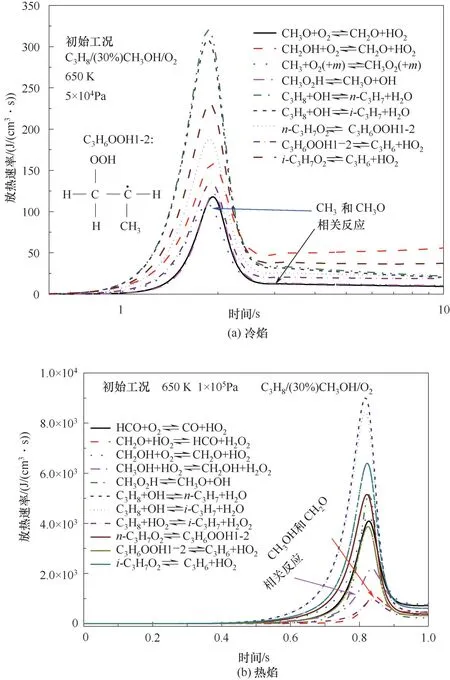
圖6 主要反應的放熱速率Fig.6 Heat release rates of the main reactions
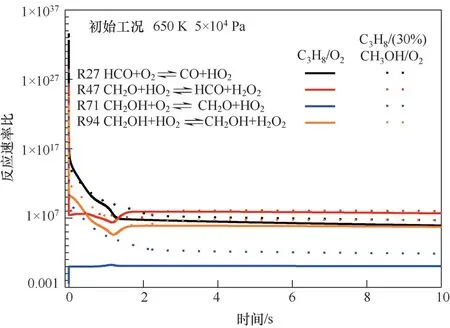
圖7 650 K、5×104 Pa下C3H8/O2和C3H8/(30%)CH3OH/O2混合氣中HO2主要反應速率比Fig.7 The forward and backward reactions ratios of the HO2 main reactions at 650 K,5×104 Pa under C3H8/O2 and C3H8/(30%)CH3OH/O2 mixtures
2.4 反應路徑分析
為進一步確定甲醇對C3H8/O2混合氣第二爆炸極限內氧化進程的影響,如圖8所示,分別針對C3H8/O2以及C3H8/(30%)CH3OH/O2混合氣的冷焰以及熱焰極限內典型特征點(650 K,5×104Pa)、(650 K,1×105Pa)的氧化反應路徑進行分析,其中反應路徑分析工況點溫度為700 K。圖8中藍色為700 K,5×104Pa下C3H8/O2混合氣的反應路徑;紅色為700 K,5×104Pa下C3H8/(30%)CH3OH/O2混合氣的反應路徑;綠色為700 K,1×105Pa下C3H8/O2混合氣的反應路徑;紫色為700 K,1×105Pa下C3H8/(30%)CH3OH/O2混合氣的反應路徑。圖中僅標注出反應量超過1%(相對于總反應量)的反應路徑。H2O28定義為H2O2經過反應式(1)在壁面上吸附的失效產物。從圖8可見,丙烷主要有兩條平行反應路徑,即丙烷通過與OH和HO2活性基團完成脫氫反應生成i-C3H7和n-C3H7,其中n-C3H7通過加氧反應生成n-C3H7O2,n-C3H7O2主要有三條反應路徑;i-C3H7通過加氧反應生成i-C3H7O2,i-C3H7O2主要有兩條反應路徑。對比藍色與紅色反應路徑可知,添加30%的甲醇時,丙烷的兩條主要平行反應路徑沒有發生變化,C3H8/O2以及C3H8/(30%)CH3OH/O2混合氣中丙烷的相對脫氫總反應量分別為95.7%和95.5%,在C3H8/O2混合氣中丙烷的脫氫反應主要通過與OH的反應進行(比例為88.3%),然而混合氣中甲醇摩爾分數的增加促進了丙烷與HO2的脫氫反應(比例為31.2%)的進行,丙烷與OH反應比例有所降低。但是混合氣中甲醇摩爾分數的增加會導致整體的反應進程減緩,相較于C3H8/(30%)CH3OH/O2混合氣,C3H8/O2中的i-C3H7O2進一步反應生成C3H6OOH2-1,C3H6OOH2-1與HO2反應生成C3H6;C3H8/O2中的n-C3H7O2進一步反應生成C3H6OOH1-3。然而,在C3H8/(30%)CH3OH/O2混合氣中,增加了丙烷與HO2反應生成H2O2的反應路徑,H2O2在壁面上的吸附進程有所體現。對比綠色與紫色反應路徑可知,混合氣中甲醇摩爾分數的增加輕微促進了丙烷以及i-C3H7O2、n-C3H7、n-C3H7O2分別與HO2的反應,相較于5×104Pa,高壓1×105Pa下促進與HO2的反應的作用有所降低。這個結果與圖6中分析結果保持一致,均證實了甲醇促進了HO2的生成,從而改變C3H8/O2的中溫反應路徑。
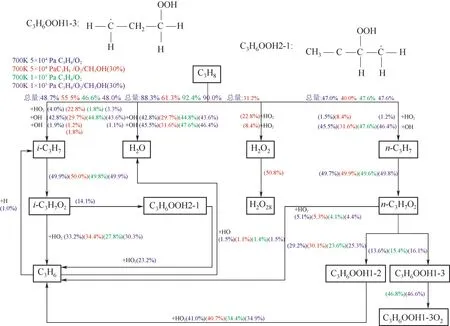
圖8 反應路徑分析:(700 K,5×104 Pa)工況點下,藍色為C3H8/O2混合氣,紅色為C3H8/(30%)CH3OH/O2混合氣;(700 K,1×105 Pa)工況點下,綠色為C3H8/O2混合氣,紫色為C3H8/(30%)CH3OH/O2混合氣Fig.8 The reaction pathway analysis of C3H8/O2 mixtures(Blue symbols)and with 30%CH3OH addition of C3H8/O2 mixtures(Red symbols)at(700 K,5×104 Pa)condition and,C3H8/O2 mixtures(Green symbols)and with 30%CH3OH addition of C3H8/O2 mixtures(Violet symbols)at(700 K,1×105 Pa)condition
2.5 NTC拐點敏感性分析
為確定控制爆炸極限曲線拐點的主要反應,對爆炸極限拐點進行了敏感性分析。敏感性系數表示拐點的溫度和壓力對化學動力學模型中主要基元反應的依賴程度。其中,敏感性系數的計算方法是將各基元反應速率的前置因子A施加50%的擾動,然后根據式(3)可以計算出歸一化敏感性系數。
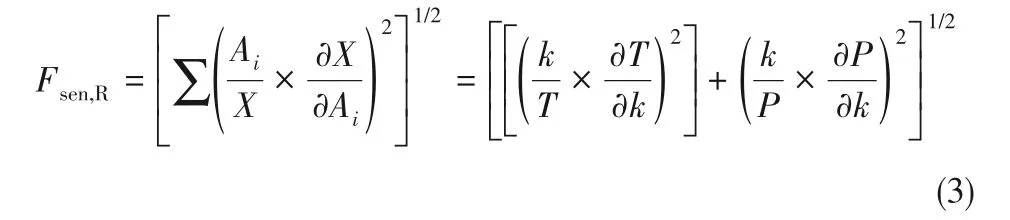
式中,Ai是第i個反應的反應速率系數的A因子;X是拐點的溫度或壓力。
采用0.5 K的步長搜索拐點的溫度,并添加50%的速率系數擾動以保證拐點溫度的變化。如圖9所示為甲醇摩爾分數為0、30%和50%的C3H8/O2混合氣NTC下拐點的主要基元反應歸一化敏感性系數。其中,反應最敏感的有丙烷與羥基(OH)反應引起的C3H8脫氫反應,C3H7O2的異構化生成C3H6OOH。C3H8的其他低溫鏈分支反應進程主要包括:C3H8分別與OH、HO2和CH3CO3進行脫氫反應;C3H7O2的異構化生成C3H6OOH;C3H6OOH的加氧反應生成過渡態環狀的C3H6OOHO2;C3H6OOHO2的進一步分解生成C3-ket ohy droperoxide酮基過氧化物(C3ket,C3ket21、C3ket13、C3ket12為同分異構體)與OH;C3ket再分解生成OH自由基和CH2O。此外,在甲醇摩爾分數為30%和50%時,CH3OH開始分別與OH自由基和H離子進行反應,與C3H8和OH的脫氫反應形成競爭,引起下拐點的壓力變化。這表明,下拐點主要由C3H8的低溫鏈分支反應所控制。
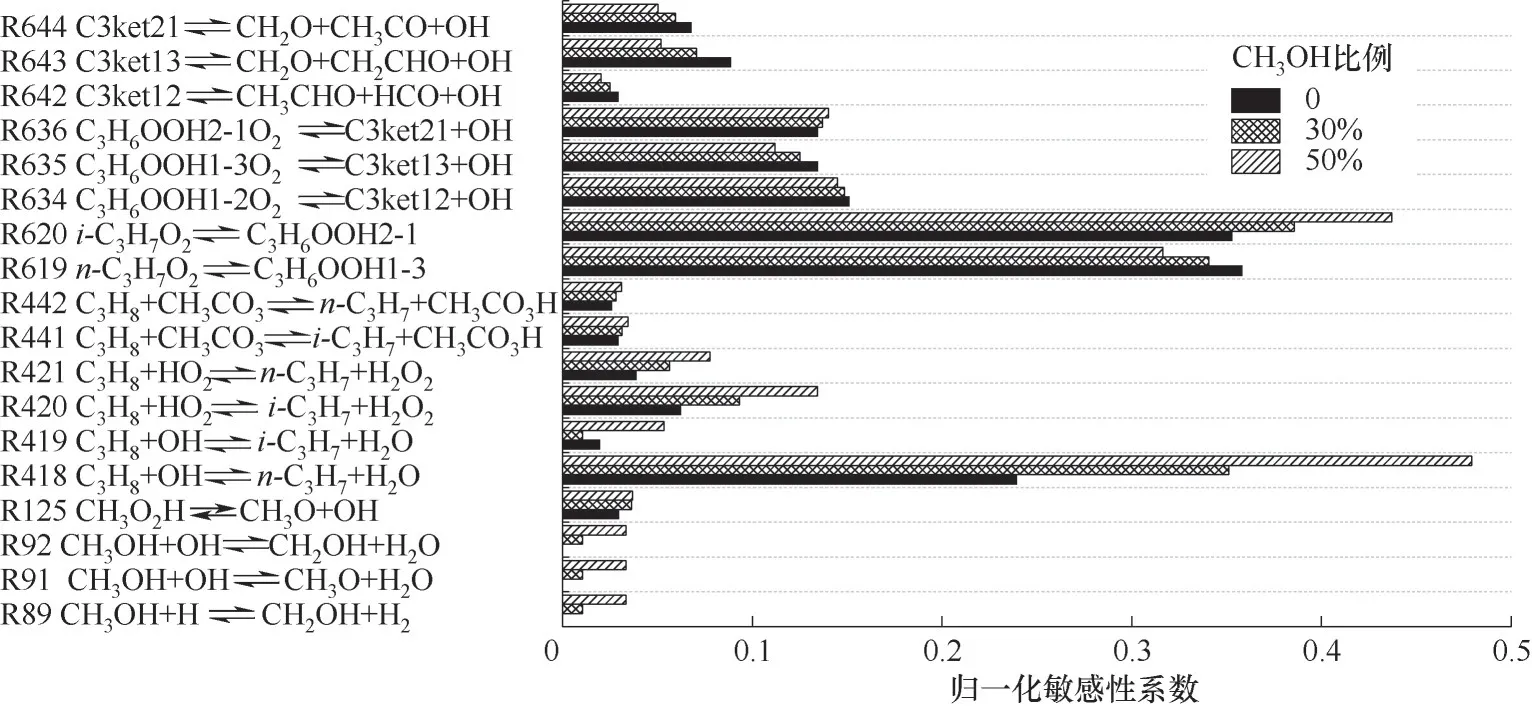
圖9 C3H8/CH3OH/O2混合氣下拐點的主要反應的敏感性Fig.9 Thesensitivity of the main reactions on the lower turnover point for C3H8/CH3OH/O2 mixtures
上拐點的主要基元反應的敏感性系數如圖10所示。其中,對于上拐點影響較大的反應主要有C3H7O2的異構化生成C3H6OOH,C3H6OOH的加氧反應,以及C3H7O2和C3H6OOH一系列產生HO2的分解反應。由于溫度升高,混合氣的整體反應進程加快,分解反應比O2加成反應更活躍,導致上、下拐點的敏感性存在差異。因此,上拐點是由O2的加入來控制產生HO2自由基進而控制上拐點的敏感性。
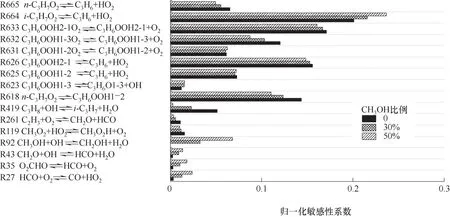
圖10 C3H8/CH3OH/O2混合氣上拐點的主要反應的敏感性Fig.10 The sensitivity of the main reactions on the upper turnover point for C3H8/CH3OH/O2 mixtures
3 結 論
本文對C3H8/CH3OH/O2混合氣在爆炸極限(溫度-壓力)下NTC特性進行了理論和計算分析,得出主要結論如下。
(1)在NTC區域,隨著混合氣中CH3OH摩爾分數的增加,下拐點的壓力逐漸向高壓區域移動,但下拐點的溫度保持不變。而在C3H8/O2混合氣中添加CH3OH對上拐點的位置變化沒有影響。隨著混合氣中CH3OH摩爾分數的增加,C3H8/O2混合氣的NTC區域是不斷減小的。
(2)熱焰工況下的溫度和壓力曲線具有典型的兩段著火特性。在冷焰和熱焰工況下,C3H8低溫反應路徑上的反應為主要放熱反應,包括C3H8與OH自由基的脫氫反應、i-C3H7O2的分解反應以及n-C3H7O2的異構化反應。此外,CH3OH鏈傳遞反應促進HO2的生成,加快了丙烷與HO2脫氫反應的進程。
(3)敏感性分析表明,下拐點主要由C3H8的低溫鏈分支反應所控制。上拐點是由O2的加入來控制產生HO2自由基從而控制上拐點的敏感性。
本文計算的C3H8/CH3OH/O2混合氣的爆炸極限界定了混合氣的慢速反應與快速反應區域,為開發新型燃燒模式提供了參考依據,有利于丙烷/甲醇新型替代燃料在壓燃式及點燃式發動機中的應用。此外,混合氣NTC特性的控制點與主要控制反應為簡化化學動力學機理提供了理論支撐。

