剖宮產瘢痕妊娠刮宮術后再入院治療的影響因素分析
張 艷,徐曉慧,王 君,宋 濤
(濰坊市婦幼保健院婦產科,山東 濰坊 261011)
剖宮產瘢痕妊娠(cesarean scar pregnancy,CSP)是剖宮產的遠期并發癥,近幾年其發生率明顯上升[1-2]。CSP的治療分為手術治療和保守治療。彩超或宮腔鏡下刮宮術的安全性和有效性已經得到了臨床實踐的驗證,所以成為CSP治療最常用的方法[3]。但是,其中部分CSP患者刮宮術后仍有組織殘留。殘留的組織里不僅包含妊娠組織,還包含大量出血性壞死組織,若能自行吸收不需要處理,但若持續存在可能引起無法控制的大出血,最終導致子宮切除[4],因此需要再入院治療。本研究對濰坊市婦幼保健院的部分CSP患者的臨床資料進行了分析總結,目的是探討CSP患者刮宮術后再入院治療的影響因素。
1資料與方法
1.1一般資料
收集濰坊市婦幼保健院2016年1月至2020年1月期間住院治療的225例確診為CSP并行刮宮術患者的臨床資料。初次行刮宮術后再次入院的CSP患者設為再入院組,共45例;再入院組的每例病例,選擇4例同期被確診為CSP的刮宮術后沒有組織殘留的患者作為對照組,共180例。
1.2納入排除標準及分型
納入標準:①符合2016年專家共識中的CSP診斷標準;②臨床資料完整。排除標準:①臨床資料不完整者;②宮頸妊娠、不全流產者;③治療未終結者。
CSP分為兩種類型,Ⅰ型為內生型,孕囊種植于瘢痕宮腔側,向宮腔方向生長;Ⅱ型為外生型,孕囊種植于剖宮產瘢痕缺陷處,向膀胱及腹腔生長。
1.3資料收集
回顧性收集研究對象的臨床資料,包括年齡、孕次、孕周、與前次剖宮產間隔時間、孕囊大小、瘢痕處肌層厚度、術前血人絨毛膜促性腺激素(human chorionic gonadotropin,hCG)水平、術后血hCG下降率、子宮動脈栓塞的預防使用率、術中出血量等。
1.4刮宮術前的預處理方法
患者刮宮前的預處理方法分為兩種:①口服米非司酮和米索前列醇后行彩超引導下刮宮術;②子宮動脈栓塞術后行彩超引導下刮宮術。225例CSP患者,采用第一種方法的有123例,采用第二種方法的有102例。45例再入院治療的CSP患者重新入院間隔時間為(4.8±1.3)個月。
1.5再入院治療情況
45例CSP患者從初次刮宮到重新入院的平均時間為(22.6±7.3)天,其中有35例CSP患者給予二次手術(18例接受了宮腔鏡下殘余妊娠組織切除術,8例進行了腹腔鏡瘢痕妊娠組織切除術,9例再次進行了超聲引導下刮宮術),其余10例CSP患者肌注甲氨蝶呤保守治療。
1.6統計學方法
采用SPSS 16.0進行數據分析,計數資料比較采用χ2檢驗,計量資料比較采用t檢驗。用Logistic回歸分析CSP刮宮術后重新入院的高危因素。P<0.05為差異有統計學意義。
2結果
2.1兩組一般資料的比較
再入院組孕周與孕囊最大直徑均大于對照組,差異均有統計學意義(P<0.05)。再入院組瘢痕處肌層較對照組薄,Ⅱ型的比例(17.8%)明顯高于對照組(6.7%),差異均有統計學意義(P<0.05)。兩組血hCG術前比較差異無統計學意義(P>0.05),但術后血hCG下降速率對照組高于再入院組(P<0.05),見表1。
表1 兩組患者一般資料比較
2.2 CSP刮宮術后再入院治療的Logistic回歸分析
將有統計學意義的因素進行Logistic回歸分析,結果顯示,孕囊(OR=1.481,95%CI:1.281~2.645)、瘢痕處肌層厚度(OR=1.426,95%CI:1.165~4.823)、血hCG(OR=1.693,95%CI:1.147~2.896)是影響CSP初次刮宮術后重新入院治療的獨立危險因素(P<0.05)。
2.3 ROC曲線分析
孕囊ROC曲線下面積(area under curve,AUC):0.733,95%CI:0.653~0.813,孕囊最大直徑等于2.75cm時,AUC為最大值,見圖1。瘢痕處肌層厚度AUC:0.878,其95%CI:0.813~0.943,瘢痕處肌層厚度等于2.95cm時,AUC為最大值,見圖2。血hCG下降速率AUC:0.819,其95%CI:0.758~0.881,其等于62.50%時,AUC為最大值,見圖3。

圖1 孕囊ROC曲線
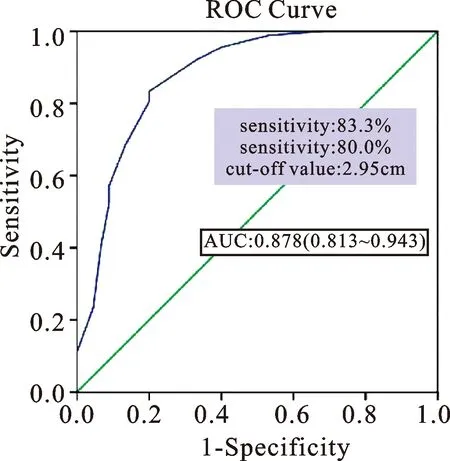
圖2 瘢痕處肌層厚度ROC曲線
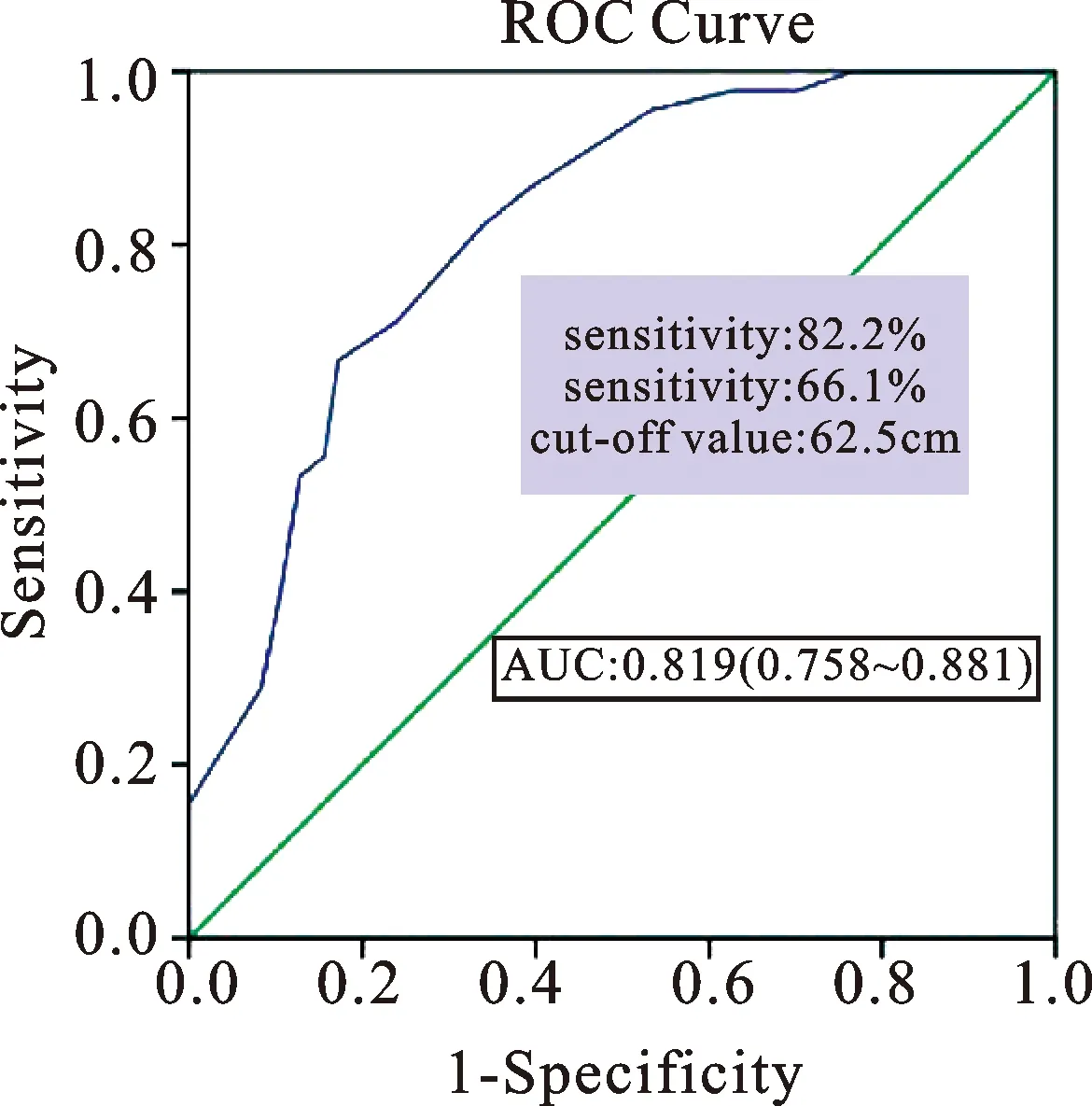
圖3 血hCG下降速率的ROC曲線
3討論
3.1 CSP治療的現狀
CSP是一種特殊的異位妊娠,如果不能及早診治,可能導致患者大出血,甚至休克[5]。因此,CSP明確診斷后需盡早終止妊娠。目前,CSP的治療方式主要有彩超引導下刮宮術、甲氨蝶呤化療及宮腹腔鏡手術治療等。彩超引導下刮宮術因創傷小,住院時間短等優勢成為CSP常見且有效的治療方式[6]。
3.2 CSP治療效果的評價
CSP刮宮術后需定期進行彩超及血hCG監測。我們在臨床工作中發現,刮宮術后CSP組織殘留(persistent cesarean scar pregnancy,PCSP)的病例不斷增加。刮宮術后組織殘留的發生率為4.31%~6.03%(7/116)[7]。
PCSP不僅包含妊娠組織,而且還包含大量出血性壞死組織,周圍的瘢痕組織難以吸收的情況下,長時間的陰道出血可能是繼發于感染的,并且可能對以后的懷孕產生不利影響,藥物保守治療不是最佳的治療方案,因為隨時可能出現陰道大流血的風險,最終可能導致子宮切除,所以需要進一步治療。還有一種情況是,殘留的妊娠組織可能繼續生長,彩超下顯示包塊類似于滋養細胞腫瘤,容易誤診,從而應用不必要的化學治療。明確引起CSP刮宮術后再次入院治療的高危因素,在臨床工作中對提高治療效果具有重要的意義。
3.3 CSP再次入院治療的因素
孕囊是懷孕期間胚胎的最初形態,屬于原始的胎盤組織,初級卵黃囊不斷發育在胚外中胚層形成血管及原始生殖細胞并形成孕囊[8]。CSP由于瘢痕處組織彈性欠佳,孕囊在發育的過程中易出現不規則形態發育,并引起陰道流血[9]。孕囊越大,里面所含的絨毛也多,所以組織殘留的概率也越大。并且孕囊直徑的增加通常伴隨著孕齡的增加,孕囊周圍的滋養層血流量也相應增加,這也增加了刮宮的難度同時也增加了殘留的可能性。并且,CSP孕囊直徑越大刮宮術后不良結局的發生率越大。本研究結果表明,孕囊的最大直徑≥2.75cm是影響CSP刮宮后再入院治療的高危因素。
剖宮產處瘢痕肌層厚度也是影響CSP刮宮后再入院治療的高危因素。子宮瘢痕主要由于切緣粘附,平滑肌再生形成新的組織血管,新的組織肌肉在子宮恢復期變得肌化,進一步變成子宮瘢痕[10]。子宮瘢痕厚度越大,瘢痕處肌肉強度越大[11]。正常孕婦在妊娠過程中子宮下段前壁不會明顯變薄,而瘢痕子宮在妊娠過程中,隨著孕周的增加,前壁下段厚度會逐漸變薄[12]。絨毛組織位于瘢痕部位,手術醫生在刮宮過程中可能導致子宮穿孔的風險增加。特別是妊娠囊接近子宮漿膜時,組織殘留的可能性明顯增加。對于瘢痕肌層厚度≤2.95mm的CSP患者,子宮動脈栓塞后行宮腔鏡下刮宮是更為恰當的選擇[13]。
血hCG下降速率≤62.50%也是影響瘢痕妊娠初次刮宮后重新入院的獨立危險因素。有研究表明術后5~10天的血hCG變化是預測持續性異位妊娠的指標[14]。Morse等[15]將術后第1天和第2天的血hCG差值除以術后第1天的血hCG值,即(hCG1-hCG2)/hCG1,當該值大于0.75時排除了預測值為99%陰性的持續性異位病例。本研究結果顯示,術后血hCG下降速率對PCSP有較好的預測值,血hCG下降速率等于62.50%時,其預測值最佳。若CSP患者刮宮術后第1天血hCG下降小于62.50%,我們應予以重視,必要時給予藥物補充治療。
綜上所述,孕囊、瘢痕處肌層厚度、血hCG下降速率是影響瘢痕妊娠初次治療后重新入院的獨立危險因素。雖然孕周不是影響CSP再入院治療的獨立危險因素,但是有些危險因素確實與孕周的增加有關。所以我們要做到盡早診斷,從而可以及時治療,減少PCSP的發生。對于孕囊最大直徑≥2.75cm、瘢痕處肌層厚度≤2.95mm、hCG下降速率≤62.50%的剖宮產瘢痕患者,應予以重視,適當給予干預,減少患者再次入院治療的發生率。
本研究存在的不足之處是樣本量有限,可能無法準確評估CSP患者刮宮術后PCSP的危險因素。此外,這是一項回顧性病例對照研究,治療方式的選擇受醫生專業技術水平、患者經濟水平及對疾病的重視程度等多方面的影響,有較大的選擇偏倚,為進一步探究,需要增加樣本含量,延長隨訪時間。

