煙草葉片數雜種優勢表現及其相關基因差異表達分析
滕建輝 喻奇偉 熊晶 莫澤君 柯漁洲 陳倩 羅雯 張倩 王飛雁 劉仁祥


摘要:【目的】探究煙草葉片數雜交優勢表現,并分析煙草葉片數相關基因的差異表達情況及雜種優勢形成的原因,為深入研究煙草葉片數的分子遺傳基礎和選育葉片數較多的雜交種提供理論依據。【方法】以葉片數差異較大的 9個煙草品種(系)為親本,按照NCⅡ遺傳交配設計組配20個雜交組合,并測定親本和雜交組合的葉片數,計算其雜種優勢,從中篩選出強、弱優勢組合,利用實時熒光定量PCR檢測其葉片相關基因BRI1、BSK3、FLC、FPF1和PHYC的相對表達量。最后,對葉片數相關基因中親表達優勢間及其與葉片數中親優勢進行相關分析。【結果】9個親本材料的葉片數為20.33~33.22片,以GDH94的葉片數最多,其次是南江三號和畢納1號,三者間無顯著差異(P>0.05,下同),但GDH94顯著高于其余6個親本(P<0.05,下同),表明供試親本間的葉片數存在真實的遺傳差異。20個雜交組合的葉片數存在明顯差異,為20.89~31.33片,以GDH94×南江三號的葉片數最多,以NC82×青梗的葉片數最少,說明采用雜種優勢育種方法可選育出煙草葉片數較多的雜交種。20個雜交組合葉片數的雜種優勢差異較大,其中中親優勢為 -14.71%~11.77%,表現為正向中親優勢和負向中親優勢的組合分別占25%和75%,其中,以K326×GDH88葉片數的正向中親優勢最強,為11.77%,以GDH94×湄潭大蠻煙葉片數的負向中親優勢最強,為-14.71%;NC82×南江三號葉片數的中親優勢最弱,為-0.22%,故選擇K326×GDH88和GDH94×湄潭大蠻煙為強優勢組合、NC82×南江三號為弱優勢組合。不同葉片數相關基因的中親表達優勢之間存在一定的相關性,其中BRI1和BSK3基因的中親表達優勢之間存在顯著正相關;FPF1和PHYC基因的中親表達優勢與葉片數雜種優勢存在顯著負相關。FPF1基因在正向強優勢雜交組合K326×GDH88和弱優勢組合NC82×南江三號中較其相應親本下調表達,但負向強優勢組合GDH94×湄潭大蠻煙較其親本上調表達。PHYC基因在正向強優勢組合K326×GDH88和弱優勢組合NC82×南江三號中較其相應親本下調表達,但在負向強優勢組合GDH94×湄潭大蠻煙較其親本上調表達。【結論】K326×GDH88組合的葉片數雜種優勢最大,具有較大的高產潛力。FPF1和PHYC基因參與調控煙草葉片數雜種優勢的形成,其下調表達是煙草葉片數性狀雜種優勢形成的分子基礎,可指導親本選配,提高煙草雜交選育效率。
關鍵詞: 煙草;葉片數;雜種優勢;基因表達
中圖分類號: S572.035.1? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2021)02-0420-09
Abstract:【Objective】To explore the performance of heterosis of tobacco leaf number, analyze the differential expression of leaf number related genes and the causes of heterosis, so as to provide a theoretical basis for further research on the molecular genetic basis of tobacco leaf number and breeding of hybrid varieties with more leaves. 【Method】Nine tobacco varieties(lines) with large difference in leaf number were as parents,20 hybrid combinations were set according to the NCⅡ genetic mating,and leaf number of parents and hybrid combinations were measure. Calculated the heterosis,the strong and weak dominant combinations were selected. The relative expression of leaf genes BRI1,BSK3,FLC,FPF1 and PHYC were detected using real-time fluorescent quantitative PCR. Finally,the correlation between leaf number related gene expression dominance and leaf number over-parent heterosis was analyzed. 【Result】The number of leaves of the nine parents was 20.33-33.22,and GDH94 had the most,followed by Nanjiang No.3 and Bina No.1. There was no significant difference among the three parents(P>0.05,the same below),but GDH94 was significantly higher than that of the other six parents(P<0.05,the same below), indicating that there was real genetic difference in the number of leaves among the tested parents. There were significant differences in the number of leaves among the 20 hybrid combinations, ranging from 20.89 to 31.33,with the highest number of leaves in GDH94×Nanjiang No.3 and the lowest number of leaves in NC82×Qinggeng,indicating that the hybridization method could be used to breed the hybrid with the appropriate number of leaves. Among the 20 hybrid combinations,the heterosis of the number of leaves was significantly different,of which the over-parent heterosis was -14.71%-11.77%,and the combinations showing positive over-parent heterosis and negative over-parent heterosis accounted for 25% and 75%,respectively. The positive over-parent heterosis of the number of leaves of K326×GDH88 was the strongest(11.77%),and the negative over-parent heterosis of the leaf number of GDH94×Meitandaman tobacco was the strongest(-14.71%). Over-parent heterosis of the leaf number of NC82×Nanjiang No.3 was the weakest(-0.22%). Therefore,K326×GDH88 and GDH94×Meitandaman tobacco were selected as the representative combinations of strong dominance,while NC82×Nanjiang No.3 was selected as the representative combination of weak dominance. There was a certain correlation in the over-parent heterosis among different leaf number related genes, and there was a significant positive correlation between the over-parent heterosis of BRI1 and BSK3 genes.There was a significant negative correlation between the over-parent heterosis of FPF1 and PHYC genes and leaf number heterosis. The expression of FPF1 gene was down-regulated in positive strong dominant hybrid K326×GDH88 and weak dominant hybrid NC82×Nanjiang No.3 compared with their parents,but up-regulated in negative strong dominant hybrid GDH94×Meitandaman tobacco compared with their parents. The PHYC gene expression was down-regulated in positive strong dominance combination K326×GDH88 and weak dominant combination NC82×Nanjiang No.3 compared with their parents,but up-regulated in negative strong dominant combination GDH94×Meitandaman tobacco compared with their parents.【Conclusion】The combination of K326×GDH88 has the highest leaf number heterosis and high yield potential. FPF1 and PHYC genes are involved in the regulation of the formation of tobacco leaf number heterosis,and their down-regulated expression is the molecular basis for the formation of tobacco leaf number heterosis,which can guide the selection of parents and improve the efficiency of tobacco hybrid breeding.
Key words: tobacco; leaf number; heterosis; gene expression
Foundation item: High-level Innovative Talent Training Plan of Guizhou(QKHPTRC〔2016〕5663);Science and Technology Project of Guizhou Tobacco Company(201602,201904,2020XM07)
0 引言
【研究意義】煙草是我國重要的葉用經濟作物。葉片數是煙葉產量的主要構成指標之一,直接影響煙農的經濟收益和卷煙原料的市場供應(左偉標等,2020)。雜種優勢是生物界的一種普通現象,可提高作物產量和品質,在水稻、玉米等作物中已廣泛利用(Chen,2010;王昆等,2018)。雜種優勢形成的原因極其復雜,作物雜種優勢不僅在不同作物間及不同性狀間存在差異,而且同一作物同一性狀也可能因雜交組合和雜交方式及栽培環境不同而存在差異,很難明確顯性、超顯性和上位性效應中哪個在作物雜種優勢中占主導作用(Patrick et al.,2013;Shang et al.,2016;商連光等,2017),難以有效指導優良雜交種的選育和利用。基因型雜合化是雜種優勢產生的物質基礎,雜交種的基因及其互作對雜種優勢表現起決定性作用,但基因必須通過轉錄和蛋白翻譯才能對性狀起調控作用,從mRNA水平上和基因表達調控角度來分析研究雜種優勢的形成機理更為直接和科學(凌亮等,2007;許晨璐等,2013)。因此,研究煙草葉片數雜種優勢表現及相關基因差異表達分析對研究煙草雜種優勢形成的機理具有十分重要的意義。【前人研究進展】目前大量研究結果表明,煙草葉片數受遺傳因素(張興偉等,2012;李顯航,2019;蒲媛媛等,2020)、栽培措施(周俊學等;2016;信俊峰等,2018)、生長調節劑(林姍姍等,2017;蘇暢濤,2020)和生態環境(王紅鋒等,2019;王廷賢等,2019)等因素的影響。煙草葉片數是核基因控制的數量性狀,由2對主效基因與微效多基因共同作用,以加性效應和顯性×顯性上位性效應為主,其遺傳力較高(張興偉等,2012;徐航等,2013;李顯航,2019;蒲媛媛等,2020)。植物葉片數是通過眾多基因在特定遺傳背景和環境條件下相互作用的結果。擬南芥FLC基因在低溫處理下的表達量明顯升高,延遲了開花時間,導致擬南芥葉片數明顯增加(Kim et al.,2004);PHYC基因在短日照條件下高表達抑制了擬南芥開花,增加植株最終葉片數(Franklin et al.,2003);BRI1、BSK3、FLC、FPF1和PHYC基因不僅在擬南芥的花芽分化過程中發揮調控作用,還參與葉片數的調控從而有效影響葉片數(Balasubramanians et al.,2006;羅占春等,2009;王楠,2019)。【本研究切入點】本研究課題組前期研究發現煙草葉片數有較強的雜種優勢,采用雜種優勢利用育種方法育成了品質優良、葉片數具有超親優勢的2個雜交種(劉仁祥等,2016),但對煙草葉片數雜種優勢形成的原因尚不明確,雜交組合的配制仍較盲目。目前鮮見有關煙草葉片數雜種優勢表現及相關基因差異表達分析的研究報道。【擬解決的關鍵問題】以葉片數差異較大的煙草品種(系)為材料,采用NCⅡ遺傳設計組配雜交組合,分析煙草葉片數的雜種優勢表現,篩選強、弱優勢雜交組合,在基因表達水平上探究煙草葉片數雜種優勢形成與基因差異表達間的關系,為合理選配親本從而選育出葉片數較多的雜交種提供指導,以提高煙草雜交種的選育效率,可為闡明作物雜種優勢形成的分子機理打下理論基礎。
1 材料與方法
1. 1 試驗材料
供試親本材料共9個,其中GDH94、南江三號和畢納1號的葉片數較多,湄潭大蠻煙、NC82和青梗的葉片數較少,K326、GDH88和Va116的葉片數居中,均由貴州大學貴州省煙草品質研究重點實驗室提供。RNAprep Pure Plant Kit試劑盒、FastKing gDNA Dispelling RT SuperMix試劑盒和Talent qPCR PreMix(SYBR Green)試劑盒購自天根生化科技(北京)有限公司。主要儀器設備:CFX96 Real-Time System(Bio-Rad,美國)、凝膠成像系統(Bio-Rad,美國)、冷凍離心機(Thermo,美國)和DYCP-44N電泳儀(新諾,中國)。
1. 2 雜交組合配制及田間試驗設計
隨機抽取4個材料為母本,另外5個材料為父本,按照NCⅡ設計配制20個雜交組合(表1),并記錄親本和雜交組合的現蕾時間。試驗于2020年在貴州大學煙草科研基地(安順市西秀區楊武鄉石平村)進行,煙地的土壤肥力中等。于5月3日進行井窖式移栽,田間試驗采用隨機區組設計,3次重復,每小區3行,每行15株,行、株距為1.10 m×0.55 m。四周設保護行,每行第1株和最后1株不進行數據測定,其余栽培管理技術按照《安順市西秀區優質煙葉生產技術方案》執行。
1. 3 葉片數測定方法
待供試材料均進入初花期時,按照YC/T 142—2010《煙草農藝性狀調查測量方法》進行調查記載(中國煙草總公司青州煙草研究所,2010)。每小區隨機選取3株,測定其葉片數,計算平均值。
1. 4 雜種優勢的計算方法
參照陳澤輝(2009)方法計算煙草F1代葉片數的雜種優勢,計算公式如下
中親優勢(%)=(F1-MP)/MP×100
超高親優勢(%)=(F1-HP)/HP×100;
超低親優勢(%)=(F1-LP)/LP×100;
式中,MP表示雙親平均值,HP表示高親值,LP表示低親值,F1表示雜種一代葉片數的平均值。
1. 5 基因表達量的測定
1. 5. 1 樣品采集 參照高凱悅等(2016)的取樣方法,于移栽后25 d(花芽分化關鍵時期),每個材料選定正常生長且長勢一致的3株煙,取其長度為5 cm的莖尖均勻混合,并進行液氮速凍,設置3個生物學重復,樣品保存于-86 ℃的超低溫冰箱中備用。
1. 5. 2 總RNA提取及cDNA合成 采用RNAprep Pure Plant Kit試劑盒提取總RNA,按FastKing gDNA Dispelling RT SuperMix試劑盒說明反轉錄合成cDNA第一鏈。
1. 5. 3 實時熒光定量PCR 在NCBI數據庫中搜索葉片數相關基因,根據其cDNA全長序列,利用Pri-mer 6.0設計各基因引物(表2),并委托北京擎科生物科技有限公司合成。按照Talent qPCR PreMix(SYBR Green)試劑盒說明對這些基因進行實時熒光定量PCR檢測。反應體系20.0 ?L:2×Talent qPCR PreMix 10.0 ?L,上、下引物(10 μmol/L)各0.6 ?L,cDNA模板2.0 ?L,ddH2O補足至20.0 ?L。擴增程序:95 ℃預變性3 min;95 ℃ 5 s;退火溫度(表2)10 s,75 ℃ 15 s,進行40個循環。每個樣品設3次技術重復。
1. 5. 4 表達量的統計方法 以K326為對照,采用比較閾值法(2-ΔΔCt)計算葉片數相關基因(王秀莉等,2009)。根據實時熒光定量PCR測定的Ct值,計算強、弱優勢組合中葉片數相關基因的相對表達量,并據此計算各基因的中親表達優勢,分析其與葉片數雜種優勢的相關性。
中親表達優勢=(F1-雙親平均值)/雙親平均值
式中,F1表示雜交種的相對表達量,雙親平均值表示父本和母本相對表達量的平均值。
1. 6 統計分析
采用Excel 2010和SPSS 20.0對葉片數及其雜種優勢、葉片數相關基因的表達量等進行單因素方差分析和Pearson相關分析。
2 結果與分析
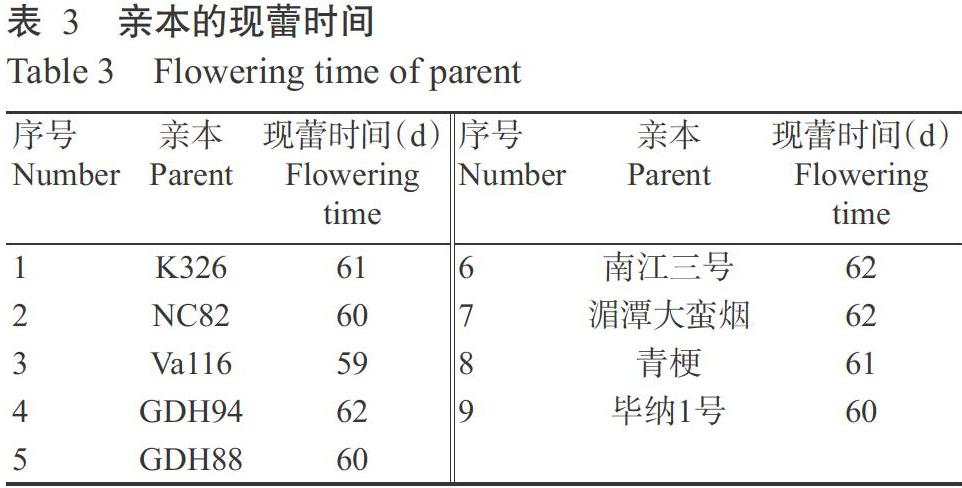
2. 1 親本和雜交組合的現蕾時間測定結果
由表3和表4可知,9個親本材料的現蕾時間為59~62 d;20個雜交組合的現蕾時間為60~64 d,可見,親本與雜交組合材料的現蕾時間無明顯差異,說明各材料花芽分化進程基本一致。由于煙草花芽分化的早晚直接影響其總葉片數,現蕾后才完成煙株花芽分化(胡榮海,2007)。因此,應在煙株花芽分化關鍵時期(移栽后25 d)進行取樣用于基因差異表達研究。
2. 2 親本間及雜交組合葉片數的差異分析結果
由表5可知,9個親本材料的葉片數為20.33~33.22片,以GDH94的葉片數最多,其次是南江三號和畢納1號,三者間無顯著差異(P>0.05,下同),但GDH94顯著高于其余6個親本(P<0.05,下同),以青梗的葉片數最少,表明供試親本間的葉片數存在真實的遺傳差異,可用于葉片數性狀的遺傳利用研究。
由表6可知,20個雜交組合的葉片數為20.89~31.33片,以GDH94×南江三號的葉片數最多,以NC82×青梗的葉片數最少。可見,20個雜交組合葉片數存在明顯差異,說明采用雜種優勢育種方法可選育出煙草葉片數較多的雜交種。
2. 3 煙草葉片數的雜種優勢表現及強、弱優勢材料篩選
20個雜交組合葉片數的雜種優勢如表7所示。不同雜交組合葉片數的雜種優勢差異較大。中親優勢為-14.71%~11.77%,表現為正向中親優勢和負向中親優勢的組合分別占25%和75%,表明煙草葉片數的雜種優勢表現以負向優勢為主。其中,以K326×GDH88葉片數的正向中親優勢最強,為11.77%,以GDH94×湄潭大蠻煙葉片數的負向中親優勢最強,為-14.71%;NC82×南江三號葉片數的中親優勢最弱,為-0.22%,故選擇K326×GDH88和GDH94×湄潭大蠻煙為強優勢組合,NC82×南江三號為弱優勢組合,用于葉片數相關基因的差異表達分析。超高親優勢為-25.69%~8.75%,僅K326×GDH88、Va116×湄潭大蠻煙和Va116×GDH88表現出正向超高親優勢,說明只要親本選擇得當可育成葉片數較多的雜交種。
2. 4 煙草葉片數雜種優勢及相關基因的表達分析結果
以K326為對照,利用實時熒光定量PCR檢測5個葉片數相關基因在強、弱優勢組合及其親本中的相對表達量,并計算各基因的中親表達優勢,結果分別如表8和表9所示。不同優勢組合中同一基因的中親表達優勢具有明顯的差異。在正向強優勢組合K326×GDH88中,FLC、BRI1、FPF1和PHYC基因表現為負向優勢;在負向強優勢組合GDH94×湄潭大蠻煙中,5個相關基因均表現為正向優勢;在弱優勢組合NC82×南江三號中,FLC和FPF1基因表現為正向優勢,BRI1、BSK3和PHYC基因表現為負向優勢。表明不同葉片數相關基因在葉片數雜種優勢中的差異表達模式較復雜,無明顯的規律性。
采用簡單相關性方法分析葉片數相關基因中親表達優勢間及其與葉片數雜種優勢的關系,結果如表10所示。不同葉片數相關基因的中親表達優勢之間存在一定的聯系。其中,BRI1與BSK3基因中親表達優勢的相關系數為0.79,呈顯著正相關,說明這2個基因的表達存在互作關系;FPF1和PHYC基因的中親表達優勢與葉片數雜種優勢呈顯著負相關,相關系數分別為-0.67和-0.71,說明FPF1和PHYC基因中親表達優勢的正向表現抑制了煙草葉片數雜種優勢的形成,故推測FPF1和PHYC基因是煙草葉片數雜種優勢形成的關鍵基因。
2. 5 FPF1和PHYC基因在強、弱優勢組合及其親本中的表達分析結果
煙草葉片數雜種優勢形成的關鍵基因FPF1和PHYC在強、弱優勢組合及其親本中的表達情況,如圖1所示。FPF1基因在正向強優勢雜交組合K326×GDH88和弱優勢組合NC82×南江三號中較其相應親本下調表達,但負向強優勢組合GDH94×湄潭大蠻煙較其親本上調表達。PHYC基因在正向強優勢組合K326×GDH88和弱優勢組合NC82×南江三號中較其相應親本下調表達,但在負向強優勢組合GDH94×湄潭大蠻煙較其親本上調表達。故推測FPF1和PHYC基因通過下調表達調控煙草葉片數雜種優勢的形成。
3 討論
3. 1 煙草葉片數及其雜種優勢表現
親本材料間的性狀差異是品種改良的物質基礎。彭韜屹(2019)、李迪秦等(2020)研究發現,烤煙葉片數因品種不同而存在一定差異,且受遺傳的影響較大。本研究結果表明,煙草親本及雜交組合間煙草葉片數存在明顯差異,說明供試材料的遺傳背景豐富,適于葉片數的遺傳研究和優良品種的雜交選育。煙草葉片數雜種優勢總體表現為負向群體中親優勢,表明采用雜種優勢育種方法選育葉片數較多雜交種的難度較大,與徐航等(2013)、Shu(2016)對葉片數雜種優勢的研究結果一致。本研究發現,有15%的雜交組合表現為正向超高親優勢,說明只要親本選擇適宜也可育成葉片數較多的雜交種。
3. 2 葉片數相關基因表達與煙草葉片數雜種優勢的關系
基因協同表達導致植物性狀表型的變化。雜種優勢的產生是由2個遺傳背景不同的親本相互作用的結果。采用基因差異表達方法,了解相同基因在親本與雜交組合中的表達差異,尋找與雜種優勢形成相關的基因,探討雜種優勢形成與基因表達調控的關系,有望更直接、更科學地從分子水平上解析雜種優勢的形成機理(呂有軍和張愛芹,2008;王艷欣等,2018)。本研究結果顯示,FPF1和PHYC基因的中親表達優勢與葉片數中親優勢呈顯著負相關,說明FPF1和PHYC基因中親表達優勢的正向表現抑制了煙草葉片數雜種優勢的形成,故推測FPF1和PHYC基因是煙草葉片數雜種優勢形成的關鍵基因。對FPF1和PHYC基因在各雜交種及其親本中的相對表達情況進一步檢測分析,結果發現煙草葉片數雜種優勢主要通過FPF1和PHYC基因的下調表達而實現,其下調表達是煙草葉片數雜種優勢形成的分子基礎,進一步證明二者是煙草葉片數雜種優勢形成的關鍵基因。在今后煙草雜種育種中,應優先選擇FPF1和PHYC基因低表達類型的材料為親本,以獲得煙草葉片數較多的雜交種。
4 結論
K326×GDH88組合的葉片數雜種優勢最大,具有較大的高產潛力。FPF1和PHYC基因參與調控煙草葉片數雜種優勢的形成,其下調表達是煙草葉片數性狀雜種優勢形成的分子基礎,可指導親本選配,提高煙草雜交選育效率。
參考文獻:
陳澤輝. 2009. 群體與數量遺傳學[M]. 貴陽:貴州科技出版社. [Chen Z H. 2009. Population and quantitative genetics[M]. Guiyang:Guizhou Science and Technology Press.]
高凱悅,李淑久,江錫瑜,楊昌達,廖海民. 2016. 烤煙南江3號的花芽分化[J]. 煙草科技,49(7):31-35. doi:10.16135/j.issn1002-0861.20160705. [Gao K Y,Li S J,Jiang X Y,Yang C D,Liao H M. 2016. Flower bud differentiation of flue-cured tobacco cv. Nanjiang No.3[J]. Tobacco Science & Technology,49(7):31-35.]
胡榮海. 2007. 云南煙草栽培學[M]. 北京:科學出版社. [Hu R H. 2007. Tobacco cultivation in Yunnan[M]. Beijing:Science Press.]
李迪秦,劉伊蕓,胡亞杰,韋建玉,楊全柳,李強. 2020. 不同基因型烤煙農藝性狀與質量指標評價及灰色關聯分析[J]. 云南農業大學學報(自然科學),35(4):643-650. doi:10.12101/j.issn.1004-390X(n).201903056. [Li D Q,Liu Y Y,Hu Y J,Wei J Y,Yang Q L,Li Q. 2020. Evaluation and grey relational analysis between the agronomic chara-cters and quality indicators of different genotypes flue-cured tobacco[J]. Journal of Yunnan Agricultural University(Natural Science),35(4):643-650.]
李顯航. 2019. 烤煙葉片數連鎖分子標記篩選[D]. 貴陽:貴州大學. doi:10.16213/j.cnki.scjas.2018.9.027. [Li X H. 2019. Screening of linkage molecular markers for number of flue-cured tobacco leaves[D]. Guiyang:Guizhou University.]
林姍姍,陳健,程森,王生才,尹紅慧,徐天養,竇玉青,張偉峰. 2017. 植物生長調節劑對烤煙經濟性狀與質量的影響[J]. 貴州農業科學,45(10):44-47. doi:10.3969/j.issn.1001-3601.2017.10.010. [Lin S S,Chen J,Cheng S,Wang S C,Yin H H,Xu T Y,Dou Y Q,Zhang W F. 2017. Effects of plant growth regulators on economic characters and quality of flue-cured tobacco[J]. Guizhou Agricultural Sciences,45(10):44-47.]
凌亮,王瑞,尚春樹,代永齊. 2007. 作物雜種優勢分子遺傳基礎研究進展[J]. 山西農業科學,(6):111-116. doi:10. 3969/j.issn.1002-2481.2007.06.034. [Ling L,Wang R,Shang C S,Dai Y Q. 2007. Research advance on the molecular genetics basis of heterosis in crops[J]. Journal of Shanxi Agricultural Sciences,(6):111-116.]
劉仁祥,夏志林,崔慶偉,喻奇偉,張慶明,聶瓊,徐秀紅,劉洋. 2016. 貴州烤煙育種工作進展與對策探討[J]. 山地農業生物學報,35(4):1-6. doi:10.15958/j.cnki.sdnyswxb.2016.04. 001. [Liu R X,X Z L,Cui Q W,Yu Q W,Zhang Q M,Nie Q,Xu X H,Liu Y. 2016. Progress in tobacco breeding in Guizhou Province and discussion for solutions[J]. Journal of Mountain Agriculture and Bio-logy,35(4):1-6.]
羅占春,杜偉,張衛星. 2009. 土壤水分與煙草生長發育和生理代謝的相關研究進展[J]. 山地農業生物學報,28(5):446-451. doi:10.3969/j.issn.1008-0457.2009.05.016. [Luo Z C,Du W,Zhang W X. 2009. The progress on the effect of soil water on growth and development and physiological metabolism of tobacco[J]. Journal of Mountain Agriculture and Biology,28(5):446-451.]
呂有軍,張愛芹. 2005. 基因差異表達與作物雜種優勢分子機理研究[J]. 種子,(12):33-38. doi:10.16590/j.cnki.1001-4705.2005.12.045. [Lü Y J,Zhang A Q. 2005. Molecular mechanism of gene differential expression and crop hetero-sis[J]. Seed,(12):33-38.]
彭韜屹. 2019. 烤煙新品系09011在廣元煙區的生態適應性評價[D]. 雅安:四川農業大學. doi:10.27345/d.cnki.gsnyu. 2019.000806. [Peng T Y. 2019. Evaluation of ecological adaptability of new flue-cured tobacco strain 09011 in Guangyuan Tobacco area[D]. Yaan:Sichuan Agricultural University.]
蒲媛媛,鄭宏斌,李顯航,喻奇偉,熊晶,夏忠文,羅家俊,李星悅,陳誼然,劉仁祥. 2020. 烤煙NC82和畢納1號品種葉片數的遺傳模式分析及分子標記篩選[J]. 山地農業生物學報,39(3):17-22. doi:10.15958/j.cnki.sdnyswxb. 2020.03.003. [Pu Y Y,Zheng H B,Li X H,Yu Q W,Xiong J,Xia Z W,Luo J J,Li X Y,Chen Y R,Liu R X. 2020. The genetic analysig and molecular marker scree-ning of leaf number of flue-cured tobacco varieties NC82 and Bina 1[J]. Journal of Mountain Agriculture and Bio-logy,39(3):17-22.]
商連光,高振宇,錢前. 2017. 作物雜種優勢遺傳基礎的研究進展[J]. 植物學報,52(1):10-18. doi:10.11983/CBB16187. [Shang L G,Gao Z Y,Qian Q. 2017. Progress in understanding the genetic basis of heterosis in crops[J]. Chinese Bulletin of Botany,52(1):10-18.]
蘇暢濤. 2020. 植物生長調節劑在烤煙上的應用效果試驗[J]. 現代農業科技,(6):120-121. doi:10.19383/j.cnki.nyzhyj.2020.08.003. [Su C T. 2020. Effect of plant growth regulator on flue-cured tobacco[J]. Modern Agricultural Science and Technology,(6):120-121.]
王紅鋒,孫曙光,楊曉亮,付小紅,楊紅柯,秦平偉. 2019. 重慶煙區烤煙生態環境與農藝性狀的典型相關分析[J]. 湖南農業科學,(2):29-33. doi:10.16498/j.cnki.hnnykx. 2019.002.009. [Wang H F,Sun S S,Yang X L,Fu X H,Yang H K,Qin P W. 2019. Canonical correlation analysis of ecological environment and agronomic traits of flue-cured tobacco in Chongqing tobacco area[J]. Hunan Agricultural Sciences,(2):29-33.]
王昆,于海龍,曹亞從,張正海,王立浩,張寶璽. 2018. 辣椒雜種優勢相關研究進展及其展望[J]. 辣椒雜志,16(3):1-7. doi:10.16847/j.cnki.issn.1672-4542.2018.03.001. [Wang K,Yu H L,Cao Y C,Zhang Z H,Wang L H,Zhang B X. 2018. Progress and perspective of heterosis researches on pepper[J]. Journal of China Capsicum,16(3):1-7.]
王楠. 2019. 煙草BR信號通路與成花相關基因在花芽分化響應苗期低溫中的表達分析[D]. 重慶:西南大學. [Wang N. 2019. Expression analysis of the gene in tobacco BR signaling pathway and flower-related in flower bud diffe-rentiation in response to low temperature in seedling stage[D]. Chongqing:Southwest University.]
王廷賢,鄭小雨,張廣東,王剛,楊占偉. 2019. 烤煙生態環境和紋理特征的典型相關分析[J]. 昆明學院學報,41(6):18-23. doi:10.14091/j.cnki.kmxyxb.2019.06.004. [Wang T X,Zheng X Y,Zhang G D,Wang G,Yang Z W. 2019. Typical correlation analysis between flue-cured tobacco ecological environment and texture characteristics[J]. Journal of Kunming University,41(6):18-23.]
王秀莉,姚穎垠,彭惠茹,張一,逯臘虎,倪中福,孫其信. 2009. 赤霉素代謝及其調控相關基因的差異表達與小麥株高雜種優勢的關系研究[J]. 科學通報,54(16):2320-2324. doi:10.1007/s11434-009-0518-3. [Wang X L,Yao Y Y,Peng H R,Zhang Y,Lu L H,Ni Z F,Sun Q X. 2009. The relationship of differential expression of genes in GA biosynthesis and response pathways with heterosis of plant height in a wheat diallel cross[J]. Chinese Science Bulletin,54 (16):2320-2324.]
王艷欣,王月星,王位,王建蒙,柴圓,戴豪楊,張文廣. 2018. 雜種優勢的應用及基因表達的特點[J].畜牧與飼料科學,39(4):32-34. doi:10.16003/j.cnki.issn1672-5190. 2018.04.009. [Wang Y X,Wang Y X,Wang W,Wang J M,Chai Y,Dai H Y,Zhang W G. 2018. Application of heterosis and its gene expression characteristics[J]. Animal Husbandry and Feed Science,39(4):32-34.]
信俊峰,范曉琪,杜衛民,陳利平,顧會戰,張啟莉,何佶弦,蔣垚,魯黎明. 2018. 留葉數對烤煙新品系09011生長及產質量的影響[J]. 現代農業科技,(22):1-2. doi:10.3969/j.issn.1007-5739.2018.22.001. [Xin J F,Fan X Q,Du W M,Chen L P,Gu H Z,Zhang Q L,He J X,Jiang Y,Lu L M. 2018. Effects of leaf numbers on growth,yield and quality of new flue-cured tobacco line 09011[J]. Modern Agricultural Science and Technology,(22):1-2.]
許晨璐,孫曉梅,張守攻. 2013. 基因差異表達與雜種優勢形成機制探討[J]. 遺傳,35(6):714-726. doi:10.3724/SP.J.1005.2013.00714. [Xu C L,Su X M,Zhang S G. 2013. Gene differential expression and heterosis formation mechanism[J]. Hereditas(Beijing),35(6):714-726.]
徐航,劉仁祥,徐如宏,袁富,吳祖玄. 2013. 烤煙主要農藝性狀的遺傳分析[J]. 中國煙草科學,34(5):62-66. doi:10.3969/j.issn.1007-5119.2013.05.013. [Xu H,Liu R X,Xu R H,Yuan F,Wu Z X. 2013. Genetic analysis of the main agronomic traits of flue-cured tobacco[J]. Chinese Tobacco Science,34(5):62-66.]
張興偉,王志德,孫玉合,任民,劉艷華,牟建民,徐軍. 2012. 烤煙葉數、葉面積的遺傳分析[J]. 植物遺傳資源學報,13(3):467-472. doi:10.13430/j.cnki.jpgr.2012.03.017. [Zhang X W,Wang Z D,Sun Y H,Ren M,Liu Y H,Mou J M,Xu J. 2012. Genetic analysis of leaf number and leaf area in flue-cured tobacco[J]. Journal of Plant Genetic Resources,13(3):467-472.]
中國煙草總公司青州煙草研究所. 2010. YC/T 142—2010? 煙草農藝性狀調查測量方法[S]. 北京:中國標準出版社. [Qingzhou Tobacco Research Institute,China National Tobacco Corporation. 2010. YC/T 142—2010? Survey and measurement methods of tobacco agronomic traits[S]. Beijing:China Standard Press.]
周俊學,王艷芳,劉杉,李繼偉,趙世民,王慧,王小東,劉領. 2016. 留葉數目和方式對烤煙生長及光合特性的影響[J]. 湖北農業科學,55(22):5868-5874. doi:10.14088/j.cnki.issn0439-8114.2016.22.036. [Zhou J X,Wang Y F,Liu S,Li J W,Zhao S M,Wang H,Wang X D,Liu L. 2016. Effects of number and pattern of remained leaf on growth and photosynthetic characteristics of flue-cured tobacco[J]. Hubei Agricultural Sciences,55(22):5868-5874.]
左偉標,洪天龍,高遠,郭芳陽,魯松霖,葉諶睿,安銀立,畢樂樂,王永齊,柏永超. 2020. 農藝措施調控烤煙營養吸收利用的研究進展[J]. 安徽農業科學,48(22):4-6. doi:103969/j.Issn.0517-6611.2020.22.002. [Zuo W B,Hong T L,Gao Y,Guo F Y,Lu S L,Ye C R,An Y L,Bi L L,Wang Y Q,Bai Y C. 2020. Research progress on the regu-lation of agronomic measures for absorption and utilization of nutrients in flue-cured tobacco[J]. Journal of Anhui Agricultural Sciences,48(22):4-6.]
Balasubramanians S,Sureshkumar S,Agrawal M,Michael T P,Wessinger C,Maloof J N,Clark R,Warthmann N,Chory J,Weigel D. 2006. The PHYTOCHROME C photoreceptor gene mediates natural variation in flowering and growth responses of Arabidopsis thaliana[J]. Nature Genetics,38(6):711-715. doi:10.1038/ng1818.
Chen Z J. 2010. Molecular mechanisms of polyploidy and hybrid vigor[J]. Trends in Plant Science,15(2):57-71. doi:10.1016/j.tplants.2009.12.003.
Franklin K A,Davis S J,Stoddart W M,Vierstra R D,Whitelam G C. 2003. Mutant analyses define multiple roles for phytochrome C in Arabidopsis photomorphogene-sis[J]. The Plant Cell,15(9):1981-1989. doi:10.1105/tpc. 015164.
Kim H J,Hyun Y,Park J Y,Park M J,Kim J. 2004. A genetic link between cold responses and flowering time through FVE in Arabidopsis thaliana[J]. Nature Genetics,36(2):167-171. doi:10.1038/ng1298.
Patrick S,Schnable,Nathan M,Springer. 2013. Progress toward understanding heterosis in crop plants[J]. Annual Review of Plant Biology,64:71-88. doi:10.1146/annurev-arplant-042110-103827.
Shang L G,Wang Y M,Cai S H. 2016. Genetic analysis of upland cotton dynamic heterosis for boll number per plant at multiple developmental stages[J]. Scientific Reports,6:35515. doi:10.1038/srep35515.
Shu H W. 2016. Phenotypic diversity of important agronomic traits in Sichuan sun-cured tobacco local variety[J]. Journal of Agricultural Sciences,6(2):23-30. doi:10.12677/HJAS.2016.62004.
(責任編輯 陳 燕)

