lncRNA SND1-IT1靶向miR-185-5p調控胃癌細胞增殖、遷移和侵襲的機制研究
艾合買提江·艾海提 謝有強 陳智全
我國是胃癌高發國家之一,盡管手術、放化療、分子靶向治療等治療手段不斷提高,胃癌患者的生存率仍不令人滿意[1,2]。近年來,許多原癌基因和抑癌基因被證實在胃癌的發生發展中起著重要作用。因此,進一步闡明胃癌發生轉移的分子機制對提高胃癌患者的診斷、治療和預后具有重要意義。長鏈非編碼RNA(Long non-coding RNA,lncRNA)是新近發現非編碼RNA家族成員,其長度>200 nt并缺乏蛋白編碼功能[3]。研究表明,lncRNAs通過在不同程度上調控基因表達,參與對胃癌細胞增殖、細胞周期、凋亡、侵襲、遷移、轉移和致瘤性等過程的調控[4,5]。lncRNA葡萄球菌核酸酶結構域包含蛋白1內含子轉錄本1(Staphylococcal nuclease and Tudor domain containing 1 gene intron transcript 1,SND1-IT1)是新近發現的一種lncRNA,研究顯示lnc SND1-IT1高表達可提高骨肉瘤細胞的增殖和遷移能力[6]。但SND1-IT1在胃癌進展中的作用尚不明確。因此,本研究通過觀察lnc SND1-IT1在胃癌中的表達及其生物學作用,揭示其分子機制,為胃癌的治療提供潛在策略。
1 材料與方法
1.1 實驗材料 人胃黏膜上皮正常細胞GES-1、胃癌細胞AGS、HGC-27和Hs 746T購于中國科學院上海細胞庫;DMEM、F-12、RPMI-1640、胎牛血清、青鏈霉素溶液購于美國Hyclone公司;lnc SND1-IT1小干擾RNA(si-lnc SND1-IT1)及其對照(si-con)、miR-185-5p模擬物(miR-185-5p mimics)及其對照(miR-con)、miR-185-5p抑制物(anti-miR-185-5p)及其對照(anti-miR-con)、lnc SND1-IT1過表達載體(pcDNA-lnc SND1-IT1)及其對照(pcDNA)、PCR引物由上海吉瑪制藥有限公司完成;TRIzol試劑、Lipfectamine 2000購于美國Ivitrogen公司;細胞計數試劑盒8(cell count kit 8,CCK-8)、放射免疫沉淀測定(radioimmunoprecipitation assay,RIPA)裂解液購于上海碧云天生物科技有限公司;Transwell小室購于美國BD公司;兔抗人細胞周期素D1(CyclinD1)抗體、兔抗人周期蛋白依賴性激酶2(cyclin-dependent kinase 2,CDK2)抗體、兔抗人基質金屬蛋白酶2(matrix metalloproteinase-2,MMP-2)抗體、兔抗人MMP-9抗體、山羊抗兔IgG購于美國Abcam公司。
1.2 細胞培養 GES-1細胞在DMEM培養基中培養,AGS細胞在F-12培養基中培養,HGC-27和Hs 746T細胞在RPMI-1640培養基中培養。所有細胞培養基均添加10%胎牛血清、1%青鏈霉素溶液,均置于37℃、含5% CO2的濕潤細胞培養箱中進行培養。
1.3 細胞轉染 將對數期AGS細胞2×105cells/孔接種到6孔板,當細胞融合度達到60%時,利用脂質體轉染試劑將si-con、si-lnc SND1-IT1、miR-con、miR-185-5p mimics、si-lnc SND1-IT1+anti-miR-con和si-lnc SND1-IT1+anti-miR-185-5p分別轉染AGS細胞,轉染48 h,檢測轉染效果后進行后續實驗分析。
1.4 RT-qPCR檢測lnc SND1-IT1和miR-185-5p的表達 采用TRIzol試劑提取細胞總RNA,紫外分光光度計測定RNA的純度和濃度。取適量RNA利用逆轉錄試劑盒反轉錄為cDNA,然后利用SYBR Green master mix試劑盒進行qPCR。按照2-ΔΔCt法檢測lnc SND1-IT1和miR-185-5p的表達。SND1-IT1上游5’-CCTGAGCGGCAGATCAACC-3’,下游5’-AGGTAGATCATGCCATACTCTCG-3’;β-actin上游5’-AGCGAGCATCCCCCAAAGTT-3’,下游5’-GGGCACGAAGGCTCATCATT-3’; miR-185-5p上游5’-TGAGGAGCCGATCACGTC-3’,下游5’-GTGCCGGTGCAGAGGT-3’;U6上游5’-CGCTTCGGCAGCACATATACTAAAATTGGAAC-3’,下游5’-GCTTCACGAATTTGCGTGTCATCCTTGC-3’。
1.5 CCK-8法檢測細胞增殖活力 細胞轉染48 h,將AGS細胞按照2.5×103cells/孔96孔培養板,培養24、48、72 h時,每孔添加10 μl的CCK-8試劑孵育1 h,酶標儀在450 nm波長測定各孔的光密度值(A)。
1.6 Transwell法檢測細胞遷移和侵襲能力 細胞轉染48 h,將AGS細胞懸浮于無血清的DMEM培養液中,取1×105cells/300 μl接種到鋪有基質膠的transwell小室,24孔板下室內加入600 μl含20%胎牛血清的DMEM培養基,細胞培養箱中培養24 h,取出transwell小室,4%多聚甲醛固定下室膜20 min,0.5%結晶紫溶液染色后,顯微鏡下觀察細胞過膜情況,拍照和計數,以均值表示侵襲細胞數目。遷移實驗時采用未鋪有基質膠的transwell小室,其他步驟同侵襲實驗。
1.7 蛋白質印記檢測CyclinD1、CDK2、MMP-2和MMP-9蛋白表達 采用RIPA裂解液提取細胞蛋白,BCA法進行定量。將蛋白樣品進行聚丙烯酰胺凝膠電泳,轉移至聚偏二氟乙烯膜上后,于5%的脫脂牛奶中孵育2 h,洗膜后,置于稀釋的一抗溶液中4℃孵育過夜,洗膜后,置于稀釋的二抗溶液中室溫條件下孵育2 h。增強化學發光試劑盒顯色后,并通過圖像軟件分析各目的條帶的灰度值。
1.8 雙熒光素酶報告實驗 含有miR-185-5p結合位點的野生型(WT-SND1-IT1)或突變位點的突變型(MUT-SND1-IT1)熒光素酶報告基因載體的構建由上海吉瑪制藥有限公司完成。將miR-185-5p mimics、miR-NC分別與WT-SND1-IT11或MUT-SND1-IT1共轉染AGS細胞,轉染48 h,雙熒光素酶報告基因檢測系統測定熒光素酶活性。
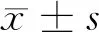
2 結果
2.1 lnc SND1-IT1和miR-185-5p人胃黏膜上皮正常細胞和胃癌細胞中的表達 與人胃黏膜上皮正常細胞GES-1比較,胃癌細胞AGS、HGC-27和Hs 746T中lnc SND1-IT1的表達明顯增加,miR-185-5p的表達明顯降低(P<0.05)。選擇胃癌細胞AGS進行后續實驗。見表1。

表1 lnc SND1-IT1 和miR-185-5p在人胃黏膜上皮正常細胞和胃癌細胞中的表達
2.2 沉默lnc SND1-IT1對胃癌細胞增殖、遷移和侵襲的影響 與轉染si-con比較,轉染si-lnc SND1-IT1后AGS細胞lnc SND1-IT1的表達明顯降低,CyclinD1、CDK2、MMP-2和MMP-9蛋白的表達明顯降低,細胞增殖率顯著降低,遷移和侵襲細胞數目顯著降低(P<0.05)。見圖1,表2。

圖1 Western blot檢測胃癌細胞增殖和轉移相關蛋白表達的表達和Transwell檢測胃癌細胞遷移和侵襲

表2 沉默lnc SND1-IT1對胃癌細胞增殖、遷移和侵襲的影響
2.3 lnc SND1-IT1靶向調控miR-185-5p 采用Starbase在線預測發現lnc SND1-IT1可直接靶向miR-185-5p。雙熒光素酶報告實驗驗證二者靶向關系顯示,與miR-con和WT-SND1-IT1共轉染相比,miR-185-5p mimics和WT-SND1-IT1共轉染AGS細胞熒光素酶活性顯著降低(P<0.05);而與miR-con和MUT-SND1-IT1共轉染相比,miR-185-5p mimics和MUT-SND1-IT1共轉染AGS細胞熒光素酶活性無明顯變化。RT-qPCR顯示,與轉染si-con相比,轉染si-lnc SND1-IT1后AGS細胞miR-185-5p的表達明顯升高;與轉染pcDNA相比,轉染pcDNA-lnc SND1-IT1后AGS細胞miR-185-5p的表達明顯降低(P<0.05)。說明lnc SND1-IT1靶向并負調控miR-185-5p表達。見圖2,表3、4。

圖2 lnc SND1-IT1與miR-185-5p存在靶向序列

表3 雙熒光素酶報告實驗

表4 lnc SND1-IT1調控miR-185-5p表達
2.4 過表達miR-185-5p抑制胃癌細胞增殖、遷移和侵襲 與轉染miR-con比較,轉染miR-185-5p mimics后AGS細胞miR-185-5p的表達明顯升高,CyclinD1、CDK2、MMP-2和MMP-9蛋白的表達明顯降低,細胞增殖率顯著降低,遷移和侵襲細胞數目顯著降低(P<0.05)。見圖3,表5。

表5 過表達miR-185-5p對胃癌細胞增殖、遷移和侵襲的影響

圖3 Western blot檢測胃癌細胞增殖和轉移相關蛋白表達的表達
2.5 沉默lnc SND1-IT1和干擾miR-185-5p對胃癌細胞的抑制作用 與共轉染si-lnc SND1-IT1和anti-miR-con比較,共轉染si-lnc SND1-IT1和anti-miR-185-5p后AGS細胞miR-185-5p的表達明顯降低,CyclinD1、CDK2、MMP-2和MMP-9蛋白的表達明顯升高,細胞增殖率顯著升高,遷移和侵襲細胞數目顯著升高(P<0.05)。見表6,圖4。

表6 沉默lnc SND1-IT1和干擾miR-185-5p對胃癌細胞增殖、遷移和侵襲的影響

圖4 Western blot檢測胃癌細胞增殖和轉移相關蛋白表達的表達
3 討論
lncRNAs表異常達影響其在表觀遺傳水平上的調控,導致細胞生長和侵襲異常,進而導致腫瘤發生,有效控制細胞生長和侵襲是緩解腫瘤進展和進一步提高治療效果的關鍵。Wang等[7]證實lncRNA結腸癌相關轉錄本2(colon cancer associated transcript 2,CCAT2)高表達與胃癌患者腫瘤發生、轉移相關,高表達胃癌患者預后較差,總生存期較短。Chen等[8]研究發現被轉化生長因子β活化(activated by transforming growth factor-β,ATB)lncRNA在胃癌中也呈高表達,其高表達與侵襲深度增加、遠處轉移及晚期腫瘤淋巴結轉移有關,下調lncRNA ATB抑制胃癌細胞的增殖、侵襲和遷移。本研究顯示胃癌細胞中lnc SND1-IT1表達較人胃黏膜上皮正常細胞顯著增加,進一步功能分析顯示沉默lnc SND1-IT1后胃癌細胞的增殖、遷移和侵襲能力明顯降低,與lnc SND1-IT1在骨肉瘤中的作用一致[6]。然而,在鱗狀細胞癌中lnc SND1-IT1呈低表達[9],這可能與lnc SND1-IT1在不同腫瘤細胞中作用不同有關。CyclinD1是細胞周期關鍵蛋白,其通過與CDKs結合,促進底物Rb磷酸化,促進細胞DNA合成,從而使細胞周期進入S期,進而導致細胞獲得無限制增殖能力[10]。MMP-2和MMP-9是MMPs家族的關鍵成員,其通過降解胞外基質在腫瘤轉移中具有重要作用,其高表達與腫瘤細胞的侵襲性表型相關[11]。本研究顯示,沉默lnc SND1-IT1后CyclinD1、CDK2、MMP-2和MMP-9表達顯著降低,與功能分析結果相吻合。以上結果說明,沉默lnc SND1-IT1可降低胃癌細胞的增殖、遷移和侵襲能力。
lncRNA通過發揮miRNA分子海綿作用是其調控胃癌細胞生物學行為的重要機制[12]。本研究采用生物信息學軟件starbase進行靶基因預測發現miR-185-5p是lnc SND1-IT1的潛在靶基因。RT-qPCR分析胃癌細胞中miR-185-5p表達發現,胃癌細胞中miR-185-5p表達下調,與lnc SND1-IT1表達模式呈負相關。進一步采用雙熒光素酶報告基因實驗驗證二者靶向關系發現,miR-185-5p是lnc SND1-IT1的靶基因,且lnc SND1-IT1負調控miR-185-5p表達。miR-185-5p已被證實在前列腺癌、膠質瘤等惡性腫瘤中發揮抑癌基因作用[13,14]。在前列腺癌和肝癌中miR-185-5p表達下調,過表達miR-185-5p可誘導前列腺癌細胞凋亡,抑制細胞遷移和侵襲能力[15,16]。與上述研究結論類似,本研究顯示過表達miR-185-5p可抑制胃癌細胞的增殖、遷移和侵襲能力。此外,過表達miR-185-5p還可抑制CyclinD1、CDK2、MMP-2和MMP-9的表達水平。進一步恢復實驗顯示,干擾miR-185-5p表達可部分逆轉沉默lnc SND1-IT1對胃癌細胞的增殖、遷移和侵襲的抑制作用。于是本研究推測胃癌中lnc SND1-IT1過表達可能通過干擾miR-185-5p表達,從而促進胃癌細胞的增殖、遷移和侵襲。
綜上所述,本研究首次證實lnc SND1-IT1和miR-185-5p在胃癌中的作用,即胃癌細胞中lnc SND1-IT1表達上調,miR-185-5p表達下調,沉默lnc SND1-IT1通過靶向miR-185-5p可抑制胃癌細胞的增殖、遷移和侵襲能力。因此,lnc SND1-IT1和miR-185-5p有望成為胃癌治療的潛在靶點。

