美拉德反應及其產物在遞送生物活性物質方面的應用研究進展
王 植,劉昊天,劉 騫,陳 倩,孔保華
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
生物活性物質除具有基本營養功能外,多具有抗腫瘤、抗炎、抗氧化、抗高血壓或抗高血脂等活性。因此,生物活性物質在慢性病(如糖尿病、癌癥、心血管疾病和肥胖癥)的預防和治療中受到廣泛關注[1]。隨著人們生活水平的提高和食品科學的發展,許多生物活性物質作為功能性成分被應用于食品中。然而,許多生物活性物質水溶性差、易降解,在加工和貯存過程中,不利的環境條件會影響其穩定性,從而影響食品品質或藥品效果等。此外,生物活性物質的口服途徑受到各種生理屏障的限制,如pH值、胃腸酶和黏液層。為了提高生物活性物質的穩定性和生物利用度,科研人員利用一些遞送體系對其進行保護[2]。這些遞送體系包括乳狀液、納米粒子、納米凝膠和微膠囊,它們在穩定性、生物利用度、生物降解性和生物相容性方面具有許多優點[3]。
蛋白質作為食品中主要成分之一,可形成穩定乳狀液、泡沫、膠體和薄膜等,對食品的流變特性、感官特性和質構特性有著重要影響[4],同時它也作為載體廣泛應用于遞送體系中。然而,蛋白質通常對pH值的變化、高離子強度、高溫、蛋白水解酶和有機溶劑等十分敏感,這限制了蛋白質的應用[5]。有研究表明,以蛋白質為載體的遞送體系容易被胃腸道中的消化酶水解,從而導致生物活性成分的突然釋放、降解[6]。美拉德反應是含有碳水化合物和蛋白質的食品在加熱過程中發生的反應,它是自然發生的,不需要添加其他成分,并且能夠改善食品的重要性質,如穩定性、風味和色澤等[7],同時可以提高蛋白質的乳化性、凝膠性和抗氧化活性等性質[8]。近年來,以美拉德反應為基礎的蛋白質-多糖復合物作為生物活性成分載體,在食品和醫藥領域受到了極大的關注[9]。通過美拉德反應在特定條件下所制備的蛋白質-多糖共價復合物具有較好的溶解性,并且在不同的環境條件(pH值、溫度以及離子強度等)下具有較高的穩定性,這使得它們在食品和制藥工業中作為揮發油、香料和生物活性物質的包埋劑和輸送載體具有很好的應用前景[10]。雖然美拉德反應有諸多益處,但是它也有不可忽視的負面影響,當反應控制不當時,會生成一些對人體有害的物質,如晚期糖基化終產物。因此,有必要控制美拉德反應的條件,以防止形成對人體有害的物質[11]。
本文主要概述了美拉德反應的機理,同時對蛋白質-多糖復合物構建的食品級遞送體系及其應用進行了綜述,還討論了遞送體系在消化系統中的變化,對合理利用美拉德反應并發揮其在構建生物活性物質遞送體系的作用具有指導意義。
1 美拉德反應概述
美拉德反應又稱羰氨反應,是指羰基化合物與氨基化合物之間經過縮合、聚合最終生成類黑精的反應,在食品工業中廣泛存在[12]。一般來說,美拉德反應主要分為3 個階段。初期階段包括羰氨縮合和分子重排兩步,以葡萄糖為例,其半縮醛羥基與胺類化合物的游離氨基之間形成共價鍵進而生成席夫堿,席夫堿通過環化過程形成不穩定性的縮合產物N-葡萄糖基胺。隨后,N-葡萄糖基胺在酸的催化下通過Amadori分子重排形成較為穩定的Amadori重排產物(Amadori rearrangement products,ARPs);或通過Heyenes分子重排異構成Heyenes重排產物(Heyenes rearrangement products,HRPs)[13]。在美拉德反應中期階段,ARPs或HRPs在酸性或堿性條件下會降解為中間體化合物,所涉及的反應包括1,2-烯醇化、2,3-烯醇化以及Strecker降解。在美拉德反應的晚期階段,中期階段生成的還原酮、裂解產物以及Strecker降解產物經歷醛醇縮合以及醛胺縮合進而生成褐色的含氮大分子物質類黑精[14]。盡管美拉德反應可以為產品帶來豐富的色澤和風味,然而,研究人員發現美拉德反應晚期終產物與糖尿病、慢性腎衰竭、心血管以及神經性疾病等病理過程密切相關[15]。因此,應該適當對美拉德反應加以控制,減少有害物質的形成,降低美拉德反應晚期產物帶來的健康風險。值得一提的是,美拉德反應可以提升蛋白質的乳化性、凝膠性、發泡性和抗氧化活性等功能特性[16],它輔助的蛋白質修飾比其他化學修飾更安全,可以將糖基化蛋白質作為食品的潛在成分添加到食品中。通過受控條件下的美拉德反應來制備具有明顯功能特性的蛋白質多糖復合物,可以用作食品級輸送系統的新型載體,以封裝、保護和控制許多生物活性物質的釋放[17]。美拉德反應的3 個階段見圖1[18]。
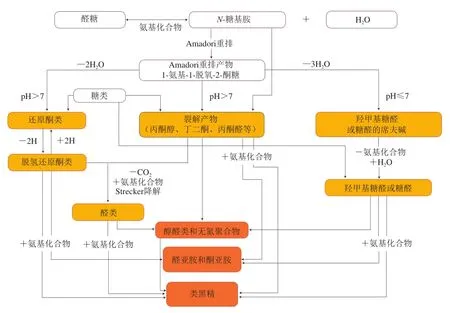
圖1 美拉德反應路線圖[18]Fig.1 Roadmap of Maillard reaction[18]
2 美拉德反應共價復合物的功能性質
2.1 乳化性
乳化性在食品體系中具有重要作用,蛋白質的表面疏水性和親水性平衡是決定乳化性質的重要因素[19]。利用多糖對蛋白質進行糖基化修飾是一種提高乳化特性的有效方法,一般來說,糖基化修飾會導致蛋白質解折疊,暴露出更多的疏水位點,這可以使蛋白質更好地吸附在油滴上。多糖與蛋白質的共價結合還會提供額外的靜電斥力以及空間位阻,使液滴間保持一定的距離,避免油滴的聚集。此外,多糖的加入會提升乳化體系的黏度,從而降低液滴的遷移速率,這也在一定程度上提高了乳化體系的穩定性。Zhang Bei等[20]通過美拉德反應制備的燕麥蛋白-葡聚糖結合物改善了水包油(oil in water,O/W)型乳狀液的穩定性。Consoli等[21]在濕熱條件下通過美拉德反應制備了酪蛋白酸鈉-玉米淀粉水解物結合物,與不含結合物的對照組相比,它提升了白藜蘆醇乳狀液的乳化穩定性。美拉德反應形成的蛋白質多糖復合物能夠在油滴周圍形成致密的剛性界面層結構,這有利于利用它們制備遞送系統,從而保護生物活性物質免受胃腸道(特別是胃)中的氧化劑、蛋白水解酶、酸性物質的破壞。
2.2 凝膠性
蛋白質的凝膠是指溶液中的蛋白質分子有規律交聯后,形成的三維網絡結構,美拉德反應可以改善蛋白質的凝膠性質。Matsudomi等[22]通過美拉德反應制備干蛋白-半乳甘露聚糖復合物,得到的透明凝膠具有較高的持水性和凝膠強度。凝膠在水溶液中的溶脹能力被認為是控制凝膠基質中被包裹的生物活性成分釋放速率的決定性因素。Meydani等[23]在研究中觀察到通過美拉德反應可以在低蛋白質含量下形成乳清分離蛋白-麥芽糊精復合物冷凝固凝膠,與對照組乳清分離蛋白凝膠相比,復合物所形成的凝膠在模擬胃液中溶脹率明顯較低,這可能是由于美拉德反應中蛋白質-多糖的交聯度較高,從而導致凝膠消化率較低。同時,美拉德反應還提高了凝膠的硬度和保水性。
2.3 抗氧化活性
蛋白質與多糖進行美拉德反應后巰基暴露,暴露的巰基可以很好地清除自由基,從而增強其抗氧化活性,美拉德反應的產物通常與抗氧化能力的增加有關[24]。Liu Qian等[25]研究了經美拉德反應得到的乳清分離蛋白-葡萄糖復合物的結構特征和抗氧化活性,結果表明復合物具有較高的熱穩定性和抗氧化性。美拉德反應復合物具有很高的熱穩定性,可以作為潛在的抗氧化劑和乳化劑應用于熱加工食品中,在高溫下不會發生明顯的降解,也不會失去其功能和生物學特性。美拉德復合物具有較強的抗氧化性能,可以保護包裹的生物活性物質免受氧化降解[26]。Lin Qianzhu等[27]通過美拉德反應制備了線性短鏈葡聚糖-賴氨酸復合物,采用冷凍干燥法制得納米粒子,與單一的線性短鏈葡聚糖和賴氨酸相比,復合物具有更強的自由基清除能力。同時,復合物制備的納米粒子在模擬胃液中保持穩定的形態,可以作為一種理想的納米載體,用于運送生物活性物質。
3 基于美拉德反應的遞送系統類型
經美拉德反應的蛋白質-多糖復合物具有高溶解性、乳化活性和抗氧化能力,對環境(離子強度、pH值和溫度)具有較強的穩定性,目前已被應用于輸送生物活性物質。
3.1 乳狀液
O/W型乳液和納米乳液遞送體系中,可以將疏水性生物活性物質包裹在乳狀液油滴中,從而提高其在水溶液中的穩定性和溶解度[28]。以蛋白質為載體的O/W型乳液遞送體系因其生物相容性好、成本效益高且易于制備已被廣泛應用于疏水性生物活性物質的遞送,然而,這種體系容易因環境(如pH值、溫度、離子強度和消化酶)的改變而發生聚集和相分離。此外,O/W型乳液和納米乳液是熱力學不穩定的系統,往往會由于絮凝、聚集和相分離而導致破乳[29],所以必須使用一些方法來改善乳狀液的性能。乳狀液的穩定性與乳化劑有關,乳化劑可以吸附在油滴表面形成界面層[30],通過美拉德反應將蛋白質和多糖共價連接在一起形成的新型乳化劑可以解決上述問題,此方法制備的乳狀液具有較高的安全性和穩定性,目前已被用作一種頗具前景的遞送體系[31]。復合物中的蛋白質可以快速吸附到油滴表面,而通過糖基化結合上的多糖則可以提供強烈的空間排斥和靜電排斥作用,從而抑制油滴的聚集。
姜黃素是存在于姜黃根莖中的一種天然多酚類化合物,具有良好的生物活性和藥理活性。但是姜黃素在酸性以及中性條件下的水溶性很差,在堿性或者見光條件下會迅速分解,因而限制了其應用。Wang Chaonan等[28]研究了牛血清白蛋白-葡聚糖美拉德共價復合物在保護和遞送O/W型乳液中的姜黃素的潛在應用,以牛血清白蛋白-葡聚糖共價復合物為乳化劑的乳液在不同溫度和pH值下對姜黃素有較好的保護作用,這可能是因為其更完整的界面層可以防止姜黃素的降解、沉淀和擴散到水相。研究還發現,與姜黃素/吐溫20懸浮液相比,牛血清白蛋白-葡聚糖復合物可以提高姜黃素在小鼠體內的口服生物利用度。Gumus等[32]研究了酪蛋白-葡萄糖美拉德共價復合物對葉黃素乳液在不同pH值下的物理和化學穩定性的影響,研究表明,與未加入葡萄糖的對照組相比,利用復合物制備的乳狀液在pH 3~7范圍內表現出更高的穩定性,并且乳液在胃中保持其穩定性,這是因為液滴表面的葡萄糖提供了空間排斥,防止胃蛋白酶到達液滴表面,阻礙了胃蛋白酶的水解,同時,糖基化蛋白質復合物不影響葉黃素的消化和生物活性。檸檬醛是一種具有抗菌活性的成分,由于其穩定性較差,它的應用受到了限制[33]。Yang Yuexi等[9]研究發現通過美拉德反應制備的大豆分離蛋白和可溶性多糖共價復合物可增強檸檬醛在O/W型乳狀液中的物理穩定性。
由此可見,以美拉德蛋白質-多糖復合物為乳化劑的乳狀液穩定性較好,在制備功能性飲料方面具有應用前景。同時,乳狀液在胃中具有較高的穩定性,主要是由于多糖阻礙了胃蛋白酶對界面蛋白的水解,這使其成為設計腸道特異性藥物遞送體系的理想候選者,從而預防或治療腸道疾病。
3.2 納米粒子
納米粒子是可以提供靶向藥物的膠體顆粒,其粒徑為1~100 nm[34],食品中許多疏水性生物活性物質被納米粒子包埋之后,不僅溶解性和穩定性提高,而且具有較好的緩釋效果,基于納米粒子的藥物遞送體系已廣泛應用于運載口服藥中的生物活性成分[6]。蛋白質制備的納米粒子通常通過粒子之間的靜電排斥力來維持穩定,然而,粒子在高離子強度和等電點附近容易聚集和沉淀。因此,研究人員利用美拉德反應制備蛋白-多糖復合物,從而提升遞送體系的穩定性[35]。為了提高β-胡蘿卜素的熱穩定性、溶解性和生物利用度,Yi Jiang等[36]通過美拉德反應制備了β-乳球蛋白-葡聚糖復合物,將其分散在超純水中,在室溫下攪拌2 h,然后用乙酸乙酯配制質量分數0.1%的β-胡蘿卜素溶液,采用均質蒸發法制備了納米顆粒,包封率為98.4%。Li Zheng等[6]通過美拉德反應制備了卵清蛋白-葡聚糖共價復合物包裹表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)并提高其生物利用度,將卵清蛋白-葡聚糖共價復合物與EGCG混合,調節pH值至5.2后,在80 ℃下加熱60 min,得到載有EGCG的卵清蛋白-葡聚糖共價復合物納米顆粒,其形狀為球形,載藥率為23.4%。Fan Yuting等[37]通過美拉德反應制備了牛血清白蛋白-葡聚糖納米顆粒用來運載姜黃素,通過綠色簡便的方法形成了具有球形結構的納米顆粒,提高了納米粒子在pH值為2.0~7.0時的穩定性。此外,與游離姜黃素相比,牛血清白蛋白-葡聚糖納米粒子中姜黃素的穩定性更高,抗氧化能力更強。由于牛血清白蛋白-葡聚糖納米顆粒不受pH值變化的影響,且包埋的姜黃素具有較高的穩定性,因此可廣泛應用于酸性飲料(酸奶、牛奶飲料和果汁)中的營養補充劑。
3.3 納米凝膠
納米凝膠是納米級別的凝膠顆粒,存在三維溶脹的聚合物鏈交聯網絡[38],它能溶脹于水但不溶解于水,粒徑大約在10~100 nm之間。鑒于其生物降解性和無毒性等優良特性,納米凝膠在許多方面具有潛在的應用前景[39]。納米凝膠因其具有較高的負載能力,可以作為生物活性物質的遞送體系。姜黃素的口服生物利用度相當有限,因為它在胃腸液中的溶解度很低,很容易發生降解[40]。Feng Jin等[41]通過美拉德反應制備了卵清蛋白-葡聚糖復合物,將4 mg粉末狀的姜黃素直接加入到10 mL的美拉德復合物溶液中,溫和攪拌10 min后,調節pH值至4.5,然后將溶液在1 000×g的條件下離心10 min,收集上清液并在90 ℃下加熱30 min,然后立即在冰浴中冷卻至室溫,得到負載姜黃素的納米凝膠。這種綠色工藝提高了納米凝膠的貯存穩定性、pH值穩定性和再分散性,并且可以改善姜黃素的口服生物利用度。在Meydani等[23]的研究中,通過美拉德反應制備的乳清分離蛋白-麥芽糊精凝膠在模擬胃環境中具有較高的穩定性。通過美拉德反應可以制備出對胃蛋白酶具有低敏感性的多糖結合蛋白,因此,包裹在美拉德復合物凝膠中的生物活性物質可以抵抗胃的惡劣條件,并成功地輸送到小腸進行吸收。
3.4 微膠囊
微膠囊是以天然或合成高分子材料為原料的微型容器。微膠囊化就是將固體、液體或氣體包埋、封存在一種微型膠囊內成為一種固體微粒產品的技術,復合凝聚法、噴霧干燥法和擠壓法等微膠囊化技術常用于生物活性物質的包埋[42]。復合凝聚法往往需要一些具有毒性(如戊二醛或甲醛)或制備時間較長(如轉谷氨酰胺酶)的交聯劑來穩定微膠囊壁[43],將美拉德反應生成的共價復合物作為壁材可以很好地解決這一問題。Ifeduba等[44]研究發現硬脂酸大豆油在基于美拉德復合物的復凝聚體系中,具有較高的熱穩定性和氧化穩定性。孫欣等[45]通過美拉德反應生成大豆分離蛋白-木糖復合物,以復合物和殼聚糖為壁材,利用復合凝聚法制得黑胡椒油樹脂微膠囊,結果表明,美拉德反應使微膠囊的微觀結構更加致密,并使微膠囊的貯藏穩定性有所提升。由此可見,利用美拉德復合物得到的穩定復凝聚體可以成功地包裹和保護油脂等生物活性物質,提升其穩定性。Jia Chengsheng等[46]通過美拉德反應制備了乳清分離蛋白-低聚木糖復合物,并對番茄紅素進行了包埋,結果表明該復合物可用于包埋番茄紅素或其他生物活性物質,改善其性能。Zhang Yating等[47]將水解大豆分離蛋白-麥芽糊精美拉德復合物包埋魚油微膠囊進行了冷凍干燥,可以使微膠囊形成多孔均勻的表面結構,提高了其包封率和熱穩定性。這是因為復合物的多糖部分在微膠囊周圍有形成薄膜的趨勢,起到了隔離氧氣的作用,從而減少了魚油微膠囊的氧化。Sugimura等[48]將酪蛋白酸鈉和麥芽糊精混合物乳化的魚油微膠囊進行噴霧干燥,誘導其中發生美拉德反應,提高了魚油微膠囊的抗氧化性。Cortesi等[49]將還原糖-明膠微膠囊在80 ℃下濕加熱5 min,增強了微膠囊在水溶液中的溶解穩定性。Choi等[50]研究發現,以乳清蛋白-麥芽糊精復合物為壁材,利用噴霧干燥法制備的共軛亞油酸微膠囊粒徑較小,水溶性較好,包封率較高。這些研究表明,美拉德反應可用于改善微膠囊的理化性質。同時,還有研究表明,將乳清蛋白-低聚異麥芽糖共價復合物對益生菌進行微膠囊化后,在模擬胃腸道條件下對益生菌的保護作用提高[51]。
以美拉德共價復合物為壁材的微膠囊對pH值變化、高離子強度和高溫具有較高穩定性,可以保證所包埋的生物活性物質在較長時間內的化學穩定性。
4 遞送體系在消化系統中的變化
人體消化系統由口腔、食道、胃、小腸和大腸構成,從口腔到大腸的理化環境(pH值、離子組成、酶活性和溫度)不同,所以了解人體消化系統各部分的環境條件對于設計生物活性物質的遞送體系十分重要[52]。人體攝取食物后,食物在不同的器官中停留不同的時間,并經過了一系列機械和化學作用。在食品和藥品行業的實際應用過程中,許多疏水性生物活性物質的作用并沒有得到充分發揮,這主要是因為它們的化學穩定性低、水溶性低和口服生物利用度低。目前已經有研究人員設計了一些遞送體系,使包埋的生物活性物質在胃中不發生釋放,而最終在腸道釋放,從而改善生物活性成分的口服吸收效果[53]。基于美拉德復合物的乳狀液體系研究較多,穩定的O/W型乳液能顯著提高包埋親油生物活性成分在人體胃腸道中的穩定性[54],可以成功地控制脂溶性生物活性物質在胃腸道特定位置的釋放。因此,理解生物活性物質在人體消化系統中的消化機制有助于構建新型遞送體系,提升其生物利用度。
4.1 口腔
口腔是人體攝入食物后的第一道屏障,其pH值條件是中性,溫度為37 ℃左右,唾液中主要含有淀粉酶。遞送體系進入口腔會發生一些變化[55],如被唾液稀釋、與唾液中的各種電解質相互作用、溫度和pH值的變化以及與口腔黏膜和舌頭之間的摩擦等。Feng Jin等[41]研究發現卵清蛋白-葡聚糖納米凝膠在模擬口腔條件下不易發生聚集。Xu Duoxia等[56]利用干熱法制得乳清分離蛋白-甜菜果膠復合物,將其作為β-胡蘿卜素乳液的乳化劑,在含有0.02%(質量分數,下同)黏蛋白、0.16%氯化鈉和0.02%氯化鉀的模擬唾液中,β-胡蘿卜素乳液的粒徑無明顯變化。Zhong Lei等[57]制備了以燕麥分離蛋白-平菇β-葡聚糖共價復合物為乳化劑的β-胡蘿卜素乳狀液,將8 mL含有0.03 g/mL黏蛋白模擬唾液流體預熱至37 ℃后與8 mL乳狀液混合并經過模擬口腔的處理后,乳狀液的平均粒徑和微觀結構沒有顯著變化。這是因為平菇β-葡聚糖在液滴表面提供了較高濃度的陰離子羧基,能夠通過靜電斥力避免與帶負電荷的黏蛋白的結合。因此,在用陰離子多糖制備美拉德復合物時,蛋白質-多糖復合物可以通過空間斥力和靜電空間斥力來提高體系對唾液引發的絮凝的穩定性。此外,蛋白質-多糖復合物在生物活性物質周圍提供了一層抗剪切的界面層結構,可以抵抗口腔中施加的高剪切力,從而減少遞送體系可能發生的理化屬性和微觀結構的變化。
4.2 胃
食物在咽部吞咽,并通過食道到達胃。胃中含有胃蛋白酶,是一種高度酸性的環境。由于高酸性和離子強度的影響,以蛋白質為乳化劑的乳狀液在通過胃時會被水解[58]。與天然蛋白質穩定的O/W型乳液相比,以蛋白質-多糖美拉德復合物為乳化劑的O/W型乳液在胃消化過程中的穩定性更高[32]。Lesmes等[10]制備了β-乳球蛋白-葡聚糖美拉德復合物,將其作為乳化劑研究其對O/W型乳狀液的影響,在模擬胃液中,與不含復合物的對照組相比,以復合物為乳化劑的乳液具有較高的穩定性。Davidov-Pardo等[59]制備了由酪蛋白酸鈉-葡聚糖美拉德復合物包埋的納米顆粒,并將白藜蘆醇包埋在其中,在模擬胃液條件下,不含復合物的納米顆粒懸浮液的粒徑大幅增加,而復合物納米顆粒懸浮液的粒徑增加較小,這表明美拉德復合物制備的納米顆粒在胃液環境下穩定性較高。Yi Jiang等[36]通過美拉德反應制得包埋β-胡蘿卜素的β-乳球蛋白-葡聚糖納米顆粒,在pH值為2.0且存在胃蛋白酶的條件下,2 h內只有5.4%的β-胡蘿卜素被釋放。由此可見,由美拉德制備的蛋白質-多糖共價復合物可以抵抗胃蛋白酶的水解,提高包埋的生物活性物質在人體胃腸道消化中的穩定性。這主要歸因于復合物在油滴周圍提供了的厚實而完整的界面層,通過強烈的空間排斥阻止了油滴的絮凝。
4.3 小腸
食物營養物質的吸收主要發生在小腸。小腸上皮是影響吸收的重要物理和生理屏障,它包括黏液層和細胞層兩部分。腸道中存在膽鹽,會使脂質的水解明顯增強,生成表面活性成分,如甘油單酯和甘油二酯,這些化合物競爭吸附乳液界面的表面活性分子,與磷脂和膽鹽形成“混合膠束”,導致界面組成發生改變,營養成分最終被小腸吸收[60]。因此,乳化液界面的結構和組成極大地影響脂質的消化速度,從而影響“混合膠束”的含量。在Zhong Lei等[57]的研究中,模擬小腸消化后,與未添加燕麥分離蛋白-平菇β-葡聚糖共價復合物的乳液相比,添加復合物的乳狀液平均粒徑較小,這表明其包埋的β-胡蘿卜素大多被消化吸收,提高了β-胡蘿卜素的口服利用度。Li Yang等[61]采用干熱法制得大豆分離蛋白-阿拉伯膠復合物,以其為壁材利用噴霧干燥法制備番茄樹油脂微膠囊,在模擬腸液條件下,包埋的番茄紅素幾乎完全釋放。Feng Jin等[41]的研究表明蛋白質-多糖復合物的納米凝膠在模擬消化過程中可以保護姜黃素并提高其生物利用度。理想的遞送體系應在消化過程中防止或減少生物活性成分的降解,并將其充分轉運和溶解到“混合膠束”中以供小腸吸收。基于美拉德復合物的遞送體系在不影響其生物利用度的情況下,更有效地提高了脂溶性生物活性物質的化學穩定性。
5 結 語
美拉德反應形成的共價復合物由于其優異的性能,在食品和制藥工業中可以作為一種運載生物活性物質的有效載體。在不同輸送體系中,基于美拉德反應的蛋白質-多糖復合物在保護活性物質的可降解性、營養性和功能特性等方面表現出了諸多優點,這為制備新型遞送體系創造了巨大的價值。本文綜述了基于美拉德復合物遞送體系的主要類型,如O/W型乳液、納米顆粒、納米凝膠和微膠囊,并且說明了遞送體系在消化系統中發生的變化。美拉德反應得到的蛋白質-多糖復合物作為乳化劑和包封劑在O/W型乳狀液和其他輸送載體中運送多種生物活性物質,提高其生物利用度,是目前研究的熱點。在這些體系中,復合物在被包埋的生物活性物質周圍形成了一個厚的連續的層,當體系在加工、貯存和運輸過程中暴露于一些的不利環境時,能夠降低其降解率。因此,美拉德復合物可作為親脂性和其他生物活性成分的載體,從而提高它們的穩定性和生物利用度,并可設計用于食品和醫藥的功能性產品。然而,還需要更多的研究來驗證美拉德反應復合物的功能特性、控制晚期糖基化終產物的生成、選擇較為合適的美拉德產物來設計生物活性物質的遞送體系。此外,還需要更多的體外和體內研究來檢測蛋白質-多糖美拉德復合物傳遞體系的性能。

