不同基因型及培養基在燕麥花藥組織培養中的應用
田娟 張曼 孫墨可 董玉迪 王春龍 郭來春 魏黎明 任長忠
摘要:以JA3、M44、19A647燕麥資源為試驗材料,采用花藥離體培養方法,將3種材料的花藥接種于C17、W14培養基上,研究3種基因型在2種培養基上反應率、出愈率、轉移率和再生率的差異,以期篩選出適合燕麥花藥培養的基因型和誘導培養基。結果表明,在3個基因型中,JA3的反應率、出愈率、轉移率都是最高的,分別達到36.29%、2695%、86.93%,只有JA3獲得了再生植株,其綠苗率為0.10%,可見JA3適合用于花藥組織培養,可以作為燕麥花藥培養的橋梁材料;C17培養基中的愈傷組織比較緊湊,質量較好,W14培養基中的愈傷組織不易聚集長大,質量較差,從W14培養基中共獲得6株白化苗,從C17培養基中獲得2株白化苗、2株綠苗。由研究結果可以看出,燕麥花藥愈傷組織誘導和再分化在基因型之間的差異顯著,JA3適合作為燕麥花藥培養的橋梁品種,相較于W14培養基,C17為燕麥花藥培養的最佳培養基。
關鍵詞:燕麥;基因型;培養基;花藥組織培養;愈傷組織
中圖分類號: S339.4+1;S512.604.3 ?文獻標志碼: A ?文章編號:1002-1302(2021)09-0049-04
燕麥(Avena sativa L.)是禾本科燕麥屬一年生草本植物,是世界上主要的糧食作物之一[1],它抗旱[2]、耐寒[3]、耐鹽堿[4-5]。燕麥蛋白的氨基酸種類齊全,配比合理[6],具有極高的營養、飼用價值和保健功效[7]。燕麥新品種主要采用引進選育、系統育種、品種間雜交等方式育成[8]。花藥培養育種是將花粉培育成單倍體植株,再經染色體自然或人工加倍得到純合二倍體的一種育種方法,這種由染色體加倍產生的純合二倍體,在遺傳上非常穩定,不發生性狀分離,因此,花培育種能夠縮短育種年限[9]。但是在實際育種中,燕麥花培育種方法應用得很少,主要是因為花藥組織培養的誘導率不高。誘導率不高的原因,主要是材料的基因型、培養基的種類和成分、預處理和培養條件等因素在不同程度上制約了燕麥花藥培養的效果[10]。由于燕麥選育受資源與技術的雙重制約,使得燕麥育種效率低下,品種更新換代較慢,產業化發展滯后[11]。為了解決我國燕麥育種面臨的育種技術單一、方法陳舊、周期長、優良品種少等問題,攻克燕麥花藥單倍體育種技術屏障勢在必行。關于燕麥花藥組織培養的報道已經有很多[12-24],本試驗選用JA3、M44、19A647燕麥品種(系)作為試驗材料,比較C17、W14這2種誘導培養基在燕麥花藥培養過程中的反應率、出愈率、轉移率和再生率差異,以期篩選出適合燕麥花藥培養的基因型和誘導培養基,為提高燕麥花藥培養育種效率提供理論依據。
1 材料與方法
1.1 試驗材料
以編號為JA3、M44、19A647的燕麥品種(系)作為試驗對象,于2019年4月1日播種于吉林省白城市農業科學院內。在孕穗期采集幼穗后置于4 ℃冰箱中進行暗、冷處理7 d后取出,用75%乙醇消毒,選取小孢子為單核中晚期的小穗(小孢子時期通過醋酸楊紅染色鏡檢來確定),剝離出花藥放在直徑為3.5 cm的培養皿中,每個培養皿中放置30個花藥,于32 ℃處理5 d后轉移到28 ℃條件下進行暗培養。
1.2 愈傷組織的誘導
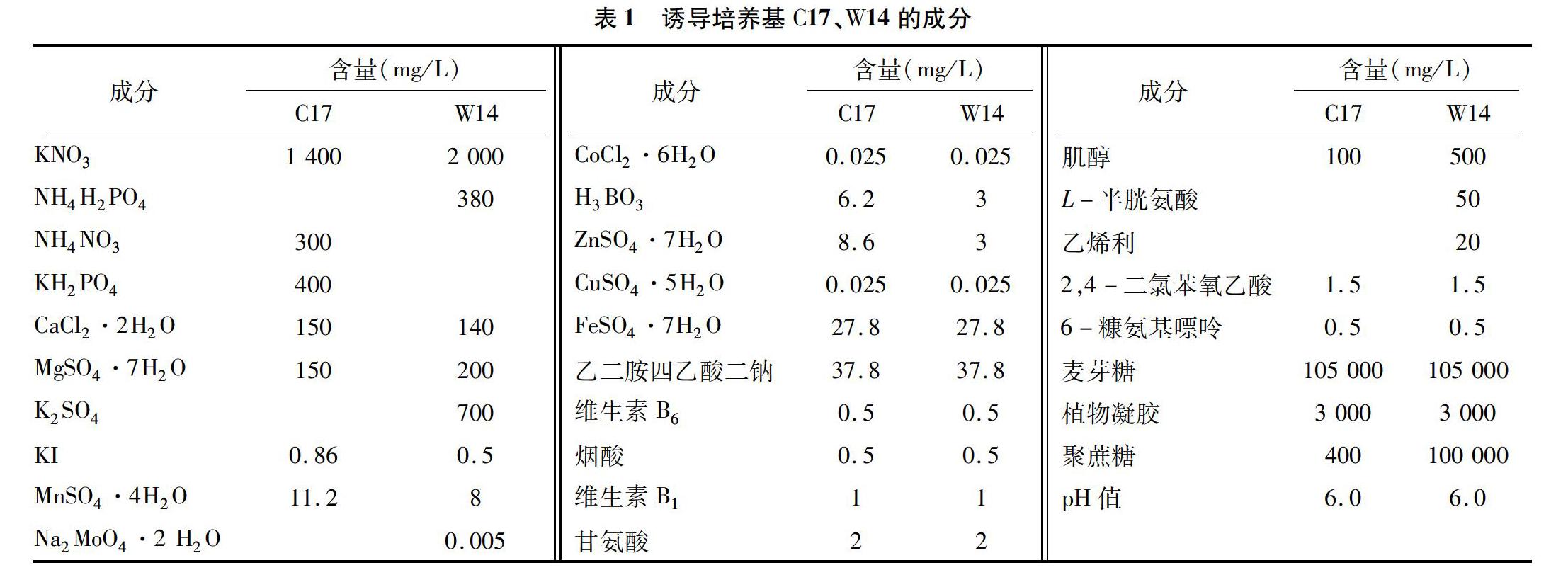
脫分化使用C17、W14這2種培養基,其中C17為固體培養基,W14為固液雙層培養基。W14上層是液體培養基,加入100 g/L聚蔗糖400、105 g/L麥芽糖等,培養基的具體成分見表1。
1.3 分化和生根培養
將誘導的愈傷組織轉移到再生培養基上,再生培養基是固體W14,另加2%蔗糖、0.3%植物凝膠,定容后調節pH值為6.0,于121 ℃滅菌20 min。將植物激素2 mg/L NAA、0.5 mg/L KT過濾消毒后加入再生培養基中。再生溫度設為22 ℃,采用16 h/d弱光光照。生根采用MS培養基[21],輔以0.2 mg/L NAA、2%蔗糖和0.3%植物凝膠。生根溫度為 25 ℃,光照時間為16 h/d。
1.4 數據統計與分析
使用WPS 2019軟件對試驗數據進行整理和統計分析,用IBM SPSS Statistics 19.0軟件進行單因素方差分析。
反應時間指從花藥接種到培養基中至花藥表面出現小泡的時間,出愈時間指從花藥接種到培養基中至出現愈傷組織的時間,其他計算公式如下:
反應率=反應的花藥數/接種的花藥數×100%;
出愈率=出現愈傷組織的花藥數/接種的花藥數×100%;
轉移率=能夠轉移的愈傷數/出現愈傷組織的花藥數×100%;
綠苗率=出現的綠苗數/接種的花藥數×100%;
白化苗率=出現的白化苗數/接種的花藥數×100%。
2 結果與分析
2.1 基因型對燕麥花藥愈傷組織誘導和再分化的影響
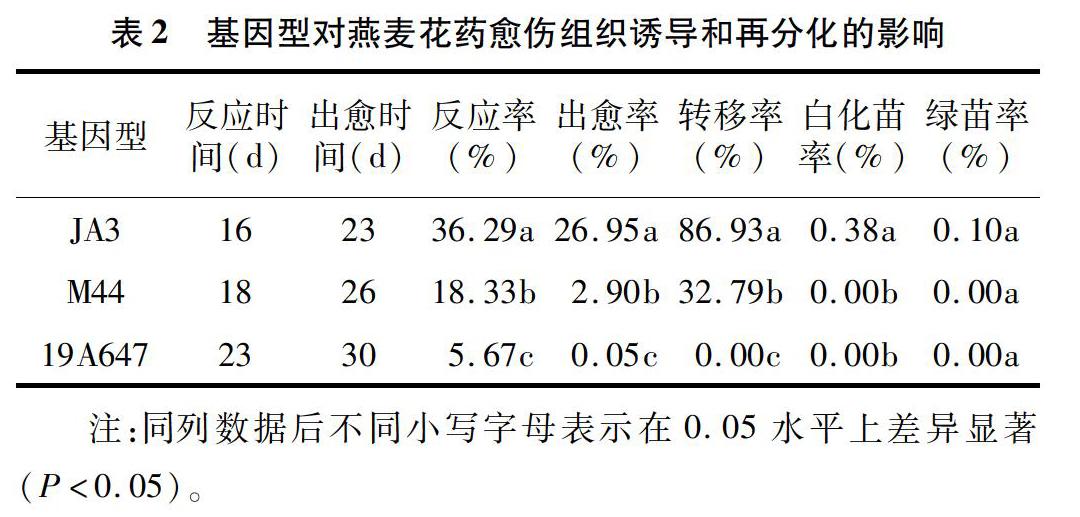
以JA3、M44、19A647燕麥品種(系)為材料,研究不同基因型對燕麥花藥愈傷組織誘導和再分化的影響。由表2可以看出,不同基因型燕麥的反應時間和出愈時間有所不同,但是3種基因型燕麥從反應到出愈約用1周時間,出愈時間為23~30 d不等。在相同培養條件下,燕麥花藥愈傷組織誘導和再分化在不同基因型之間的差異顯著。在供試的3個材料中,JA3的反應率、出愈率均最高,分別能達到36.29%、26.95%,而且JA3的轉移率能達到8693%,說明其愈傷組織活力較高,增殖速度快。在3個燕麥基因型中,只有JA3獲得了再生植株,其綠苗率為0.10%。以上結果說明,JA3適合用于花藥組織培養,可以作為燕麥花藥培養的橋梁材料。19A647的反應率、出愈率都較低,沒有能夠轉移的愈傷組織,說明19A647不適合用于花藥培養。
2.2 培養基對燕麥花藥愈傷組織誘導和再分化的影響
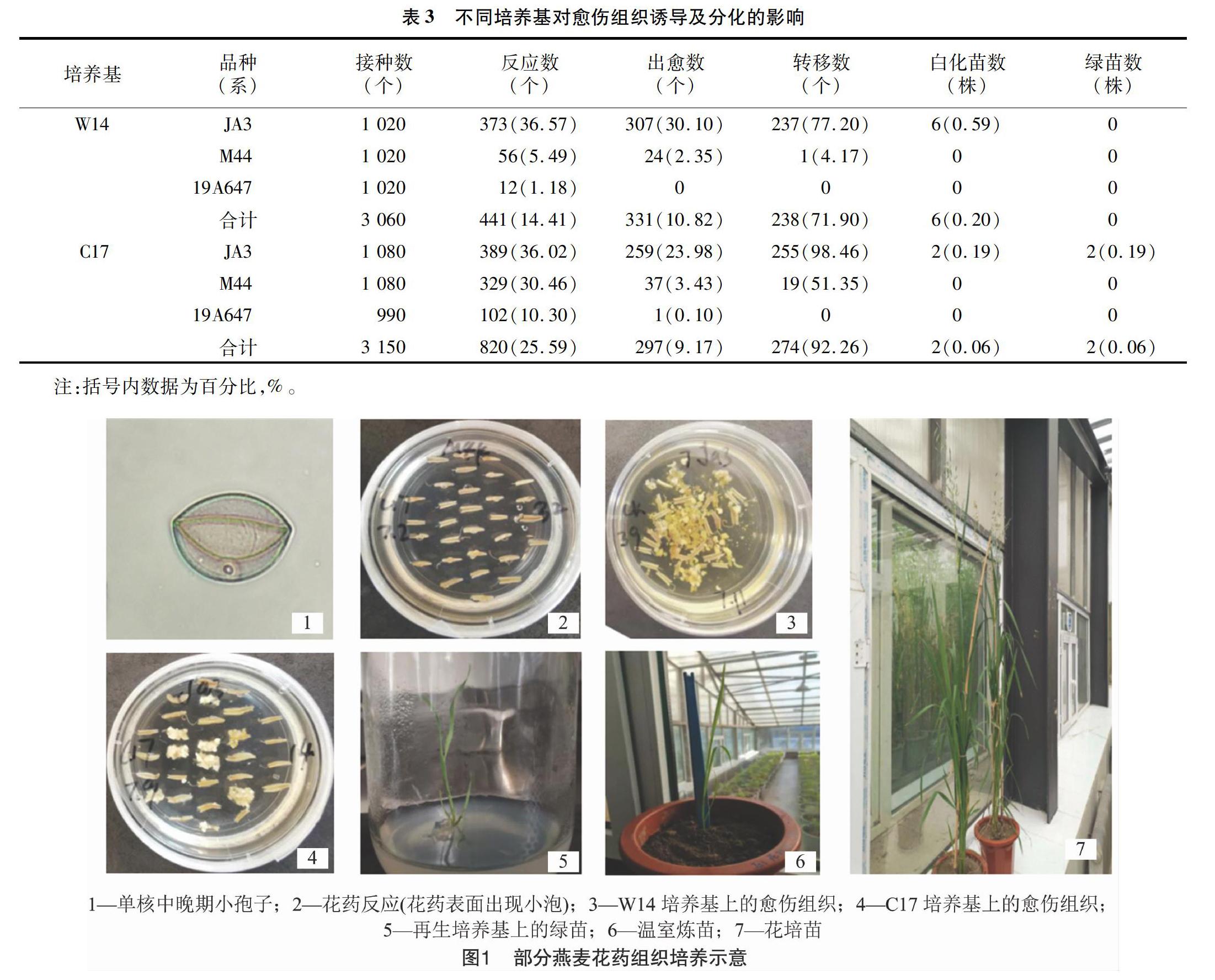
由表3可以看出,C17培養基中的花藥反應數較W14培養基高,并且每個基因型中反應數均超過10%。在出愈數方面,雖然W14培養基比C17培養基高,但是在轉移數方面,W14培養基不如C17培養基。由圖1可以看出,W14培養基出現的愈傷組織比較分散,不能達到轉移所需的大小。而C17培養基中的愈傷組織比較緊湊,容易長大,質量比較好。從W14培養基中獲得了6株白化苗,從C17培養基中獲得了2株白化苗和2株綠苗,且每100個花藥的綠苗數達到0.06株。綜合愈傷組織質量和獲得的綠苗數,在本研究選用JA3、M44、19A647這3個燕麥材料進行花藥組織培養的過程中,C17培養基優于W14培養基。
2.3 誘導培養基C17、W14成分的比較
培養基各成分的配比與優化直接影響了燕麥花藥培養的出愈率。從表1可以看出,在C17、W14的培養基成分中,鐵鹽、有機成分、植物激素等含量完全相同。C17、W14中大量元素的種類不同,C17中的大量元素由KNO3、NH4NO3、KH2PO4、CaCl2·2H2O、MgSO4·7H2O提供,W14中的大量元素由KNO3、NH4H2PO4、CaCl2·2H2O、MgSO4·7H2O、K2SO4提供,相較于C17,W14中的微量元素(由KI、MnSO4·4H2O、H3BO3、ZnSO4·7H2O等化合物提供)含量都有不同程度的減少。C17是固體培養基,碳源只來自蔗糖,W14是固液雙層培養基,碳源來自蔗糖、麥芽糖,W14培養基中增加了L-半胱氨酸、乙烯利等。
3 討論與結論
3.1 基因型
誘導花粉形成愈傷組織是誘導花粉植株的第一步,在同樣的培養條件下,不同品種或雜種燕麥花藥產生花粉愈傷組織的頻率差異極大,有的高達48.5%,但有的則不產生花粉愈傷組織[22]。這種差異顯然是由花藥與花粉內部的因素引起的,供體植株的基因型是影響花藥、花粉培養的關鍵因素,不同基因型的植株對培養的反應不同。本試驗結果表明,在相同培養條件下,燕麥花藥愈傷組織誘導和再分化在基因型之間的差異顯著,主要表現為出現愈傷組織的時間不同以及出愈率、綠苗分化率和白化苗分化率不同等方面。本研究結果與Kiviharju等的相關研究結果[23-25]一致。本研究所選的JA3燕麥在W14培養基上的出愈率達到30.10%,適合作為燕麥花藥培養的橋梁品種。
3.2 培養基
培養基的組成在胚胎發生中起著主要作用。燕麥花藥培養效率的提高,在某些程度上依賴于培養基成分、激素配比等。C17、W14培養基是廣泛用于燕麥花藥培養的2種培養基[13,26-29],這2種培養基的成分與激素含量存在一定差異。本研究對比了2種培養基誘導愈傷組織和綠苗分化的能力,并綜合愈傷組織的質量、獲得的綠苗數得出,C17為最佳培養基,與Ponitka等的研究結果[30]一致,但是與Warchol等的研究結果[31]不一致。
本試驗中培養基差異很大,大量元素來源不同,微量元素含量不同,并且與C17相比,W14中添加了L-半胱氨酸、乙烯利等激素,分為固液2層,在液體層中加入了麥芽糖而不是蔗糖。這些成分的改變并沒有提高燕麥花藥愈傷組織的誘導率和質量,但是可以看出,雙層培養基的優點是花藥在培養早期可以從活性高的液體培養基中汲取營養,從而提高花粉反應率,但是并沒有提高愈傷組織誘導率,而且由于花藥直接放在液體培養基上,出現的愈傷組織在培養基上來回游動,不能聚集長大,反而降低了愈傷組織質量。由于本研究的培養基差異很大,究竟是大量元素、微量元素、糖源還是 L-半胱氨酸和乙烯利等激素對愈傷組織的影響,還有待進一步探討。
本試驗從多種角度發現,在相同培養條件下,不同基因型植株的再生情況差異明顯。這種差異在很大程度上由基因型自身的再生能力決定,優化再生體系僅能在一定程度上提高某些基因型的培養力,但并不能從根本上改變這種差距。對于不同培養基而言,相同基因型植株的出愈率差別不大。
參考文獻:
[1]鄭殿升.中國燕麥的多樣性[J]. 植物遺傳資源學報,2010,11(3):249-252.
[2]李 威. PEG脅迫下6種裸燕麥品種種子萌發期的抗旱性研究[J]. 種子,2014,33(5):38-41.
[3]柏曉玲,周青平,陳有軍,等. 燕麥幼苗對低溫脅迫的響應[J]. 草業科學,2016,33(7):1375-1382.
[4]姜 瑛,周 萌,吳 越,等. 不同燕麥品種耐鹽性差異及其生理機制[J]. 草業科學,2018,35(12):2903-2914.
[5]付鸞鴻,于 崧,于立河,等. 不同基因型燕麥萌發期耐鹽堿性分析及其鑒定指標的篩選[J]. 作物雜志,2018(6):27-35,174.
[6]許英一,王 宇,林 巍. 燕麥蛋白理化性質研究[J]. 安徽農業大學學報,2018,45(3):385-388.
[7]石振興,朱瑩瑩,任貴興. 燕麥中減肥降脂的功能成分研究進展[J]. 食品安全質量檢測學報,2018,9(7):1567-1571.
[8]任長忠,崔 林,楊 才,等. 我國燕麥高效育種技術體系創建與應用[J]. 中國農業科技導報,2016,18(1):1-6.
[9]王 煒,葉春雷,楊隨莊,等. 花藥培養技術在小麥種質資源創制及育種中的應用[J]. 中國種業,2018(11):25-29.
[10]田 娟,張 曼,董玉迪,等. 燕麥花藥組織培養影響因子研究進展[J]. 安徽農業科學,2018,46(35):11-13.
[11]王 娟,李蔭藩,梁秀芝,等. 北方主栽燕麥品種種質資源形態多樣性分析[J]. 作物雜志,2017(4):27-32.
[12]Rines H W. Oat anther culture:genotype effect on callus initiation and the production of a haploid plant[J]. Crop Science,1983,23(2):268-272.
[13]Kiviharju E,Puolimatka M,Pehu E. Regeneration of anther-derived plants of Avena sterilis[J]. Plant Cell,Tissue & Organ Culture,1997,48(2):147-152.
[14]Warchol M,Skrzypek E,Nowakowska A,et al. The effect of auxin and genotype on the production of Avena sativa L. doubled haploid lines[J]. Plant Growth Regulation,2016,78(2):155-165.
[15]Kiviharju E,Pehu E. The effect of cold and heat pretreatments on anther culture response of Avena sativa and A. sterilis[J]. Plant Cell,Tissue and Organ Culture,1998,54(2):97-104.
[16]Kiviharju E M,Tauriainen A A. 2,4-dichlorophenoxyacetic acid and kinetin in anther culture of cultivated and wild oats and their interspecific crosses:plant regeneration from A. sativa L.[J]. Plant Cell Reports,1999,18(7):582-588.
[17]Rines H W, Rieralizarazu O, Nunez V M, et al. Oat haploids from anther culture and from wide hybridizations[M]//Jain S M, Sopory S K, Veilleux R E, et al. In vitro haploid production in higher plants. Dordrecht:Kluwer, 1997,4:205-221.
[18]Jingsan S,Tiegang L,Sōndahl M R,et al. Anther culture of naked oat and the establishment of its haploid suspension cell[J]. Journal of Integrative Plant Biology,1991,33(6):417-420.
[19]Rines H W. Oat haploids from wide hybridization[J]. Doubled Haploid Production in Crop Plants,2003:155-159.doi:10.1007/978-94-017-1293-4_24.
[20]Kiviharju E,Moisander S,Laurila J,et al. Improved green plant regeneration rates from oat anther culture and the agronomic performance of some DH lines[J]. Plant Cell,Tissue and Organ Culture,2005,81(1):1-9.
[21]Murashige T,Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15(3):473-497.
[22]楊 才,王秀英. 采用花藥單倍體育種方法育成花中21號莜麥新品種[J]. 河北北方學院學報(自然科學版),2005,21(3):39-42.
[23]Kiviharju E,Puolimatka M,Saastamoinen M,et al. Extension of anther culture to several genotypes of cultivated oats[J]. Plant Cell Reports,2000,19(7):674-679.
[24]S'lusarkiewicz-Jarzina A,Ponitka A. The effect of physical medium state on anther culture response in Polish cultivated oat (Avena sativa L.)[J]. Acta Biologica Cracoviensia(Series Botanica),2007,49(2):27-31.
[25]Noga A,Skrzypek E,Warchol M,et al. Conversion of oat (Avena sativa L.) haploid embryos into plants in relation to embryo developmental stage and regeneration media[J]. In Vitro Cellular & Developmental Biology-Plant,2016,52(6):590-597.
[26]Kiviharju E,Puolimatka M,Saastamoinen M,et al. The effect of genotype on anther culture response of cultivated and wild oats[J]. Agricultural and Food Science in Finland,1998,7(3):409-422.
[27]Kiviharju E,Moisander S,Tanhuanpaa P,et al. Oat anther culture and use of DH-lines for genetic mapping[J]. Methods of Molecular Biology,2017,1536:71-93.
[28]Sidhu P K,Davies P A. Regeneration of fertile green plants from oat isolated microspore culture[J]. Plant Cell Reports,2009,28(4):571-577.
[29]Ferrie A M R,Irmen K I,Beattie A D,et al. Isolated microspore culture of oat (Avena sativa L.) for the production of doubled haploids:effect of pre-culture and post-culture conditions[J]. Plant Cell,Tissue and Organ Culture,2014,116(1):89-96.
[30]Ponitka A,S'lusarkiewicz-Jarzina A. Regeneration of oat androgenic plants in relation to induction media and culture conditions of embry-like structures[J]. Acta Societatis Botanicorum Poloniae,2009,78(3):209-213.
[31]Warchol M,Czyczylo-Mysza I,Marcińska I,et al. Factors inducing regeneration response in oat (Avena sativa L.) anther culture[J]. In Vitro Cellular & Developmental Biology-Plant,2019,55(5):595-604.

