限食對大鼠海馬神經元線粒體自噬的影響
戴國英 劉慧慧 馬丹 于化新 單德紅
【摘要】 目的:觀察50%限食(dietary restriction,DR)14 d對大鼠海馬神經元線粒體的結構和功能及其自噬的影響,探討DR的安全性。方法:選取16只雄性SD大鼠按體質量配對分為正常組和DR組,每組8只。正常組給予自由進食,DR組給予50%DR,14 d后取海馬組織,透射電鏡觀察海馬神經元線粒體超微結構,JC-1法檢測線粒體膜電位(ΔΨm),ELISA法檢測線粒體ATP和反應性氧簇(reactive oxygen species,ROS)水平,Western blot法檢測微管相關蛋白輕鏈3(light chain 3,LC3)-Ⅰ和Ⅱ表達并計算兩者比值。結果:兩組線粒體均邊緣清楚,但正常組相對較大,嵴呈片狀,數量較多,而DR組的線粒體較小,且存在嵴減少現象;與正常組比較,ΔΨm和ATP水平均下降(P<0.05),但ROS水平變化不明顯(P>0.05),LC3-Ⅱ表達上升,LC3-Ⅰ表達下降,LC3-Ⅱ/Ⅰ比值升高。結論:海馬神經元線粒體可被14 d的50%DR負性影響,但可通過增強線粒體自噬進行對抗。
【關鍵詞】 飲食限制 海馬 神經元 線粒體自噬 微管相關蛋白輕鏈3
Effect of Diet Restriction on Mitophagy in Hippocampal Neuron of Rats/DAI Gouying, LIU Huihui, MA Dan, YU Huaxin, SHAN Dehong. //Medical Innovation of China, 2021, 18(13): 0-031
[Abstract] Objective: To observe the effects of 50% dietary restriction (DR) on the structure and function of hippocampal neuron mitochondria and mitophagy of rats for 14 d, and to explore the safety of DR. Method: A total of 16 male SD rats were selected and divided into normal group and DR group according to body weight, with 8 rats in each group. The normal group was given free food, and the DR group was given 50%DR. After 14 days, the hippocampal tissue was taken, and the mitochondrial ultrastructure of the hippocampal neurons was observed by transmission electron microscopy. The mitochondrial membrane potential (ΔΨm) was detected by JC-1 method. Mitochondrial ATP and reactive oxygen species (ROS) levels were detected by ELISA, and microtubule-associated protein light chain 3 (LC3)-Ⅰ and Ⅱ expression were detected by Western blot, and their ratio was calculated. Result: Mitochondria in both groups had clear margins, but the normal group was relatively large with flaky cristae and more number, while the DR group had smaller mitochondria with reduced cristae; compared with the normal group, the levels of ΔΨM and ATP were decreased (P<0.05), but the ROS level was not significantly changed (P>0.05), the expression of LC3-Ⅱ was increased, the expression of LC3-Ⅰ was decreased, and the ratio of LC3-Ⅱ/Ⅰ was increased. Conclusion: Hippocampal neuronal mitochondria might be negatively affect by 14 d 50%DR, but it can be opposited by increasing mitophagy.
[Key words] Dietary restriction Hippocampus Neuron Mitophagy Microtubule-associated protein light chain 3
First-authors address: College of Integrated Traditional Chinese Medicine and Western Medicine, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China
doi:10.3969/j.issn.1674-4985.2021.13.007
研究顯示,多食已成為眾多疾病的新的病因,而飲食限制(dietary restriction,DR)也成為新的治療手段[1-2]。DR對神經系統退行性病變、糖尿病、心血管疾病和癌癥等治療具有一定作用,其機制與保護線粒體和抗氧化等有關[3-5]。DR的本質是暫時減少細胞的營養供給,而線粒體對營養信號極為敏感,其結構、功能和胞內分布會隨之發生變化,稱為線粒體可塑性[6]。線粒體是多功能網狀細胞器,其損傷不僅減少細胞供能,還會干擾胞內鈣穩態和生物合成,甚至誘發氧化應激和免疫異常,從而參與眾多疾病的發生發展[7-8]。因此,如何在開展DR的同時,盡量減少其對線粒體的影響至關重要。DR方案較多,其限食程度和持續時間不盡相同[2,4,9-11]。本研究設計了相對激進的14 d的50%DR方案,觀察其對正常大鼠海馬神經元線粒體結構、氧化磷酸化(oxidative phosphorylation,OXPHOS)水平和線粒體自噬流的影響,旨在探討DR的安全性,現報道如下。
1 材料與方法
1.1 材料
1.1.1 動物 16只SPF級雄性SD大鼠,體質量(200±10)g,購于遼寧省本溪巿實驗動物中心,適應性飼養(室溫18~23 ℃,相對濕度45%~55%)1周后開始實驗。
1.1.2 主要試劑和抗體 線粒體提取試劑盒(北京索萊寶生物技術有限公司,批號:20170824),JC-1線粒體膜電位(ΔΨm)檢測試劑盒(北京索萊寶生物技術有限公司,批號:20171102),ATP檢測試劑盒(南京建成生物工程研究所,批號:20171107),反應性氧簇(reactive oxygen species,ROS)檢測試劑盒(Tsz Biosciences,批號:201710);山羊抗兔多克隆抗體微管相關蛋白輕鏈3 (microtubule-associated protein light chain 3,LC3)-Ⅰ和Ⅱ (Proteintech, 批號:00010203;00023353)、GADPH(Transgen Biotech,批號:L10515);
兔抗鼠二抗(Proteintech,批號:200000002),EasySee Western blot發光液(北京全式金生物技術有限公,批號:10419)。
1.1.3 主要儀器 JEM-1011透射電鏡(日本電子),iMark酶標儀、轉膜儀和電泳儀(均美國Bio-Rad),高速冷凍離心機(美國,Thermo Sientific,ST-16R)、顯影儀(上海天能科技有限公司,Tanon5200)。
1.2 方法
1.2.1 分組和DR方法 將大鼠按體質量配對分為正常組和DR組,每組8只,均單籠飼養。從實驗的第0天開始,精確稱量每只正常組大鼠的單日進食量,減半為下一天配對DR組大鼠的喂食量。DR持續14 d,實驗結束時沒有大鼠死亡及脫失現象發生。該實驗項目已通過遼寧中醫藥大學實驗動物倫理委員會的審核(20151205)。
1.2.2 標本采集 大鼠腹腔注射10%水合氯醛(0.35 mL/100 g)麻醉后,斷頭取雙側海馬組織,部分于4 ℃下切成約1 mm的3小塊,2.5%戊二醛固定,用于線粒體超微結構觀察;部分置于線粒體蛋白分離緩沖液中,制備海馬組織勻漿后離心(1 000 g,
5 min,4 ℃),取上清同條件再次離心,再取上清離心(1 200 g,10 min,4 ℃)后,吸取沉淀加入100 μL PBS(pH 7.4),制取線粒體懸液備用;海馬其余部分于-80 ℃凍存,用于Western blot檢測。
1.2.3 線粒體超微結構觀察 參考文獻[12-14]方法,將上法固定的組織用PBS漂洗,1%鋨酸固定后,乙醇和丙酮梯度脫水,環氧樹脂包埋切片(50~60 nm厚),3%醋酸鈾-枸櫞酸鉛雙染,120 kV拍片觀察海馬神經元線粒體超微結構。
1.2.4 線粒體OXPHOS評價 取海馬神經元線粒體懸液,按文獻[12-14]方法,JC-1法檢測ΔΨm,ELISA法分別檢測ATP和ROS水平,均嚴格按照說明書操作。
1.2.5 線粒體自噬水平評價 采用Western blot檢測LC3-Ⅰ和Ⅱ表達,并計算兩者比值。依據文獻[9-11]方法,取凍存海馬組織,室溫解凍后加入線粒體蛋白質裂解液,靜置30 min,冰上研磨后置于EP管中,離心(1 000 g,10 min,4 ℃)取上清,BCA法測定蛋白濃度;每管加入6×SDS-PAGE蛋白上樣緩沖液100 μL,100 ℃變性,按50 μg總蛋白上樣量計算加樣體積,SDS-PAGE凝膠電泳后轉膜和切膜,37 ℃水浴5%脫脂奶粉/TBST封閉1 h,分別加入LC3-Ⅰ(1︰200)、LC3-Ⅱ(1︰1 000)和GAPDH(1︰2 000)各4 mL,4 ℃搖床過夜,TBST洗膜,加入4 mL HRP標記的山羊抗兔二抗(1︰5 000),GAPDH加入4 mL HRP標記二抗(1︰
2 000),37 ℃震蕩孵育1 h,TBST洗膜,加入ECL發光液,曝光顯影。應用AlphaView SA軟件計算蛋白表達量,為方便制圖,結果以DR組相當于正常組的百分比表示。
1.3 統計學處理 采用SPSS 22.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
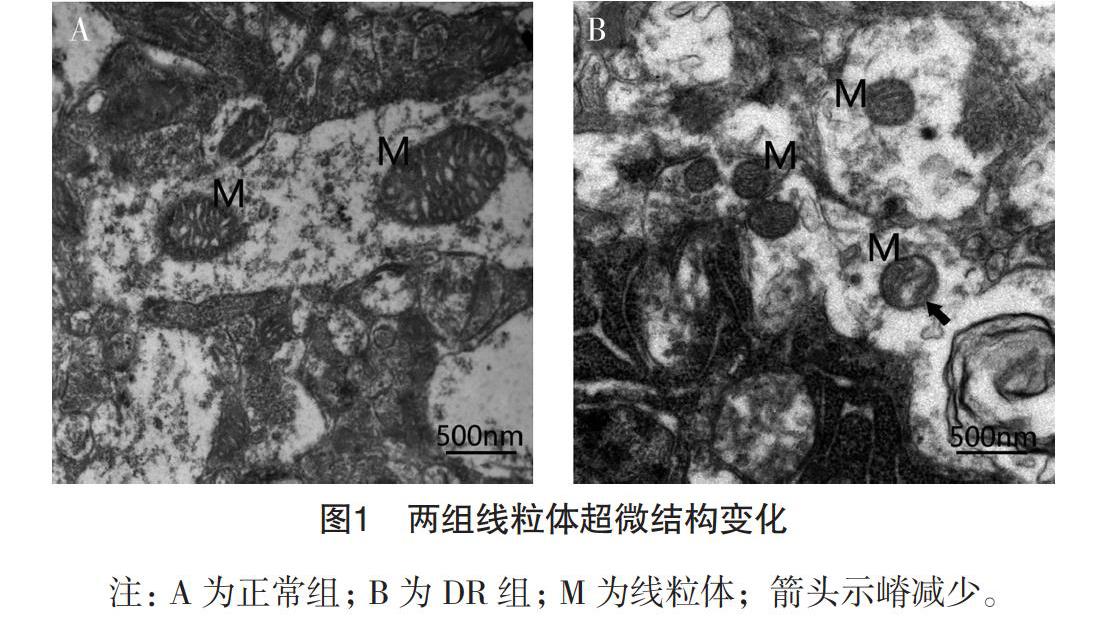
2.1 線粒體超微結構觀察 兩組線粒體均邊緣清楚,但正常組相對較大,嵴呈片狀,數量較多,而DR組的線粒體較小,且存在嵴減少現象。見圖1。
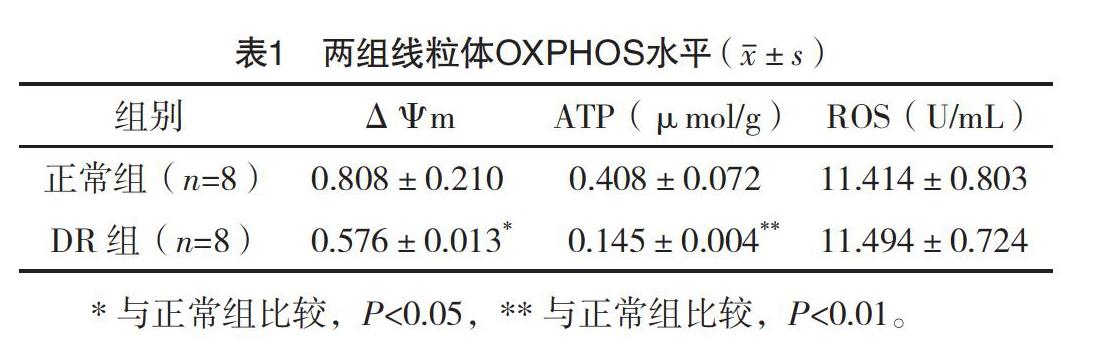
2.2 兩組線粒體OXPHOS水平比較 與正常組比較,DR組的ΔΨm和ATP水平下降,均有統計學意義(P<0.05),但ROS水平變化不明顯,差異無統計學意義(P>0.05),見表1。
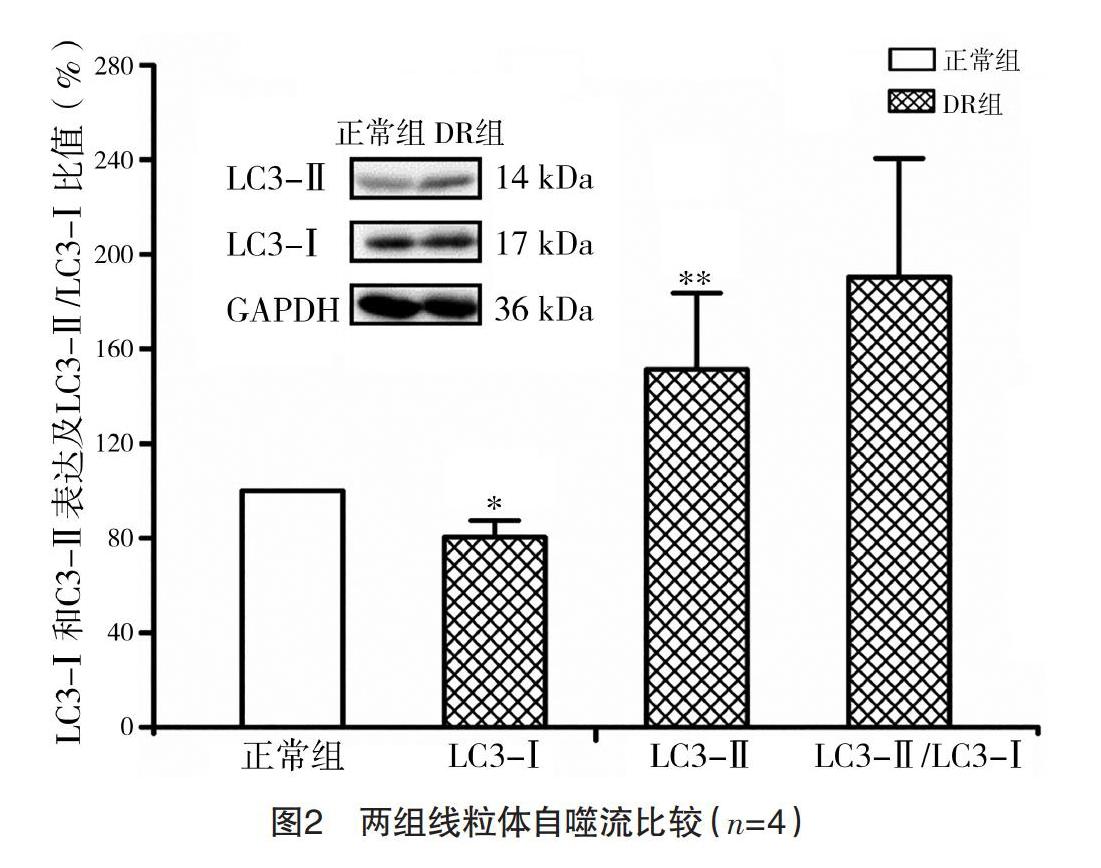
2.3 兩組線粒體自噬流評價 DR組LC3-Ⅰ和LC3-Ⅱ的相對表達量分別為正常組的(80.54±6.89)%與(151.44±32.16)%,DR組的LC3-Ⅱ/LC3-Ⅰ比值為正常組的(190.34±50.18)%。見圖2。
3 討論
海馬是邊緣系統的重要結構,不僅在情緒、認知、行為和學習記憶等方面發揮重要作用,還能夠調節心血管、消化吸收等內臟活動,而其損傷與老年癡呆、帕金森病等的發生發展密切關聯[15]。中樞神經元能量消耗巨大,其中約44%用于突觸傳遞,25%消耗在細胞骨架運動、大分子合成和細胞器間聯絡,16%花費在細胞放電,15%用來維持膜電位[16-17]。線粒體是細胞動力工廠,為細胞提供95%以上的能量,其健康對于細胞至關重要。
DR的本質是暫時減少細胞的營養供給,這勢必干擾線粒體。本研究從形態和功能等方面觀察了14 d的50%DR對海馬神經元線粒體的影響,結果顯示,DR組線粒體變小且部分線粒體嵴減少,ΔΨm和ATP水平降低,但ROS變化不明顯。ATP、ΔΨm和ROS均為線粒體OXPHOS的反應產物,前兩者減少顯示14 d的50%DR影響了海馬神經元線粒體產能,而后者變化不大則提示ROS沒有過度合成,即發生氧化應激的可能性不大。盡管如此,功能異常的線粒體個體如不及時清除,線粒體網絡終將受損,進而在多方面干擾細胞功能。
研究發現,ΔΨm下降可以激活線粒體自噬機制,從而維護線粒體網絡健康[18]。線粒體自噬過程復雜,主要是去極化的線粒體被吞噬泡包裹形成自噬體,再進入溶酶體內被分解[19]。線粒體自噬環節較多,受眾多自噬相關蛋白調控,因此相關蛋白表達水平常可以反映自噬程度,其中較為常用的是LC3。LC3對于吞噬泡的延伸和自噬體的形成等極為重要,其前體先被分解為LC3-Ⅰ后,再被脂化為LC3-Ⅱ[20]。因為LC3-Ⅱ位于吞噬泡膜上和自噬體的內膜和外膜,所以其表達可以反映吞噬泡、自噬體和自噬相關結構的數量,是最為常用的自噬流標志物[21]。本研究結果顯示,DR組的LC3-Ⅱ表達上升,LC3-Ⅰ表達下降,且LC3-Ⅱ/Ⅰ比值上升,說明14 d的50%DR可提高LC3-Ⅱ表達,從而加快吞噬泡的發育,促進自噬體及相關結構的生成,從而有利于清除異常線粒體個體。
綜上所述,海馬神經元線粒體可被14 d的50%DR負性影響,但可通過線粒體自噬進行對抗。不過線粒體自噬水平上升會減少線粒體數量,因此開展DR需注意其時間和強度,防止線粒體網絡受損。
參考文獻
[1] Horne B D,Muhlestein J B,Anderson J L.Health effects of intermittent fasting:hormesis or harm?A systematic review[J].Am J Clin Nutr,2015,102(2):464-470.
[2] Bela?ch R,Boujraf S,Benzagmout M,et al.Implications of oxidative stress in the brain plasticity originated by fasting:a BOLD-fMRI study[J].Nutr Neurosci,2017,20(9):505-512.
[3] Kusuoka O,Fujiwara-Tani R,Nakashima C,et al.Intermittent calorie restriction enhances epithelial-mesenchymal transition through the alteration of energy metabolism in a mouse tumor model[J].Int J Oncol,2018,52(2):413-423.
[4] Jeong J H,Yu K S,Bak D H,et al.Intermittent fasting is neuroprotective in focal cerebral ischemia by minimizing autophagic flux disturbance and inhibiting apoptosis[J].Exp Ther Med,2016,12(5):3021-3028.
[5] Tinsley G M,Horne B D.Intermittent fasting and cardiovascular disease:current evidence and unresolved questions[J].Future Cardiol,2018,14(1):47-54.
[6] Zhou D R,Eid R,Boucher E,et al.Stress is an agonist for the induction of programmed cell death:A review[J].Biochim Biophys Acta Mol Cell Res,2019,1866(4):699-712.
[7] Cadenas S.Mitochondrial uncoupling,ROS generation and cardioprotection[J].Biochim Biophys Acta Bioenerg,2018,1859(9):940-950.
[8] Faitg J,Reynaud O,Leduc-Gaudet J P,et al.Skeletal muscle aging and mitochondrial dysfunction:an update[J].Med Sci(Paris),2017,33(11):955-962.
[9] Stockman M C,Thomas D,Burke J,et al.Intermittent Fasting:Is the Wait Worth the Weight?[J].Curr Obes Rep,2018,7(2):172-185.
[10]施佳,馬娜,楊葉菲.飲食干預影響脂質代謝的作用機制及高脂血癥飲食療法的研究進展綜述[J].中國療養醫學,2019,28(4):390-392.
[11]陳儀坤,楊倩,何睿,等.飲食療法聯合運動干預對老年高血壓患者血壓和生活質量的影響[J].中國老年學雜志,2017,37(17):4272-4274.
[12]宋飛飛,范英麗,劉文俊,等.脾氣虛大鼠股四頭肌線粒體蛋白質控的研究[J].中華中醫藥學刊,2019,37(4):915-918.
[13]許欣竹,李振鈺,劉文俊,等.脾氣虛大鼠胃平滑肌線粒體蛋白質控的研究[J].中國醫藥導報,2019,16(31):10-13.
[14]劉文俊,許欣竹,穆靖洲,等.脾氣虛大鼠海馬神經元線粒體自噬水平及PINK1/Parkin途徑的研究[J].中華中醫藥雜志,2019,34(1):341-343.
[15] Kirschen G W,Kéry R,Ge S.The Hippocampal Neuro-Glio-Vascular Network:Metabolic Vulnerability and Potential Neurogenic Regeneration in Disease[J].Brain Plasticity,2018,3(2):129-144.
[16] Harris J J,Jolivet R,Attwell D.Synaptic energy use and supply[J].Neuron,2012,75(5):762-777.
[17] Howarth C,Gleeson P,Attwell D.Updated energy budgets for neural computation in the neocortex and cerebellum[J].J Cereb Blood Flow Metab,2012,32(7):1222-1232.
[18] Wang Y,Song M,Song F.Neuronal autophagy and axon degeneration[J].Cell Mol Life Sci,2018,75(13):2389-2406.
[19] Pickles S,Vigié P,Youle R J.Mitophagy and Quality Control Mechanisms in Mitochondrial Maintenance[J].Curr Biol,2018,28(4):170-185.
[20] Williams J A,Zhao K,Jin S,et al.New methods for monitoring mitochondrial biogenesis and mitophagy in vitro and in vivo[J].Exp Biol Med(Maywood),2017,242(8):781-787.
[21] Lee Y K,Jun Y W,Choi H E,et al.Development of LC3/GABARAP sensors containing a LIR and a hydrophobic domain to monitor autophagy[J].EMBO J,2017,36(8):1100-1116.
(收稿日期:2020-07-29) (本文編輯:田婧)

