維生素D受體在食管鱗癌中的表達及其與預后的關系
孔金玉,王 健,劉怡文,孫 蔚,原 翔,高社干
食管癌是世界上最常見的惡性腫瘤之一,在中國90%以上為鱗狀細胞癌[1-2],而目前的預防及治療手段欠佳,多數患者仍不能得到有效控制,5 a生存率很低[3]。維生素D(vitamin D,VD)是一種與人體健康密切相關的脂溶性維生素。長期以來,人們對VD的研究主要集中在鈣、磷代謝的調節作用,近年來,VD在抗腫瘤方面的研究受到越來越多的關注。大量研究表明,VD及其類似物可通過抑制腫瘤細胞增殖、浸潤與轉移、誘導細胞分化、促進細胞凋亡、抗血管生成等方式發揮抗腫瘤作用[4]。VD發揮生物學效應的受體是廣泛分布于體內諸多組織內的VD受體(vitamin D receptor,VDR)。目前,VDR與腫瘤的研究主要集中在乳腺癌、肺癌和結腸癌等[5-7],關于VDR在食管鱗癌組織中的表達水平及與臨床病理特征、預后的相關性鮮有報道。本研究擬采用實時定量PCR法檢測食管鱗癌組織中VDR的表達水平,并分析其與臨床病理特征、預后之間的關系,探討VDR在食管鱗癌發生、發展中的作用及意義。
1 資料與方法
1.1 一般資料本研究為回顧性研究,收集河南科技大學第一附屬醫院2012年1月至2014年12月具有明確病理學診斷的原發性食管鱗癌患者組織標本114例,其中男73例,女41例;年齡40~73歲,中位年齡61歲;淋巴結轉移者56例;TNM分期Ⅰ/Ⅱ期66例,Ⅲ期48例。另取其中50例手術切除的癌旁組織作為對照,全部標本收集后立即于-80 ℃冰箱保存。
1.2 主要試劑與儀器TRIzol LS Reagent及TaqMan Expression Kit(美國,Invitrogen);M-MLV逆轉錄酶、0.1 mM DTT、5×First Buffer、RNase Inhibitor和GADPH(美國,Applied Biosystems)。NanoDrop ND1000紫外可見分光光度計(美國,Thermo),7900HT熒光定量PCR(美國,Applied Biosystems)。
1.3 實時定量PCR方法檢測VDR mRNA的表達水平取食管癌或癌旁組織標本100~200 mg,液氮中研磨成粉末狀;加入1 mL的TRIzol,混合均勻;加入200 μL氯仿,12 000 r·min-1,4 ℃離心30 min;加入等體積異丙醇,-20 ℃放置2 h;12 000 r·min-1,4 ℃離心30 min;棄上清,加入1 mL 75%乙醇,洗滌RNA,混勻;12 000 r·min-1,4 ℃離心10 min;重復洗滌1次;NanoDrop紫外分光光度計檢測RNA濃度和純度;1%瓊脂糖凝膠電泳鑒定RNA是否降解;稀釋至工作濃度(50 ng·μL-1),-80 ℃保存。按照逆轉錄試劑盒進行cDNA合成,總反應體系為12 μL。逆轉錄反應條件:25 ℃ 10 min,37 ℃ 50 min,70 ℃15 min。cDNA 樣本在-20 ℃保存。按照TaqMan mRNA Assays的說明進行實時熒光PCR,檢測mRNA表達水平。每個PCR 反應體系為5 μL,設3個復孔,反應條件:95 ℃10 min;95 ℃ 15 s,60 ℃ 60 s;40個循環。以GADPH為內參,Log10(2-ΔΔCt)表示VDR mRNA相對表達量。
1.4 隨訪根據病歷信息進行隨訪,死于其他疾病、失訪或隨訪截止時間仍存活視為截尾數據。114例患者中死亡66例,均死于食管癌相關的并發癥或復發遠處轉移;總生存期(overall survival, OS)定義為確診日期至死亡日期或最近一次隨訪日期(2020年12月)。
1.5 統計學處理采用SPSS 19.0軟件包進行統計分析,采用 Log10(2-ΔΔCt)計算mRNA相對表達量,mRNA在癌和相應癌旁組織中的表達比較采用配對t檢驗,VDR mRNA表達水平與臨床病理特征的相關性采用χ2檢驗。Kaplan-Meier法繪制生存曲線,Log-rank檢驗生存時間的差異。α=0.05,以P<0.05為差異具有統計學意義。
2 結果
2.1 VDR mRNA在食管鱗癌及癌旁組織中的表達水平應用實時定量PCR方法檢測50例食管鱗癌及相應的癌旁組織中VDR mRNA的表達水平,結果顯示,VDR mRNA在食管鱗癌組織中平均表達水平(5.39 ± 0.52)低于癌旁組織(5.92 ± 0.54),差異有統計學意義(t=4.958,P<0.05)。見圖1。
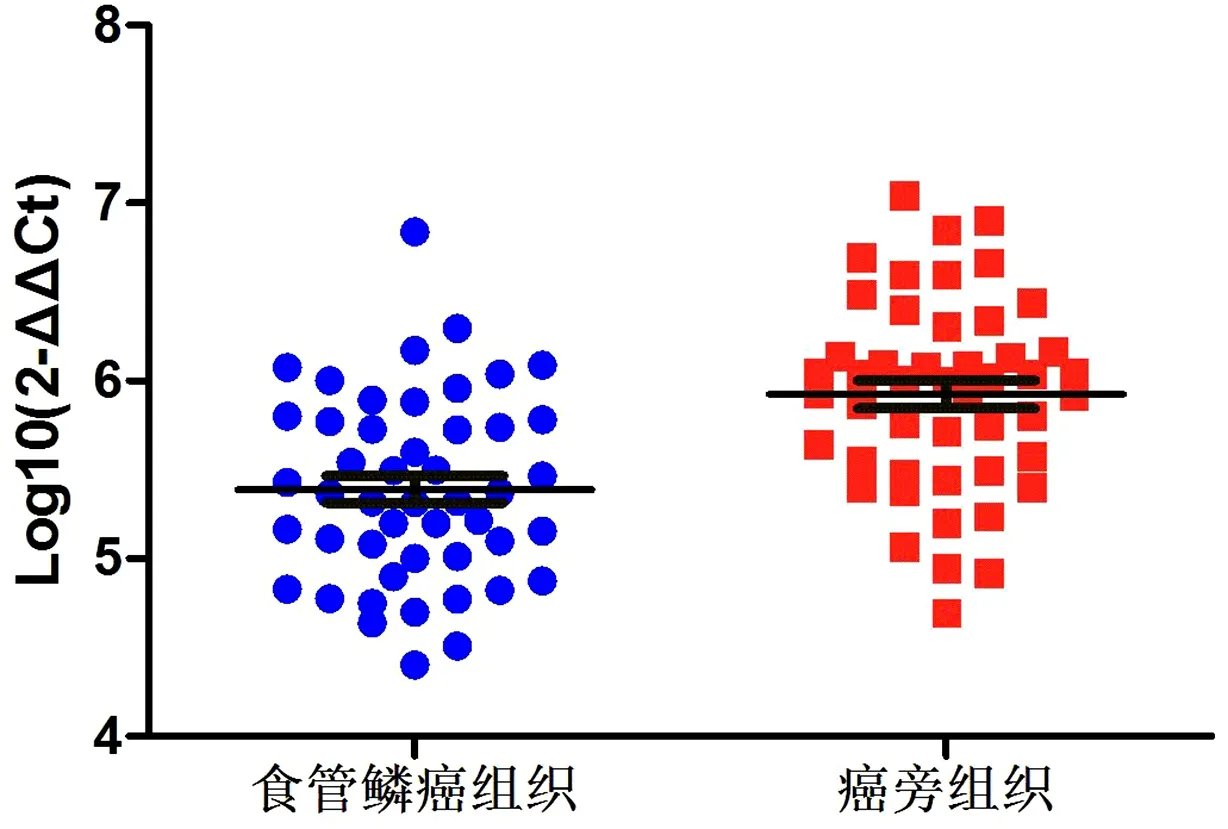
圖1 VDR mRNA在食管鱗癌組織及癌旁組織中的表達水平
2.2 VDR mRNA表達與臨床病理特征相關性分析進一步檢測VDR在114例食管鱗癌中的表達,利用VDR mRNA表達的中位值(5.550)將患者分成高表達、低表達兩組。如表1所示,VDR基因表達水平和性別(χ2=6.437,P=0.011)、吸煙(χ2=3.947,P=0.047)和淋巴結轉移相關(χ2=5.054,P=0.025),差異有統計學意義。
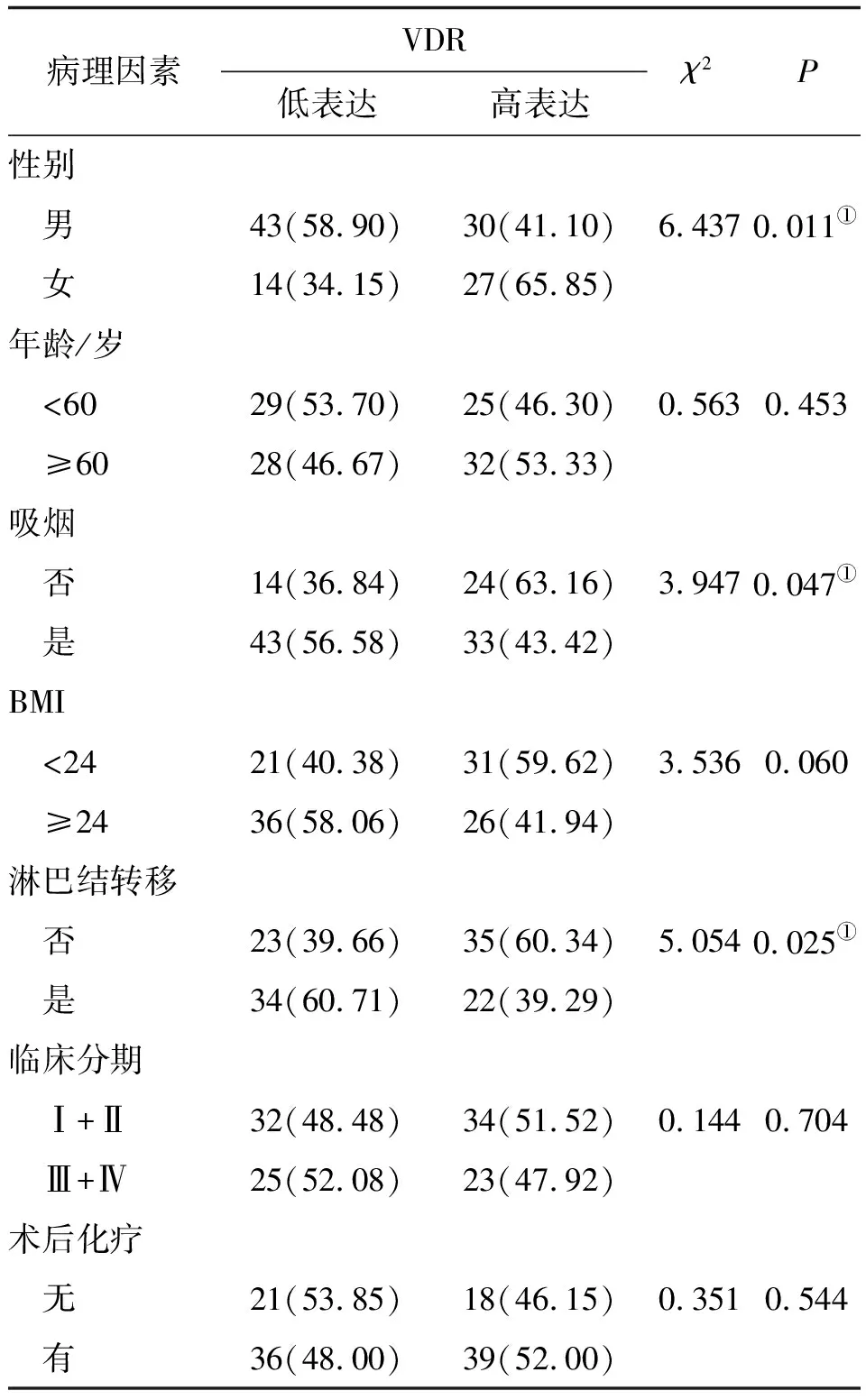
表1 食管鱗癌組織中VDR mRNA表達與臨床病理特征的關系 例(%)
2.3 VDR mRNA表達與食管鱗癌預后的關系運用Kaplan-Meier法繪制生存曲線,采用Log-rank檢驗比較生存時間的差異,分析VDR mRNA表達與食管鱗癌患者預后的相關性,圖2結果顯示,114例食管鱗癌患者術后VDR mRNA高表達組中位生存期為65.5個月,明顯高于低表達組(22.7個月),提示VDR mRNA高表達與食管鱗癌患者生存預后較好有關(χ2=4.906,P=0.027)。
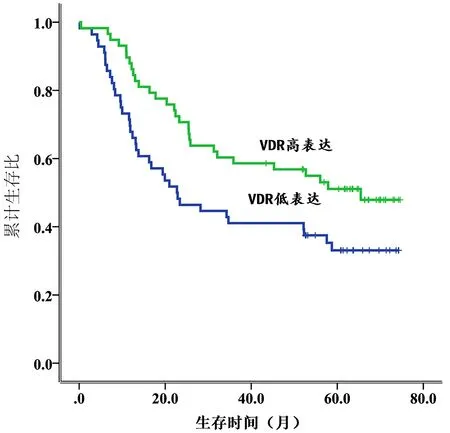
圖2 食管鱗癌中VDR mRNA高表達與低表達的生存曲線
3 討論
維生素D是一種脂溶性的類固醇衍生物,在骨代謝和鈣穩態中發揮重要作用,近年來研究發現,VD具有潛在的抗腫瘤作用,其抗腫瘤作用機制包括抑制腫瘤細胞增殖、侵襲轉移、誘導細胞凋亡、促進細胞分化等。除此之外,VD還參與調節免疫、抑制炎癥等多個生物學過程[8]。VDR廣泛分布于小腸、腎、骨、皮膚、甲狀旁腺、結腸、乳腺、胰腺等正常組織中,同時也表達于這些組織的癌細胞中[9]。VD的生物學功能是通過與VDR結合調節靶基因轉錄來實現的,當游離的1,25(OH)2D3進入細胞后被轉移至核內,與VDR結合并使VDR發生磷酸化,從而導致VDR構象的改變,進而與類視黃醇X受體(retinoid X recepto,RXR)結合形成異質二聚體,VD-VDR復合物作為轉錄因子,作用于其靶基因啟動區中的特異DNA序列(維生素D反應元件,vitamin D responsive element,VDRE),從而激活或抑制基因轉錄[10]。
VDR表達于大多數腫瘤細胞中,包括食管癌。既往VDR和食管癌的研究主要為腺癌,在食管腺癌中VDR表達水平隨著腫瘤去分化而下降。與食管正常鱗狀上皮相比,VDR在Barrett食管黏膜中的表達顯著升高[11-12]。在食管鱗癌細胞中VDR基因多態性和不良預后相關[13]。Mimori K等[14]研究發現,與正常食管組織相比,VDR在食管癌組織中表達較低,其低表達與預后較差相關,表現為腫瘤細胞的淋巴結轉移、浸潤侵襲及血行擴散能力增強。該研究提示VDR表達下調可能在食管癌的進展中發揮著重要作用,而VDR基因表達上調具有改善食管癌預后的潛在可能。另外,相關體外及動物模型研究表明,VD能抑制食管鱗癌細胞增殖,使細胞周期阻滯在G0/G1期,并誘導腫瘤細胞凋亡[15-16]。
本研究采用實時定量PCR法檢測VDR mRNA在食管鱗癌中的表達水平,并分析其與臨床病理特征及預后的相關性。研究發現VDR mRNA在食管鱗癌組織中的表達顯著低于相應的癌旁組織。VDR mRNA低表達與預后較差、生存時間較短相關。本研究結果與相關文獻報道一致[14]。除此之外,VDR mRNA表達與食管癌患者性別、吸煙及淋巴結轉移相關,提示VDR mRNA低表達在食管癌患者中男性多于女性,吸煙患者多于非吸煙患者,VDR mRNA低表達患者易發生淋巴結轉移。
綜上所述,本研究表明VDR mRNA在食管鱗癌組織中的表達水平顯著低于癌旁組織,且其表達與患者的臨床病理類型及預后密切相關。VDR有望成為食管鱗癌預后的判斷指標及潛在的治療靶點。

