一線和二線免疫治療對非小細胞肺癌患者外周血免疫抑制細胞的影響
馮九星, 陳淑靖, 鄭添琪, 李雙琦, 李佳旻, 蔣進軍*
1. 復旦大學附屬中山醫院呼吸與危重癥醫學科,上海 200032 2. 復旦大學生物醫學研究院,醫學表觀遺傳與代謝重點實驗室,上海 200032
肺癌是最為常見的惡性腫瘤之一,非小細胞肺癌(non-small cell lung cancer,NSCLC)約占肺癌的80%[1]。盡管治療方法不斷出現,但是以NSCLC為主的肺癌仍是主要的致死癌種[2]。臨床上,化療和放療被認為是無靶向基因突變NSCLC的主要治療方案[3-4]。
近年來,免疫檢查點抑制劑,如PD-1抑制劑,已經被國內外批準用于多種癌癥的治療,包括晚期NSCLC患者,但是獲益人群比例仍不高[5]。晚期NSCLC患者通常已經歷多周期的化療和放療療法,且大部分患者出現不同程度的轉移[6]。而進一步惡化的病情可能導致假陰性免疫治療不應答,從而影響免疫治療療效。
腫瘤免疫微環境(tumor immune microenvironment, TIME)中的免疫抑制細胞包括髓系來源抑制性細胞(myeloid-derived suppressor cells, MDSCs)、腫瘤相關性巨噬細胞和調節性T細胞(regulatory T cells,Tregs)[7]。MDSCs一般分為單核細胞-髓系來源抑制性細胞(monocytic myeloid-derived suppressor cells,M-MDSCs)和粒細胞-髓系來源抑制性細胞(granulocytic myeloid-derived suppressor cells,G-MDSCs)。目前一線或二線免疫治療對這些免疫抑制細胞產生的影響尚不清楚。因此,為探討一線和二線免疫治療對機體內TIME的影響,本研究檢測一線和二線免疫治療患者PD-1抑制劑第1次治療前后外周血中上述3種主要免疫抑制細胞的變化,為其臨床應用提供參考。
1 資料與方法
1.1 研究對象 選擇2018年1月至2019年10月復旦大學附屬中山醫院收治的NSCLC患者27例,在PD-1抑制劑治療前后采集患者外周血。根據患者接受PD-1抑制劑治療前是否曾接受化療,分為PD-1抑制劑一線免疫治療組(一線組,n=7)和PD-1抑制劑二線免疫治療組(二線組,n=20)。納入標準:(1)年齡>18歲;(2)無靶向基因突變;(3)NSCLC晚期。本研究獲得復旦大學附屬中山醫院倫理委員會批準(B2019-204R),所有患者均簽署知情同意書。
1.2 治療方案 一線組和二線組在接受PD-1抑制劑治療階段均使用帕博利珠單抗,化療頻率和劑量均為3周/次,每次200 mg。本研究細胞數量數據均為患者完成第1次PD-1抑制劑治療后的檢測結果。
1.3 隨訪方案 隨訪期即患者使用PD-1抑制劑治療期,平均隨訪時間為16.9(3.6~38.9)周。隨訪方式為每次來院進行注射PD-1抑制劑,治療前后均采集外周血留待分析,并使用計算機化X線體層照相術(CT)記錄腫瘤體積變化情況。患者采用PD-1治療2個周期后,若符合臨床評估標準后,便后續只觀察細胞免疫的變化。本研究主要終點事件為隨訪終止,次要終點事件為患者選擇停止用藥。
1.4 腫瘤大小測量及臨床效果評估標準 PD-1抑制劑治療前后,采用CT記錄腫瘤體積變化情況。根據RECIST v1.1指導準則[8],將患者分為部分緩解(partial response,PR)、疾病穩定(stable disease,SD)、疾病進展(progressive disease,PD)。PR: 靶病灶最大徑之和減少≥30%,至少維持4周。SD:靶病灶最大徑之和縮小未達PR,或增大未達PD。PD: 靶病灶最大徑之和至少增加≥20%或出現新病灶。
1.5 外周血流式分析 分別取100 μL新鮮外周血液于1.5 mL的EP管中,每管加入1 μL Fc阻斷劑,4℃封閉10 min,加入目的Marker染色組合,M-MDSCs: CD33+CD11B+HLA-DR-CD15-CD14+、G-MDSCs:CD33+CD11B+CD14-CD15+、Tregs: CD4+CD25+CD127-。加入抗體后,輕輕渦旋混勻,4℃條件下閉光染色30 min。每管中加入1 mL的紅細胞裂解液,閉光裂解4 min。4℃,350×g離心5 min,吸去上清液,加入1 mL預冷的PBS清洗,4℃,350×g離心5 min,重復清洗1次。加入350 μL預冷的含有1%多聚甲醛的PBS重懸細胞,將重懸液轉移到流式管中。采用BD Fortessa進行目標細胞群的檢測,并用Flow Jo軟件進行數據分析。
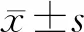
2 結 果
2.1 臨床效果評價 27例NSCLC患者中,接受一線免疫治療7例(25.9%),接受二線免疫治療20例(74.1%)。一線組中,PR比例為57.1%(4/7),SD比例為28.6%(2/7),PD比例為14.3%(1/7)。二線組中,PR比例為15%(3/20),SD比例為55%(11/20),PD比例為30%(6/20)。7例(25.9%)PD患者由于疾病進展而停止使用PD-1抑制劑治療。
2.2 治療前免疫抑制細胞水平 流式細胞分析結果(圖1)顯示:治療前,一線組和二線組外周血中M-MDSCs、G-MDSCs和Tregs水平差異無統計學意義(P=0.87、0.12、0.56)。

圖1 免疫治療前2組間M-MDSCs、G-MDSCs和Tregs水平差異
2.3 治療前后外周血中M-MDSCs水平變化 流式細胞分析結果(圖2)顯示:與治療前相比,治療后一線組M-MDSCs在外周血中的水平下降(P<0.05)。與治療前相比,二線組在治療后M-MDSCs水平差異無統計學意義。

圖2 2組患者免疫治療前后外周血M-MDSCs水平變化
2.4 治療前后外周血中G-MDSCs水平變化 結果(圖3)顯示:治療前后,一線組和二線組患者G-MDSCs差異均無統計學意義。

圖3 免疫治療前后2組外周血中G-MDSCs水平變化
2.5 治療前后外周血中Tregs水平變化 結果(圖4)顯示:與治療前相比,治療后Tregs在一線組和二線組中均顯著上升(P<0.05,P<0.01)。

圖4 免疫治療前后2組外周血Tregs水平變化
2.6 治療后外周血免疫抑制細胞水平 結果(圖5)顯示:第1次免疫治療后,二線組比一線組外周血中M-MDSCs細胞群水平更高(P<0.05)。G-MDSCs和Tregs在2組間差異無統計學意義(P=0.71、0.47)。

圖5 免疫治療后2組外周血M-MDSCs、G-MDSCs和Tregs水平比較
2.7 相關性分析 結果(圖6)顯示:Tregs變化量和療效不相關(P=0.19),M-MDSCs比例下降值和療效相關(r=-0.04,P=0.001 3),即變化值為負數且其絕對值越大,療效越好(療效等級為2)。

圖6 Tregs和M-MDSCs治療前后比例變化值和療效的相關性分析
3 討 論
本研究通過招募NSCLC患者初步探究一線免疫治療和二線免疫治療在腫瘤控制過程中效果的差異,并分析了2組患者在接受PD-1抑制劑治療后外周血M-MDSCs、G-MDSCs和Tregs水平的變化。本研究初步證實,晚期基因突變陰性NSCLC患者接受一線免疫治療較二線免疫治療具有更好的臨床療效,而且第1次免疫治療后,一線免疫治療組有更低水平的M-MDSCs,預示著在前者中更低的由M-MDSCs造成的免疫抑制活性,但是G-MDSCs沒有相應變化。相比之下,Tregs水平在2組中均顯著上升,但二線PD-1抑制劑治療組中上升的趨勢更加明顯。外周血M-MDSCs顯著下降與療效相關;Tregs顯著增加,但與療效無關。
TIME中主要的免疫細胞成分是MDSCs,這是一類起源于腫瘤患者骨髓,移行到外周血和腫瘤組織中的不成熟的髓系細胞。MDSCs可通過一氧化氮代謝通路和增加PD-L1的表達等機制抑制T細胞和自然殺傷細胞的抗腫瘤活性,MDSCs活性的維持不但與腫瘤生長相關,也與腫瘤轉移相關[9]。作為TIME中重要的免疫抑制細胞,Tregs細胞與腫瘤的發生和進展密切相關,是免疫治療有效的主要因素之一,當患者外周血中Tregs數量減少或者消失時,腫瘤也就容易被控制[10]。黑素瘤的研究[11]表明,使用PD-1抑制劑治療有效的患者外周血中Tregs細胞的數量和腫瘤抑制活性明顯降低。外周血中MDSCs比腫瘤組織中MDSCs的變化更能反映PD-1抑制劑的療效,因此只檢測外周血中免疫抑制細胞也具有參考意義[9]。
本研究表明,一線免疫治療的效果明顯優于二線免疫治療,與KEYNOTE-001研究[12]的5年隨訪結果一致。本研究通過流式細胞儀分析探究了一線和二線免疫治療后3種腫瘤免疫細胞的變化情況。本課題組在前期研究[13]中發現,NSCLC患者外周血中M-MDSCs的下降能顯著增強PD-1抑制劑治療的效果。在確定M-MDSCs、G-MDSCs和Tregs的基線水平在3組中差異無統計學意義的條件下,發現一線組中M-MDSCs在第1次免疫治療后顯著下降,而二線免疫治療組沒有明顯變化。更重要的是,第1次免疫治療后,一線組的M-MDSCs水平較二線組更低,預示著在前者中更低的M-MDSCs導致的低免疫抑制活性及更好的抗癌療效。
同時,G-MDSCs在一線和二線組中差異無統計學意義。與M-MDSCs僅在一線組有變化相比,Tregs的水平在2組中均顯著上升,且二線組中上升趨勢更加明顯。在患者體內,PD-1抑制劑往往會引起機體的免疫增強,此時免疫系統為了保護正常細胞免于過度免疫的影響,往往會增強微環境中的免疫抑制活性。根據臨床效果和Tregs的相應變化情況,推測在PD-1抑制劑使用后外周血中上調的Tregs水平可能是機體對于免疫增強后啟動免疫平衡保護機體免受過度免疫的傷害[12]。另一方面,在二線組中更高水平的Tregs細胞抑制了PD-1抑制劑的腫瘤免疫治療效果。因此,M-MDSCs和Tregs變化引起的免疫微環境的免疫抑制活性的動態變化可能有效增強或限制PD-1抑制劑的免疫治療效果。本研究表明,一線和二線免疫治療引起的腫瘤免疫細胞的變化不同。一線免疫治療的臨床療效更好可能與TIME不同相關,其中TIME的主要免疫抑制細胞M-MDSCs降低和Tregs輕微升高可能是具體機制。這也說明,對于NSCLC,一線免疫治療可能比二線免疫治療獲益更多。當然這需要更進一步的基礎研究驗證。
本研究存在一定的局限性:(1)患者群體僅有27例,樣本量偏小,而且分到各組中的人數也較少。(2)檢測患者外周血中3種細胞的變化,而未檢測腫瘤組織中的比例差異,也未檢測外周血中腫瘤相關性巨噬細胞。
綜上所述,晚期NSCLC患者接受一線免疫治療較二線免疫治療具有更好的臨床療效, 一線免疫治療組外周血M-MDSCs顯著下降與療效相關;G-MDSCs無變化,但二線免疫治療組Tregs顯著增加,但與療效無關。

