超聲心動圖及二維斑點追蹤評估心房顫動對左心房形態及功能的影響
王亞男, 趙盈潔, 程羽菲, 陳海燕, 舒先紅
復旦大學附屬中山醫院心臟超聲診斷科,上海市心血管病研究所,上海市影像醫學研究所,上海 200032
心房顫動(atrial fibrillation,AF),簡稱房顫,是臨床最為常見的心律失常之一,在成年人中患病率為2%~4%[1],且隨年齡增長而增加,在大于80歲人群中為5%~15%[2-3]。房顫會明顯提高患者血栓及栓塞風險,引起腦卒中、心衰等嚴重影響生活質量的疾病[4-6]。然而,陣發性房顫因可自行轉復為竇性心律,需要發作時的心電圖方可診斷,容易漏診。在房顫發展過程中,會出現進行性心房增大、心肌重構等現象,影響心房及心室功能[7]。斑點追蹤測定心肌應變是用于評價心肌形變及功能的新方法,既往也被套用于左心房的功能分析[8]。本研究擬應用針對左心房的最新分析軟件評估左心房應變,探討其能否識別不同病程階段心房重構導致的心房壁應變損傷,提高陣發性房顫的診斷準確性。
1 資料與方法
1.1 研究對象 順序入組2020年7月24日至2020年8月5日復旦大學附屬中山醫院收治的非瓣膜病性房顫患者62例,根據行超聲心動圖檢查時為竇性心律或房顫心律分為房顫竇律組(n=32)及房顫組(n=30),其中男性47例,女性15例,年齡31~80(60.3±11.7)歲。
納入標準:(1)年齡18歲以上;(2)有心電圖或動態心電圖的房顫診斷依據。排除標準:(1)先天性心臟病;(2)心臟瓣膜病;(3)冠脈粥樣硬化性心臟病;(4)既往心臟手術史;(5)透聲條件較差者。同時選擇30例無心血管疾病的志愿者作為對照組,其中男性19例,女性11例,年齡22~67(44.9±11.6)歲。本研究經復旦大學附屬中山醫院倫理委員會批準(B2021-334),所有患者均知情并簽署知情同意書。
1.2 儀器與方法 使用Philips EPIQ7C超聲診斷儀,S5-1探頭(頻率1~5 MHz)。受檢者記錄身高、體質量,取左側臥位,連接心電圖,采集心尖四腔觀、心尖二腔觀、心尖長軸觀二維動態圖像,所有圖像均采集連續5個心動周期并測量相關參數。(1)心房形態參數:采用雙平面Simpson法測量左心房最大容積(left atrial maximum volume,LAVmax)、最小容積(left atrial minimum volume,LAVmin)及排空分數(left atrial emptying fraction,LAEF)。(2)心房功能參數:采用Qlab脫機分析軟件-自動左心房應變(Auto LA Strain)測量模塊進行心房應變參數測量,見圖1。
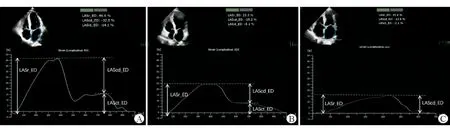
圖1 采用Qlab軟件測量左心房應變
軟件自動追蹤左心房房壁結構,必要時手動調整直至所有房壁追蹤滿意。左心房應變以時間-應變曲線及測量值形式呈現,分為存儲應變(left atrial reservoir strain, LASr)、通道應變(left atrial conduct strain, LAScd)、收縮應變(left atrial contraction strain, LASct)。存儲應變,即存儲期應變,指二尖瓣開放與左室舒張末期應變值之差,為正值;通道應變,即通道期應變,為左心房收縮起始與二尖瓣開放應變值之差,為負值;收縮應變:即收縮期應變,為左室舒張末期與左心房收縮起始應變值之差,為負值。指南[9]規定房顫患者心房應變測量應以舒張末期為參照點,故本研究所有受檢者的測量均采用舒張末期作為參照點。所有應變值測量連續5個心動周期取平均值。
1.3 重復性分析 隨機選取10例竇性心律及10例房顫心律受檢者進行重復性分析:觀察者內一致性分析由同一檢查者間隔2個月分別測量完成;觀察者間一致性分析由2位檢查者分別測量完成。觀察者內及觀察者間一致性檢驗使用組內相關系數(intra class correlation coefficients,ICC)表示。
2 結 果
2.1 一般資料分析 結果(表1)顯示:共納入92例患者,其中對照組30例;房顫竇律組32例,均為陣發性房顫,病程為1周至20年;房顫組30例,28例為持續性房顫,2例為陣發性房顫發作,病程9 d至20年。
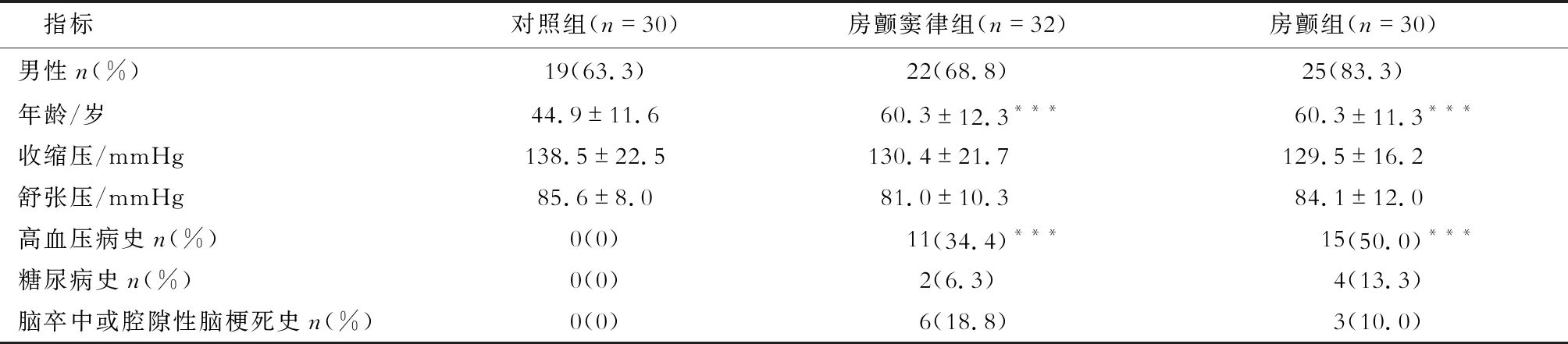
表1 3組患者的一般情況比較
2.2 左心房形態及功能參數比較 結果(表2)顯示:房顫竇律組、房顫組左心房容積(LAVmax、LAVmin)較對照組顯著增大,且房顫組>房顫竇律組>對照組,使用體表面積校正左心房容積指數(left atrial volume index,LAVI)后這一梯度仍然具有統計學意義。LAEF則逐漸下降(房顫組<房顫竇律組<對照組)。
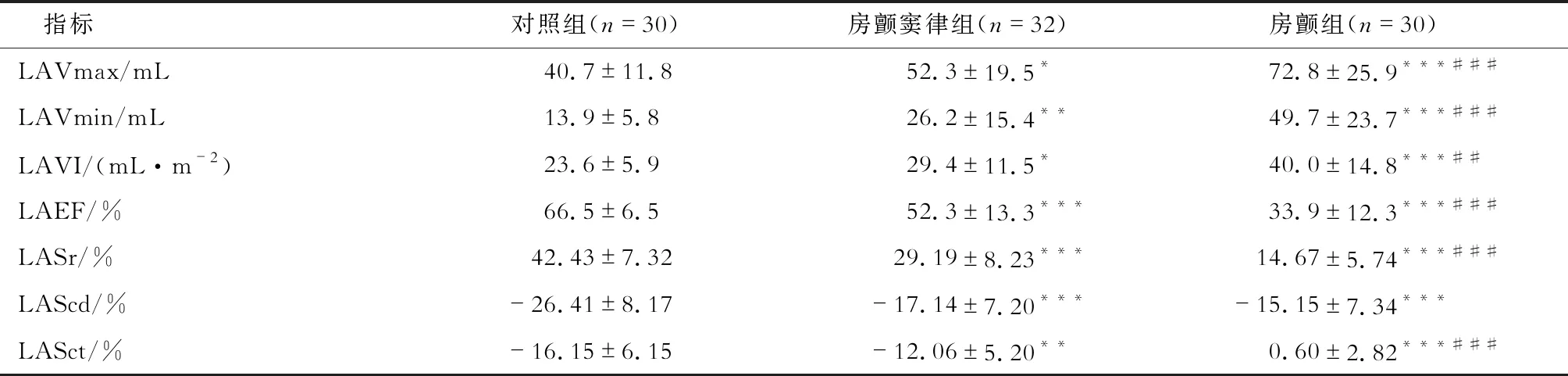
表2 3組患者左心房容積及功能比較
LASr在3組間呈現梯度減小趨勢(房顫組<房顫竇律組<對照組,P<0.05);房顫竇律組和房顫組LAScd顯著小于對照組,但2組間差異無統計學意義;房顫竇律組LASct也較對照組顯著降低;由于房顫時心房不具有收縮功能,按指南規定,對房顫組LASct不予評估。
2.3 心房形態及功能參數對陣發性房顫的診斷價值 結果(圖2)顯示:LAVmin:截斷值22.3 mL,特異度88.9%,靈敏度62.5%,AUC 0.793;LAScd: 截斷值-19.93%,特異度81.3%,靈敏度85.2%,AUC 0.826。LAEF: 截斷值62.95%,靈敏度74.1%,特異度87.5%,AUC 0.840;LASr:截斷值32.73%,靈敏度88.9%、特異度75.0%,AUC 0.880。
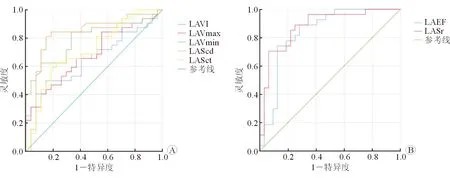
圖2 左心房參數診斷陣發性房顫(A)和參數排除陣發性房顫(B)的ROC曲線
2.4 重復性分析 LASr、LAScd及LASct的觀察者內ICC分別為0.972(95%CI 0.932~0.989),0.949(95%CI 0.876~0.979)和0.977(95%CI 0.942~0.991)。LASr、LAScd及LASct測量的觀察者間ICC分別0.946(95%CI 0.870~0.978),0.874(95%CI 0.710~0.948)和0.943(95%CI 0.789~0.986),均P<0.001。
3 討 論
房顫是最為常見的心律失常,可導致卒中[4]、栓塞[5]、心衰[6,10]等并發癥,顯著影響患者生活質量,并增加死亡率[11-12]。左心房重構是房顫的典型病理生理改變。多種病因作用于心房肌和細胞外間質,反應性膠原纖維沉積導致房壁纖維化[13],左心房纖維化和擴張引起結構重構,進而產生電重構,導致陣發性房顫[14-16];纖維化持續進展,最終導致持續性房顫[17]。心臟磁共振釓顯像是確定心房纖維化的重要診斷方法[18]。Kuppahally等[19]研究表明,延遲增強磁共振顯示左心房纖維化與左心房應變負相關,并與房顫負荷有關。然而,磁共振價格昂貴,釓顯像也有不良反應,尤其在腎功能不全患者中不宜使用[20]。斑點追蹤技術可以追蹤心動周期中超聲二維灰階斑點的位置變化,從而評價局部心肌的形變能力[21]。在接受外科手術治療的重度二尖瓣反流患者中,左心房形變相關指標尤其是左心房縱向應變與左心房纖維化分級顯著負相關,是左心房纖維化強有力的獨立預測因子,并與左心房心內膜厚度負相關,提示左心房縱向形變的異常與其纖維化和重塑的程度密切相關[22]。EACVI/EHRA關于房顫的專家共識文件[23]也指出了左心房應變是非常具有前景的指標。
然而,由于缺乏對應的軟件,左心房應變的分析通常套用左心室應變分析軟件進行[8],但左心房形態及心肌特征與左心室存在較大的差異。本研究采用左心房針對性應變分析模塊,該模塊基于人工智能技術,通過對超聲大數據庫深度學習強化了針對左心房結構及房壁識別的能力。軟件能夠準確追蹤左心房壁,重建其運動軌跡,并根據在不同時相(存儲期、通道期、收縮期)發生的形變自動計算相應應變(LASr、LAScd、LASct)。本研究顯示使用其進行左心房縱向應變的測試具有較好的重復性,LASr、LAScd、LASct的觀察者內及觀察者間內部相關系數ICC大多接近或超過95%。
本研究發現左心房功能相關指標LASr、LAEF在對照組、房顫竇律組及房顫組間呈梯度性下降;左心房結構相關指標LAVmax、LAVmin及LAVI在3組間呈梯度性增大,這與房顫時心房重構的進行性加重相符。而盡管房顫患者LAScd較對照組顯著降低,在房顫竇律組與房顫組間差異無統計學意義,這表明LAScd先于LASr、LAEF以及左心房結構相關指標LAVmax、LAVmin及LAVI,在陣發性房顫的時期已經受損。此外,LASct也在陣發性房顫時期就已受損,而房顫心律時因心房不具有收縮功能,因此對于持續性房顫患者LASct不做評估。
研究[24]表明,在老年患者中心房容積越大房顫發生風險越高,其中心房最小容積的大小是發生房顫的獨立預測因子。本研究發現竇性心律的樣本中,LAVmin具有較好的陽性預測價值。盡管LAVmin是一項體現左心房結構功能的指標,但其受到左心房排空能力的影響,即同樣大小的LAVmax,排空能力越強,LAVmin越小,反之LAVmin越大。因此LAVmin的增大不僅反映了心房增大的結構變化,也反映了心房收縮的功能變化。此外,在房顫病程較早期受損的LAScd對陣發性房顫也具有較好的陽性預測價值;而較晚受損的LAEF和LASr則具有較好的陰性預測價值。
本研究存在一定的局限性:(1)樣本量較小;(2)僅使用新軟件測量左心房應變,未與傳統的套用左心室應變的方法比較以證明其準確性;后續將擴大樣本量,并進行進一步的對比研究。
綜上所述,超聲斑點追蹤技術評估左心房應變具有較好的重復性。通過超聲斑點追蹤技術評估的左心房功能變化結合二維超聲評估的左心房結構變化能夠反映不同病程階段房顫的心房特征。LAVmin、LAScd可用于輔助發現陣發性房顫的可能,LAEF和LASr可用于輔助排除陣發性房顫的可能。

