抗GPC3/CD3雙特異性重鏈抗體的制備及其抗肝癌作用評價
李永成, 祝強強, 王彥婷, 王 洋, 孫亞奇, 陸 斌*
1. 海軍軍醫大學藥學院生化藥學教研室,上海 200433 2. 上海市第四人民醫院病理科,上海 200434 3. 海軍軍醫大學長海醫院藥劑科,上海 200433
肝細胞肝癌(hepatocellular carcinoma,HCC)是全球癌癥死亡的第四大常見病種[1],五年生存率僅為10%[2]。晚期肝癌患者喪失手術切除指征,只能進行放化療,治療效果欠佳[3-4]。因此針對肝癌進行特異性靶標的篩選和生物靶向治療成為了研究熱點。Glypican-3(GPC3)是硫酸乙酰肝素糖蛋白家族中的一員,通過糖基磷脂酰肌醇(GPI)錨定在細胞膜表面。約70%的HCC存在GPC3表達[5],而絕大多數正常成人組織及肝臟良性病變中沒有表達[6]。研究[7]還發現,GPC3在刺激細胞惡性轉化,通過經典Wnt信號通路促進肝癌生長中起著關鍵作用。因此,GPC3作為一種肝癌特異性表達抗原,是肝癌免疫治療的潛在靶點。
既往抗GPC3人源化抗體GC33的Ⅱ期臨床試驗發現其在晚期HCC患者中療效未達到預期,終止了臨床試驗[8]。抗GPC3單域抗體HN3作為一種僅含單個重鏈可變區的特殊抗體,具有相對分子質量小且易于滲透的特點,能發揮一定的抗肝癌效果[9]。將其與PE38等毒素融合構建免疫毒素,可進一步增強抗腫瘤活性[10]。將抗CD3 scFv和抗GPC3 scFv用短的Linker進行連接構建雙特異性T細胞銜接子(BiTE),可有效募集T細胞靶向殺傷GPC3陽性肝癌細胞[11]。但BiTE親和力低、純化困難和半衰期短的缺點限制了其應用。
另外靶向GPC3的嵌合抗原受體T細胞(CAR-T)免疫療法也是目前肝癌治療熱點之一,多個機構開展了臨床試驗,其中一項Ⅰ期臨床試驗結果表明了其初步安全性[12]。但是發熱、淋巴細胞計數減少和細胞因子釋放綜合征(CRS)等不良反應以及個體化療法存在的高成本和批量生產的局限性,限制了其進一步發展。
因此,本研究通過將抗GPC3 sdAb和抗CD3 sdAb相結合構建抗GPC3/CD3 BiHcAb,一方面較傳統雙特異性抗體相對分子質量小,易于滲透;另一方面加入IgG4 Fc段有利于提高穩定性、便于純化。本研究主要初步評價其體內外的抗肝癌效果。
1 材料與方法
1.1 細胞系 人肝癌細胞系SK-Hep-1和Hep3B,人皮膚鱗癌細胞系A431,HEK-293F,人淋巴瘤細胞Raji均由本實驗室保存。A431-GW為穩定轉染人GPC3的A431細胞。PMBC來源于健康人(海軍軍醫大學醫學研究倫理委員會倫理審批號:NMUMREC-2021-050)。
1.2 細胞培養 A431和A431-GW于含10% FBS的DMEM培養基中進行培養,Hep3B和SK-Hep-1于含15% FBS的MEM培養基中進行培養,PBMC于10% FBS的RPMI 1640培養基中進行培養,培養條件5%CO2、37℃、飽和濕度。HEK-293F細胞在無血清CD 293 TGE Medium培養基中進行培養,培養條件7%CO2、37℃,轉速115 r/min(r=2.5 cm),飽和濕度。
1.3 載體構建 委托金唯智生物公司全基因合成抗CD3和抗GPC3重鏈可變區,其氨基酸序列參考WO2010037838A2和US9206257B2,通過密碼子優化方式將其轉換為核酸序列;合成抗GPC3/CD3 BiTE序列,其氨基酸序列參考GC33和OKT3序列,C端加入6×His。二者序列分別以AgeⅠ、ApaⅠ和AgeⅠ、BamHⅠ插入pCMV-IgG4載體中。
1.4 抗體表達純化 將重組質粒以PEI轉染法導入HEK-293F細胞中,6~7 d后收集培養上清。BiHcAb通過Protein A柱進行純化,BiTE通過鎳柱進行純化。
1.5 流式細胞術 收集細胞,將檢測抗體用5%的BSA稀釋到10 μg/mL,冰上孵育1 h,清洗2遍后,BiHcAb用Alexa Fluor 488標記的Anti-human IgG抗體,BiTE用Alexa Fluor 488標記的Anti-His Tag抗體,避光孵育45 min,再清洗2遍,上機檢測。
1.6 細胞殺傷實驗 以1×105個/孔的靶細胞與PBMC以1∶20的比例共培養并加入10 μg/mL抗體為實驗組,并設置效應空白組、靶細胞空白組以及陽性對照組,培養72 h后用CytoTox-Glo Cytotoicity Assay進行檢測。
1.7 ELISA檢測 采用森雄公司的IFN-γ、TNF-α、IL-2、IL-6的ELISA檢測試劑盒,按說明書檢測上述共培養體系中細胞培養上清中各細胞因子濃度。
1.8 裸鼠體內肝癌細胞異體移植模型 每組4周齡雄性裸鼠5只,共5組,分別在其背部接種1×107個Hep3B細胞和1×108個PBMC。注射后0.5 h,尾靜脈注射含有相應濃度的BiHcAb和BiTE抗體150 μL,以生理鹽水為陰性對照,連續5 d通過尾靜脈注射抗體。觀察21 d后處死小鼠,期間測量腫瘤直徑大小,并計算腫瘤體積=(長×寬2)/2。
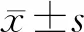
2 結 果
2.1 抗GPC3/CD3雙特異性重鏈抗體的構建與表達 將全基因合成的抗GPC3和抗CD3的單域抗體VHH序列以AgeⅠ和ApaⅠ酶切位點克隆至含IgG4 Fc段(包括野生型、Knob或Hole突變體)的表達載體pCMV-IgG4中,雙酶切篩選獲得正確克隆(圖1A)。同時將抗GPC3/CD3 BiTE序列以AgeⅠ和BamHⅠ酶切位點克隆至表達載體pCMV中。轉染HEK-293F細胞,搖瓶中懸浮培養進行表達。純化濃縮后,進行蛋白電泳和考馬斯亮藍染色。結果顯示:抗GPC3 HcAb、抗CD3 HcAb、抗GPC3/CD3 BiHcAb的相對分子質量約100 000,還原狀態下相對分子質量約40 000;抗GPC3/CD3 BiTE的相對分子質量約為50 000(圖1B),提示成功構建了4種抗體。

圖1 重鏈抗體和BiTE真核表達載體的構建和蛋白表達檢測
2.2 重鏈抗體與細胞表面相關抗原的結合能力 流式細胞術檢測結果(圖2)發現:抗GPC3重鏈抗體能夠與內源性表達GPC3的Hep3B細胞和過表達GPC3的A431-GW細胞相結合,而不能與不表達GPC3的SK-Hep-1和A431細胞結合;抗CD3重鏈抗體能夠與PBMC結合,而與不表達CD3的Raji細胞不結合。結果提示前期構建的重鏈抗體具有與細胞表面相應抗原的結合能力。

圖2 流式細胞術檢測重鏈抗體與細胞表面蛋白的結合
2.3 雙特異性重鏈抗體與細胞表面相關抗原的結合能力 結果(圖3)發現,抗GPC3/CD3 BiHcAb既能與內源性表達GPC3的Hep3B細胞和過表達GPC3的A431-GW細胞相結合,也能與PBMC結合,而與不表達GPC3的SK-Hep-1和A431細胞不結合,也與不表達CD3的Raji細胞不結合(圖3A);而抗GPC3/CD3 BiTE也具有相似的結合能力(圖3B)。結果表明構建的BiHcAb和BiTE都具有與細胞表面相應抗原的結合作用。

圖3 流式細胞術檢測雙特異性抗體與細胞表面蛋白的結合
2.4 雙特異性重鏈抗體介導的細胞殺傷作用 將靶細胞、PBMC和抗GPC3/CD3 BiHcAb(抗GPC3/CD3 BiTE、抗GPC3 HcAb或抗CD3 HcAb)共孵育72 h,細胞毒性檢測結果(圖4)發現:BiHcAb在表達GPC3的A431-GW和Hep3B細胞中的殺傷率分別是(43.1±9.0)%和(55.5±7.6)%,顯著高于BiTE組的殺傷率(5.3±10.1)%和(11.0±2.8)%,差異有統計學意義(P<0.01);也顯著高于BiHcAb在不表達GPC3的A431和SK-Hep-1細胞的殺傷率(11.1±7.6)%和(12.6±1.3)%,差異有統計學意義(P<0.01)。

圖4 雙特異性抗體介導的細胞殺傷效應
2.5 雙特異性重鏈抗體介導的細胞因子釋放 結果(圖5)表明:BiHcAb在表達GPC3的A431-GW細胞上清中誘導IFN-γ、TNF-α、IL-2和IL-6的表達量分別為(936.3±20.9)、(1 178.2±35.8)、(854.1±81.0)和(818.8±25.2) pg/mL,顯著高于BiTE組,分別為(542.1±74.0)、(294.5±28.1)、(460.3±36.0)和(620.0±12.1) pg/mL,差異有統計學意義(P<0.01)。 同樣在內源性表達GPC3的Hep3B細胞中,BiHcAb誘導IFN-γ、TNFα、IL-2和IL-6的表達量分別為(840.3±50.3)、(956.5±49.0)、(870.0±53.0)和(951.3±136.4) pg/mL,顯著高于BiTE組,分別為(386.2±27.1)、(362.0±22.7)、(542.5±33.7)和(505.1±26.1) pg/mL,差異有統計學意義(P<0.01)。

圖5 雙特異性抗體介導的細胞因子釋放
2.6 雙特異性重鏈抗體體內抑制裸鼠肝癌細胞的生長 裸鼠種植實驗結果(圖6)表明:與NS組相比,高低濃度BiHcAb組均能顯著抑制肝癌細胞在裸鼠體內的生長(P<0.01),且也顯著優于BiTE組(P<0.05)。與NS組相比,BiTE高濃度組可抑制肝癌生長(P<0.05),但低濃度組作用不顯著。當第21天時,各組裸鼠未出現惡液質表現,但因腫瘤體積大于1 000 mm3,實驗終止,處死裸鼠,稱量體質量,NS組、2 μg BiHcAb組、20 μg BiHcAb組、1 μg BiTE組和10 μg BiTE組的體質量分別為(25.8±1.5)、(25.4±1.8)、(25.7±3.0)、(26.2±2.2)和(26.5±1.9) g。分離腫瘤組織,觀察發現GPC3/CD3 BiHcAb組裸鼠腫瘤平均直徑小于其他組別,提示BiHcAb具有良好的抗腫瘤活性。

圖6 雙特異性抗體體內抑制裸鼠肝癌細胞生長
3 討 論
GPC3作為一種肝癌細胞表面特異性表達的糖蛋白,被認為是肝癌靶向治療的重要標志物,成為近年來肝癌診治研究的熱點。研究表明GPC3特異性抗體在肝癌的治療和診斷中具有重要的作用;同時靶向GPC3的免疫細胞治療如CAR-T細胞治療也已進入了臨床試驗階段。
然而目前CAR-T治療還處于發展階段,部分關鍵問題如細胞因子釋放綜合征、通用型CAR-T的制備及其在實體瘤的治療等方面都還未得到很好的解決,而且個體化療法所帶來的高昂治療費用是一般家庭難以承受的。
靶向人CD3/腫瘤相關抗原(TAA)的BiTE可作為抗腫瘤治療的重要手段。BiTE作用的發揮必須同時與T細胞表面的CD3和腫瘤細胞上的TAA相結合,然后激活T細胞,誘導細胞毒活性,釋放眾多細胞因子,從而發揮其抗腫瘤效應[13]。BiTE具有相對分子質量小、易穿透腫瘤組織、免疫原性低等優點[14],但其缺乏Fc段,易在體內被快速消除,血液半衰期較短,僅為1.25 h左右,因此需要持續推注或者一天內多次輸注以維持血藥濃度[15]。目前僅有一種靶向CD19/CD3的BiTE博納吐單抗(Blinatumomab),被美國FDA批準用于治療急性淋巴細胞性白血病。
20世紀90年代初,Hamers-Casterman等[16]偶然從駱駝中發現了一種缺乏輕鏈、僅有重鏈的抗體,稱為重鏈抗體(Heavy chain antibodies,HcAbs),其單個重鏈可變區(VHH)即具有與抗原的結合能力,又被稱為納米抗體(Nanobody)。不同于VH中包含一個面向VL的疏水面,VHH是完全親水的結構,其穩定性和溶解度優于VH。VHH的CDR3區通常比常規抗體VH的CDR3長,可形成指狀延伸,以觸及常規抗體無法到達的抗原表位;同時長的CDR3可增大與抗原的相互作用面,部分補償了VL缺失帶來的影響[17]。
本研究通過構建抗GPC3/CD3 BiHcAb,發揮其類似BiTE的功能,以分別結合T細胞和肝癌細胞,隨之激活T細胞發揮殺傷肝癌細胞的作用。同時重鏈抗體比完整抗體小、易于滲透,且因含Fc段,比BiTE的穩定性高,純化更為方便。研究結果表明BiHcAb在體外實驗中針對GPC3陽性細胞的殺傷率約為50%,遠高于BiTE的殺傷(約10%)。同時BiHcAb誘導釋放的IFN-γ、TNF-α、IL-2、IL-6等細胞因子的水平也高于BiTE組。這一方面由于BiHcAb帶有Fc段,其穩定性優于BiTE;另一方面由于與CD3和TAA抗原表位結合的VHH結構域比BiTE中的scFv部分更小,可能使腫瘤細胞與T細胞在空間上更為靠近,導致能夠更好地持續性激活T細胞,釋放更多的細胞因子,最終發揮更好的腫瘤細胞殺傷活性。在裸鼠體內移植瘤模型中,本研究進一步觀察了不同濃度抗GPC3/CD3 BiHcAb和抗GPC3/CD3 BiTE對肝癌生長的抑制效果,發現高低濃度BiHcAb組均具有較明顯的腫瘤抑制效果,而低濃度BiTE組抑制效果不明顯。結合體內外的實驗,本研究初步證實BiHcAb較之BiTE具有更好的抗腫瘤活性。然而本研究僅初步評價了抗GPC3/CD3 BiHcAb的體內外抗肝癌作用,以驗證本BiHcAb模型在腫瘤治療中的有效性。下一步還將深入探討該抗體的作用和具體機制,為將來的臨床應用提供依據。

