UPLC-MS/MS法測定人血漿和腦脊液中利奈唑胺的濃度
范理菊,吳 茵,董占軍1,
(1.河北醫科大學研究生學院,石家莊 050017;2.河北省人民醫院藥學部,石家莊 050051)
醫院獲得性顱內感染是顱腦術后最嚴重的并發癥之一,發生率為2.6%,病死率高達21%[1]。G+菌是顱內感染的主要病原菌[2]。利奈唑胺的組織穿透力強,口服生物利用度高,對中樞神經系統G+菌感染有很好的療效[3],是治療神經外科術后醫院獲得性顱內感染的常用藥物。研究發現,利奈唑胺在無腦膜感染人群中的腦脊液藥-時曲線下面積與血漿藥-時曲線下面積的比值約為0.7[4],具有良好的中樞神經系統滲透性,但個體間藥動學參數差異較大。并且當患者的病理、生理狀態變化時,其藥動學參數也會隨之改變[5-6]。因此,在治療患有中樞神經系統感染的重癥患者時,有必要對其進行治療藥物監測,以優化個體化給藥方案[7]。國外已有利奈唑胺在腦膜感染患者中的藥動學研究,并推薦了使用劑量[8-9],但利奈唑胺在國內神經外科術后顱內感染患者的腦脊液及血漿中藥動學研究資料非常有限[10]。本研究建立了UPLC-MS/MS法測定血漿及腦脊液中利奈唑胺的濃度,從而探究利奈唑胺血漿濃度與腦脊液濃度的相關性,從而為利奈唑胺在術后顱內感染患者的藥動學研究提供方法學基礎。國外已有兩種基質中利奈唑胺濃度測定的報道[11-12],目前國內報道的有兩項研究[13-14],均采用HPLC法,其特異性和靈敏度不及LC-MS/MS法。考慮到同位素稀釋質譜是國際公認的一級測量原理[15],因此本研究建立同位素稀釋的UPLC-MS/MS法測定人血漿和腦脊液中利奈唑胺濃度,可以在3 min內完成血漿和腦脊液中利奈唑胺濃度測定,簡便、高效、經濟,適用于臨床測定危重癥患者血漿和腦脊液中利奈唑胺的濃度。
1 材 料
1.1 儀器 LC-30A 型超高效液相色譜儀,配有 CTO30A 型柱溫箱、SIL30AC 型自動進樣器、LC-30AD二元高壓梯度泵(日本 Shimadzu 公司);AB Sciex 5500型串聯四級桿質譜儀,配有電噴霧離子源、三重四級桿質量分析器;Analyst 1.6.1數據采集軟件(美國AB公司)。
1.2 藥品和試劑 利奈唑胺對照品(批號1029-084A1)、利奈唑胺-d3對照品(批號1219-006A2)由美國TLC公司提供;人工腦脊液(批號0316A20,北京雷根生物技術有限公司);二甲亞砜(DMSO)、乙腈、甲酸為色譜純,其余試劑均為分析純,水為純凈水(杭州娃哈哈集團有限公司)。
2 方法和結果
2.1 色譜條件 色譜柱:Waters XBridge BEH C18色譜柱(100 mm×2.1 mm,2.5 μm),柱溫:40 ℃;流動相:0.1%甲酸水溶液(A相)-乙腈(B相),梯度洗脫(0~1.0 min,80%~35%A,1.0~2.1 min,35%~80%A);流速:0.5 ml/min;進樣量:3 μl。
2.2 質譜條件 正離子監測模式;離子源溫度600 ℃;源噴射電壓5500 V;霧化氣和加熱氣壓力均為55 psi(1 psi=6.894 76 kPa);氣簾氣35 psi;多反應監測(MRM)模式;利奈唑胺監測離子對為m/z338.1→295.9,去簇電壓(DP)110 eV,碰撞電壓(CE)32 eV;利奈唑胺-d3的監測離子對為m/z341.3→297.2,DP 110 eV,CE 30 eV。利奈唑胺和內標的質譜圖見圖1。
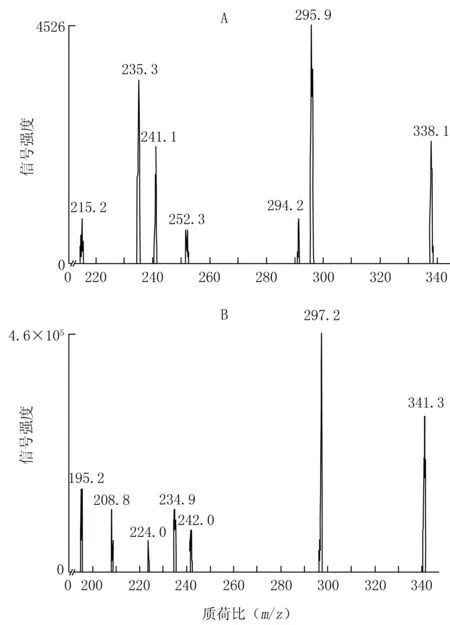
圖1 利奈唑胺和內標的質譜圖Figure 1 Mass spectrograms of linezolid and internal standardA:利奈唑胺;B:內標利奈唑胺-d3
2.3 溶液的配制 (1)標準曲線工作液:精密稱取利奈唑胺對照品適量,加DMSO溶解,配成質量濃度為1.00 mg/ml的對照品儲備液。取對照品儲備液適量,用乙腈-水(2∶8)稀釋,配制成質量濃度分別為2、4、10、20、50、100、150、200 μg/ml的系列對照品溶液,作為標準曲線工作液。(2)質控工作液:另取對照品儲備液,用乙腈-水(2∶8)稀釋,配制成質量濃度分別為5、40、160、400 μg/ml的質控工作液。上述溶液置于4 ℃冰箱保存備用。(3)內標溶液:精密稱取利奈唑胺-d3適量,用DMSO溶解,配制成質量濃度為1.00 mg/ml的內標儲備液。取內標儲備液適量,用乙腈稀釋,配制成質量濃度為0.2 μg/ml的內標溶液,置4 ℃冰箱冷藏保存。
2.4 樣品預處理
2.4.1 血漿樣品預處理 取血漿樣品40 μl,加入內標溶液200 μl,沉淀蛋白質,渦旋5 min后,以相對離心力1.372 6×104×g高速離心8 min,取上清液20 μl,加入乙腈-水(2∶8)380 μl,混勻,備測。
2.4.2 腦脊液樣品預處理 取腦脊液樣品40 μl,加入內標溶液200 μl,沉淀蛋白質,渦旋5 min,以相對離心力1.372 6×104×g離心8 min,取上清液20 μl,加乙腈-水(2∶8)380 μl,混勻,備測。
2.5 專屬性 取空白血漿樣品及定量下限的血漿樣品各6份,按2.4項下方法處理并進樣分析。腦脊液樣品參照血漿樣品。結果顯示,利奈唑胺和內標出峰位置背景干凈,無雜峰干擾。血漿樣品中利奈唑胺和內標的保留時間分別為1.18和1.17 min;腦脊液樣品中利奈唑胺和內標的保留時間分別為2.25和2.24 min。見圖2。
2.6 標準曲線的制備
2.6.1 血漿樣品的標準曲線 取空白血漿380 μl,精密加入系列濃度的標準曲線工作液各20 μl,渦旋混勻,配制成質量濃度分別為0.1、0.2、0.5、1.0、2.5、5.0、7.5、10.0 μg/ml的標準曲線用血漿樣品。取空白血漿380 μl,精密加入系列濃度的質控工作液,配制成質量濃度分別為0.25、2、4、8 μg/ml的質控血漿樣品。按2.4.1項下方法處理并進樣分析。以血漿中待測物的質量濃度(x)為橫坐標,待測物與內標的峰面積比值(y)為縱坐標,采用加權最小二乘法進行線性回歸,得到標準曲線方程為y=0.531x+0.006 35(r=0.999 4)。結果表明,利奈唑胺血藥濃度檢測的線性范圍為0.1~10.0 μg/ml,定量下限為0.1 μg/ml。
2.6.2 腦脊液樣品的標準曲線 取人工腦脊液380 μl,精密加入系列濃度的標準曲線工作液20 μl,渦旋混勻,配制成質量濃度分別為0.1、0.2、0.5、1.0、2.5、5.0、7.5、10.0 μg/ml的標準曲線用腦脊液樣品。取人工腦脊液380 μl,精密加入系列濃度的質控工作液,制成質量濃度分別為0.25、2、4、8 μg/ml的質控腦脊液樣品。按2.4.2項下方法處理并進樣分析,以腦脊液中待測物的質量濃度(x)為橫坐標,待測物與內標的峰面積比值(y)為縱坐標,采用加權最小二乘法進行線性回歸,得到標準曲線方程為y=0.479x-0.002 65(r=0.999 8)。利奈唑胺腦脊液濃度檢測的線性范圍為0.1~10.0 μg/ml,定量下限為0.1 μg/ml。
2.7 穩定性試驗 取利奈唑胺低、高質量濃度(0.25、8 μg/ml)質控血漿樣品各6份,按2.4.1項下方法處理并進樣分析,分別考察其凍融3次、冷凍7 d及室溫放置6 h的穩定性。腦脊液樣品的穩定性考察方法同血漿樣品操作,結果見表1。結果顯示,各樣品RSD均<10%,提示該方法穩定性良好。
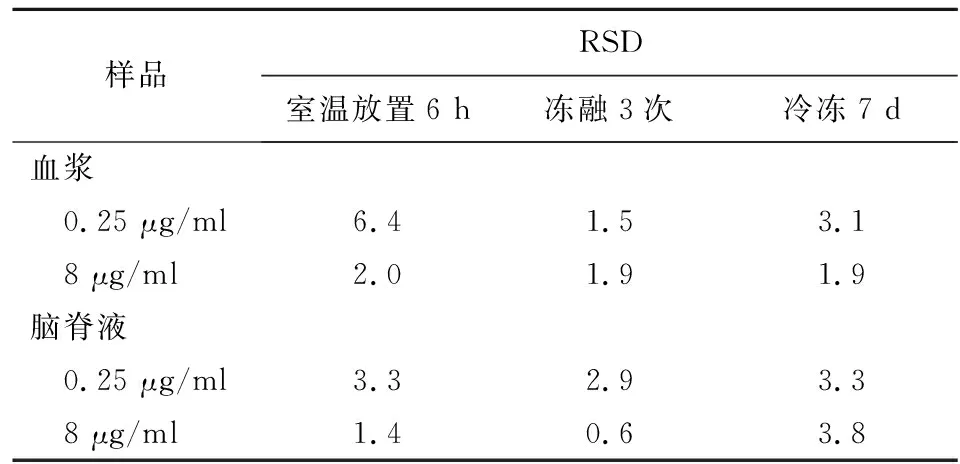
表1 血漿和腦脊液樣品的穩定性試驗結果Table 1 Results of stability test of plasma and cerebrospinal fluid samples (n=6,%)
2.8 準確度試驗和精密度試驗 取利奈唑胺定量下限、低、中、高質量濃度的質控血漿樣品各5份,按2.4.1項下方法處理,進樣檢測,考察日內精密度;連續測定3 d,考察日間精密度。腦脊液樣品的精密度和準確度測定方法同血漿樣品操作。結果顯示,各質控樣品的日內、日間RSD均<10%,見表2。
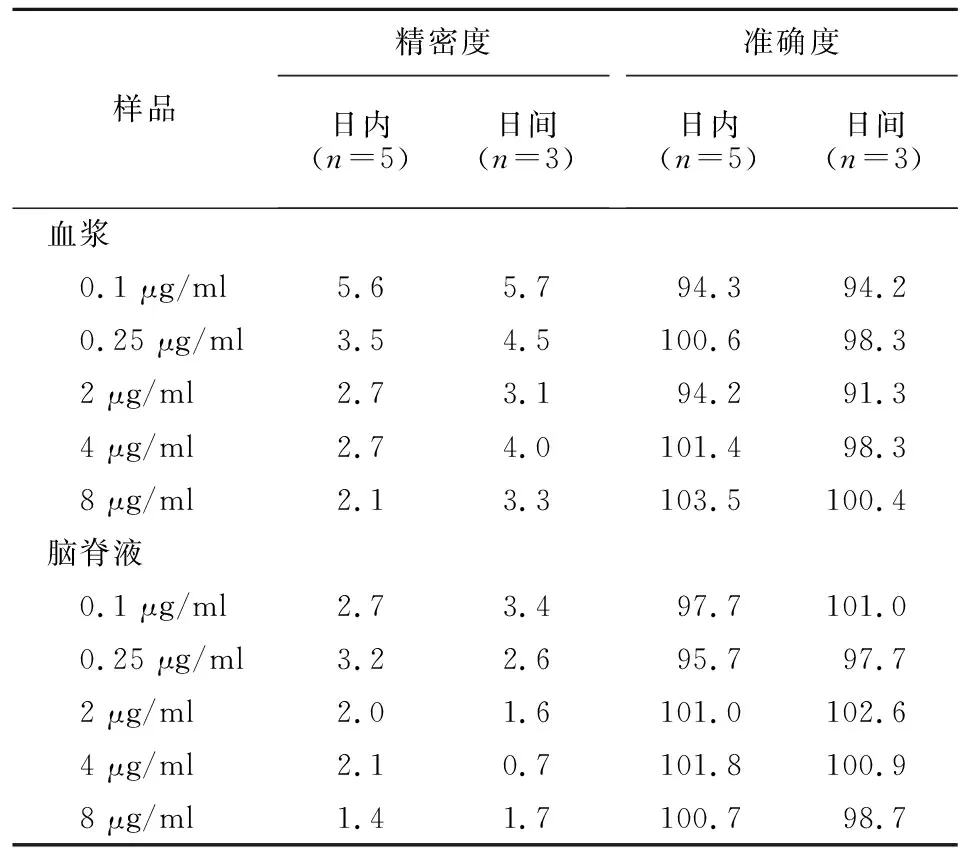
表2 血漿和腦脊液中利奈唑胺的精密度和準確度試驗結果Table 2 Results of precision and accuracy tests of linezolid in plasma and cerebrospinal fluid samples (%)
2.9 提取回收率和基質效應 平行制備低、高質量濃度的質控血漿樣品各6 份,按照2.4.1項下方法處理后進樣分析,記錄峰面積為 C。空白血漿按照2.4.1項下方法提取后,添加低、高質量濃度的血漿樣品,每個質量濃度平行制備 6 份,進行色譜分析,記錄峰面積為 B。同濃度的質控工作溶液,不經處理直接進樣,記錄峰面積為 A。提取回收率=(C/B)×100%,基質效應=(B/A)×100%。腦脊液樣品的基質效應和提取回收率測定同血漿樣品,結果見表3。
表3 血漿和腦脊液中利奈唑胺的基質效應和提取回收率Table 3 Matrix effects and extraction recoveries of linezolid in plasma and cerebrospinal fluid
2.10 稀釋可靠性 將血漿樣品用空白血漿稀釋10倍,平行制備6份,按2.4.1項下方法處理并進樣分析。腦脊液樣品的稀釋可靠性操作同血漿樣品,精密度和準確度結果見表2。結果顯示,樣品稀釋10倍對濃度測定無顯著影響。
3 討 論
利奈唑胺脂溶性高、分子質量小、血腦屏障穿透性好,現已廣泛用于治療G+菌所致的中樞神經系統感染[16]。郭明星等報道了用LC-MS/MS法測定利奈唑胺血漿藥物濃度,但采用的是非同位素內標[17-18]。本研究采用利奈唑胺-d3同位素內標,色譜分析條件下,利奈唑胺和內標有相近的色譜保留時間,被分析物的出峰時間不受時間限制,同時利奈唑胺與內標具有相似的離子化效率和提取回收率[19],最大程度地降低了基質效應,提高了利奈唑胺濃度測定的準確度。
本研究采用梯度洗脫方式,以甲酸水溶液(含0.1%甲酸,V/V)為流動相A相,乙腈為流動相B相。在流動相中加入0.1%甲酸提高了利奈唑胺的離子化效率和檢測靈敏度。血漿樣品中組分復雜,采用梯度洗脫的方式,可以使復雜樣品中性質差異較大的組分易于分離,縮短分析時間。預實驗還比較了不同比例的乙腈-水溶液(2∶8和3∶7)對實驗的影響。結果發現,用2∶8的乙腈-水溶液作為溶劑,在準確度、精密度、基質效應等方面更符合實驗要求。常用的生物樣本預處理方法有固相萃取法、液液萃取法和蛋白沉淀法。固相萃取法時間短,效率高,但成本高。液液萃取法操作繁瑣、費時,不適用于醫院常規樣品的批量測定。本研究采用乙腈為沉淀劑的前處理方法,操作簡便、成本低廉、提取回收率高,適用于醫院的治療藥物監測。本研究還將內標溶解于沉淀劑中,一是減少了因內標加樣量少引起的人為誤差,二是簡化了樣本預處理步驟,縮短了預處理時間,為臨床危重癥患者的藥物治療爭取了時間。
綜上所述,本研究建立的UPLC-MS/MS同位素稀釋法可以滿足臨床患者血漿和腦脊液中利奈唑胺的濃度測定,值得推廣應用。

