利用CRISPR∕Cas9技術編輯水稻丙酮酸磷酸雙激酶基因PPDK
孫 佳,吳清清,周文昊,林冬枝,宋忠明,董彥君*
(1上海師范大學生命科學學院,上海市植物分子科學重點實驗室,上海200234;2上海市種子管理總站,上海201103)
據報道,全世界一半以上的人口依賴稻米中的淀粉類碳水化合物和營養物質維持生命活動[1-4]。稻谷中胚乳質量約占總質量的90%,胚乳細胞的發育直接影響水稻的產量和品質。胚乳性狀與稻米外觀品質、碾磨加工品質和蒸煮食味品質密切相關。因此,研究稻谷中淀粉合成相關基因的功能對實現水稻的高產、優質以及創制水稻育種材料具有重要的意義[5]。
在植物中,丙酮酸磷酸雙激酶(PPDK)催化丙酮酸、腺苷三磷酸(ATP)和磷酸(Pi)與磷酸烯醇式丙酮酸(PEP)、腺苷一磷酸(AMP)和焦磷酸(PPi)相互轉化。PPDK大量存在于C4植物的葉綠體基質中,在C3植物中的表達量相對較低,主要存在于C3植物的未成熟種子、葉片、胚芽鞘和根中[6]。PPDK是C4植物光合作用的關鍵酶,催化CO2固定于PEP受體[7]。PPDK在C3植物種子中調節淀粉合成和氨基酸代謝,稱為胞質型PPDK。在淀粉合成的過程中,胞質型PPDK可能起到以下作用:丙酮酸是由丙酮酸激酶(PK)催化PEP生成的,是一個不可逆反應,需要PPDK來進行逆反應,而淀粉的生物合成途徑可能由PK和PPDK循環產生的信號控制[8]。PK和PPDK之間的循環能夠增加細胞質溶膠中PPi的濃度[6]。研究表明,PPi能夠誘導蔗糖合酶依賴性的途徑。這對淀粉生物合成的早期過程是非常重要的,PPi在PPDK活性下降之后觸發該途徑,隨后淀粉的生物合成在發育的宿主器官中發生[8-10]。
與其他的基因編輯技術相比,CRISPR∕Cas9基因編輯系統具有效率高、操作簡單等優勢[11],目前該技術在水稻基因編輯中得到一定應用。如邵高能等[12]利用CRISPR∕Cas9技術編輯‘中花11’香味基因Badh2,突變體籽粒中香味物質2-乙酰-1吡咯啉含量顯著增加;Shan等[13]定點突變葉綠素合成基因CAO1,突變體葉片呈淡綠色;胡雪嬌等[14]對赤霉素20-氧化酶基因SD1進行了定向編輯,獲得半矮稈水稻品種;本實驗室也成功對谷蛋白基因GluA3進行編輯,獲得了谷蛋白含量下降的突變體[15]。目前,尚未見對水稻丙酮酸磷酸雙激酶基因(P PDK)進行編輯及其對淀粉合成影響的研究。本試驗利用CRISPR∕Cas9技術對粳稻品種‘嘉花1號’的PP DK基因進行編輯,以期探究其在水稻淀粉合成中的功能。
1 材料與方法
1.1 材料
遺傳轉化水稻材料選擇浙江省嘉興市農業科學院選育的高產優質粳稻品種‘嘉花1號’,種植在上海師范大學植物園的封閉試驗基地水田中,采用常規水肥栽培管理。
1.2 CRISPR∕Cas9表達載體的構建和遺傳轉化
本試驗使用的CRISPR∕Cas9載體由華南農業大學劉耀光院士提供[16]。利用CRISPR Primer Designer軟件對丙酮酸磷酸雙激酶基因PPDK(LOC_Os05g33570)的第6外顯子設計序列為5’-GCCAGCTGCAGTTGCTTCT-3’的19 bp長度靶點。表達載體構建參照曾棟昌等[17]的方法,遺傳轉化與組織培養參照周優等[15]的方法,獲得水稻T0代苗。
1.3 q-PCR分析
提取編輯突變植株及野生型(WT)‘嘉花1號’開花15 d未成熟的胚乳組織的總RNA,并以之為模板反轉錄得到cDNA(提取RNA試劑盒為北京全式金生物技術有限公司TransZolTMPlant,反轉錄cDNA試劑盒為該公司TransScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix)。采用q-PCR方法對水稻淀粉合成相關的8個基因(表1)進行RNA水平的表達量分析。

表1 轉錄水平分析所用引物Table 1 Primers used for transcription level analysis
1.4 淀粉粒掃描電子顯微鏡觀察
選取編輯突變植株與‘嘉花1號’的成熟種子,干燥后用小刀在其橫截面上平切使其斷裂,取斷裂后的半粒米作為觀察材料,橫切面向上,噴金之后用Hitachi SU8010高分辨掃描電子顯微鏡進行觀察。
1.5 淀粉含量測定
收獲的水稻種子干燥后,脫殼保存。首先選取質量接近的糙米粒放置在10個2 mL的EP管中(每管1粒),加入200μL蒸餾水后在高壓鍋中121℃蒸煮30 min;然后加入1個鋼珠和800μL蒸餾水,進行粉碎;再將液體移至試管中定容至10 mL,加入10μL 0.02%(質量分數)的I-KI溶液,觀察溶液顏色變化并拍照記錄。選取糙米進行均勻粉碎,過100目(孔徑150μm)篩,每個樣本稱取20 mg米粉,放入10 mL試管中,然后按照Megazyme公司(愛爾蘭)的直鏈淀粉測定試劑盒和抗性淀粉測定試劑盒的操作程序,測定直鏈淀粉、抗性淀粉以及總淀粉含量。
1.6 糊化特性觀察
選取4粒完整精米均勻放置于加有1.4%(質量分數)KOH溶液的培養皿(直徑90 mm)中,加蓋后靜置在(30±2)℃的恒溫箱內,23 h后觀察米粒的糊化狀態并拍照。同時,稱取20 mg精米粉于1.5 mL的EP管中,加入0.5 mL 4 mol∕L的尿素溶液,觀察米粉在尿素中的溶解度。
1.7 米粒外觀與農藝性狀調查
在本實驗室封閉試驗基地培育野生型‘嘉花1號’與編輯得到的T2代突變體植株,成熟后對‘嘉花1號’以及純合編輯突變植株的株高、單株穗數、結實率、粒長、粒寬以及千粒重等農藝性狀進行考察,并觀察稻米外觀。
2 結果與分析
2.1 CRISPR∕Cas9表達載體的構建與轉基因水稻獲得
采用邊切邊連和兩輪巢式PCR的方法構建和擴增得到gRNA表達盒,將gRNA表達盒連接到MH質粒中再次構建重組載體(圖1),并轉入大腸桿菌(DH10B),擴大培養提取質粒,用特異引物B1∕BL(表2)擴增并測序。將測序正確的重組質粒轉入根瘤農桿菌(EHA105)中,擴大培養,PCR擴增產物測序驗證;侵染水稻‘嘉花1號’愈傷組織,獲得組培植株后,利用載體特異引物HPT-F∕R(表2)擴增檢測,共獲得9株潮霉素陽性苗,其中有6株純合和3株雜合的編輯突變植株。純合突變類型均為PPDK基因第6外顯子上的NGG前第4個堿基A缺失(圖2)。通過與野生型‘嘉花1號’蛋白序列比對,發現翻譯提前終止,突變體蛋白結構預測如圖3所示。收取T0代轉基因苗的種子,T1代分離出無轉基因載體的純合突變體,命名為ppdk3。
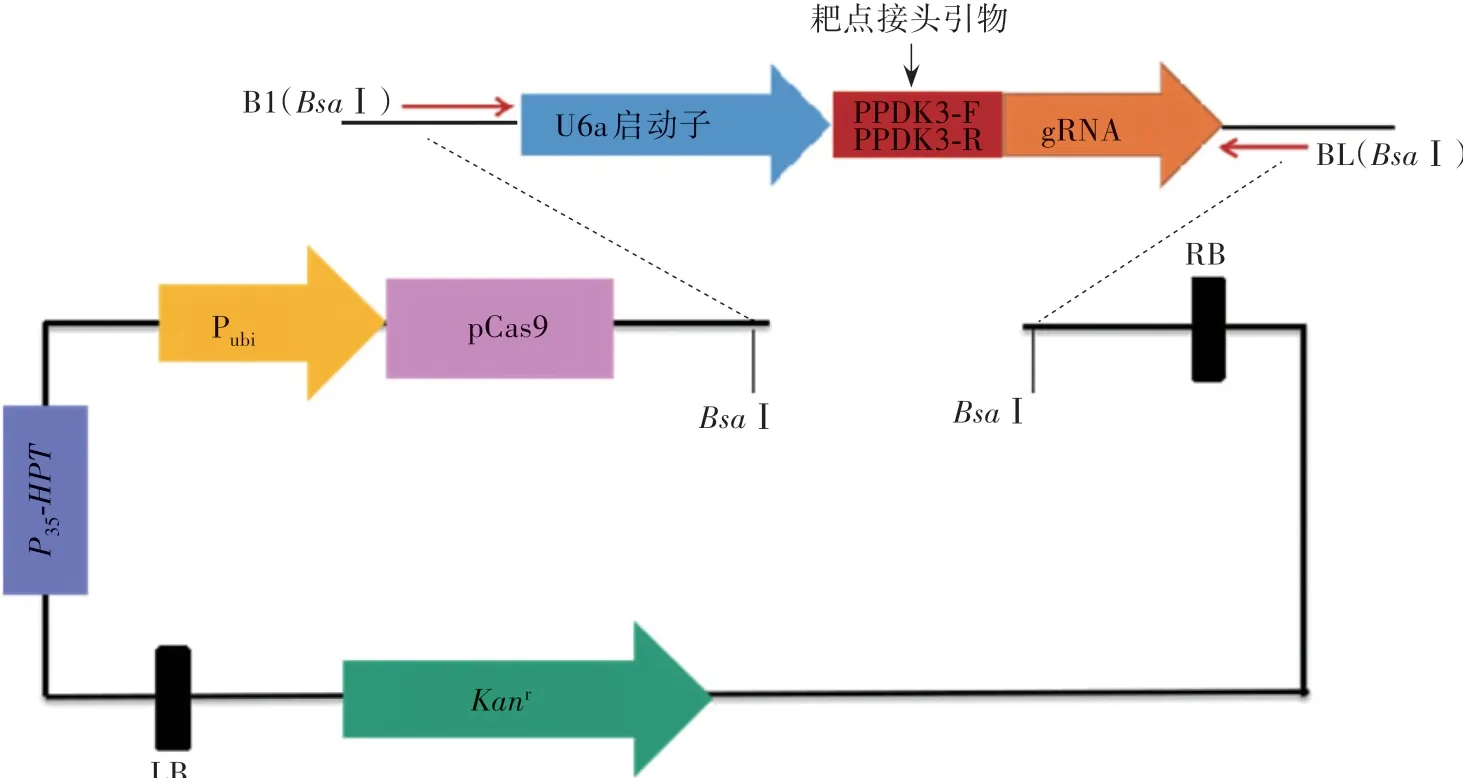
圖1 gRNA表達盒連接MH質粒示意圖Fig.1 Schematic diagram of gRNA expression box connecting MH plasmid

表2 PPDK基因靶點引物和特異引物Table 2 P PDK gene target primers and specific primers
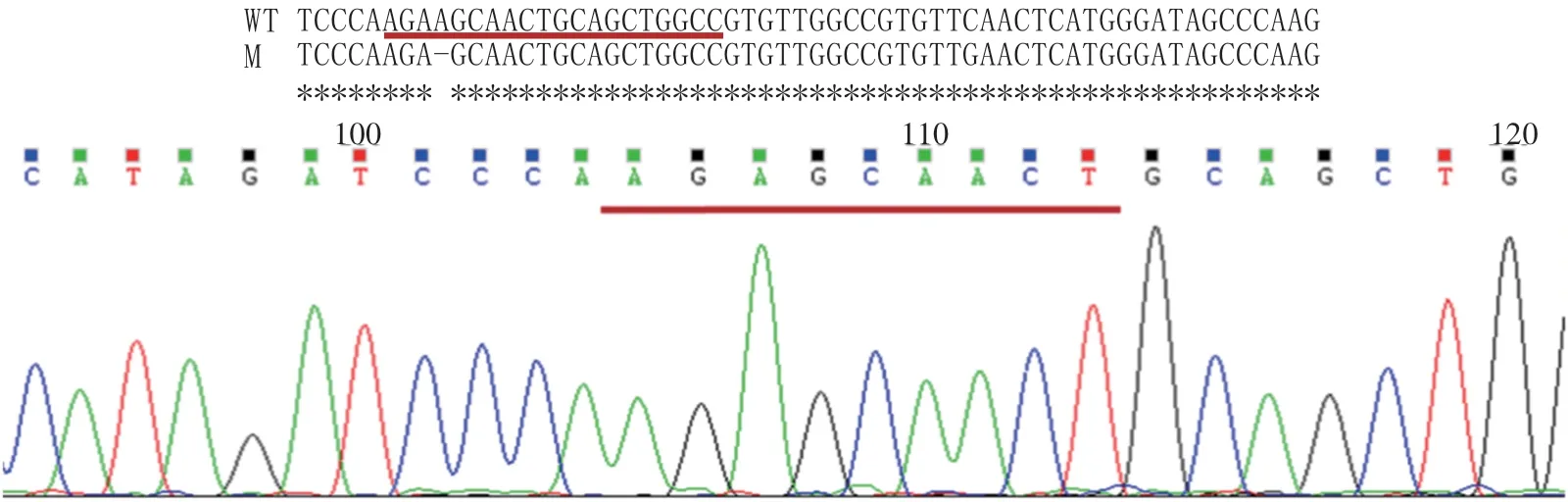
圖2 野生型(WT)和ppdk3突變體(M)測序結果對比以及DNA測序峰圖Fig.2 Comparison of wide type(WT)and ppdk3 mutant(M)sequencing results and DNA sequencing peak diagram
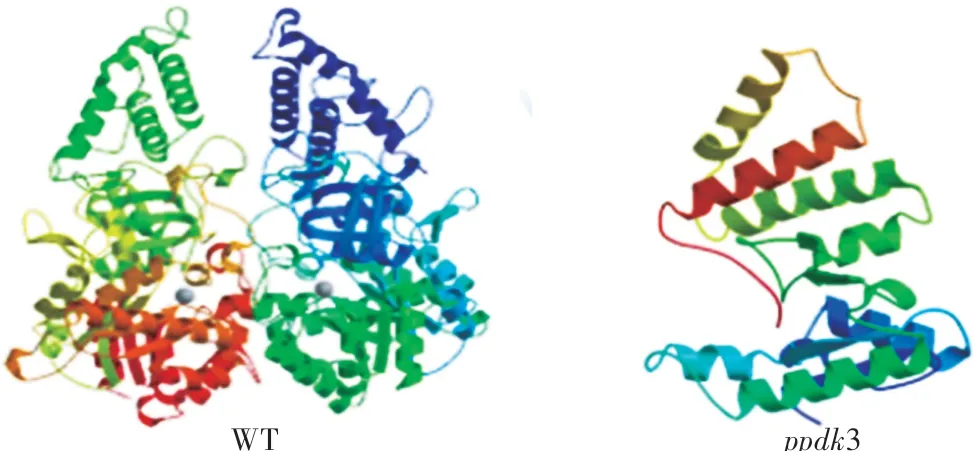
圖3 野生型(WT)和ppdk3突變體蛋白結構預測Fig.3 Protein structure prediction of wide type(WT)and ppdk3 mutant
2.2 突變體中淀粉合成相關基因RNA表達水平分析
對ppdk3突變體中淀粉合成相關的8個基因(表1)RNA轉錄水平情況進行分析表明:與野生型‘嘉花1號’相比,突變體的8個淀粉合成相關基因mRNA表達量均有明顯下調,尤其是顆粒結合型淀粉合酶基因(G BSSⅠ和GBSSⅡ)及可溶性淀粉合成酶基因中的SSⅢa、SSⅡa、SSⅣ-2的表達量下調到原來的1∕10—1∕5(圖4)。可見,PPDK基因的突變不僅影響自身的轉錄表達水平,還抑制其他淀粉合成相關基因RNA的表達。

圖4 野生型(WT)和ppdk3突變體淀粉合成相關基因的轉錄水平表達Fig.4 Transcription levels of starch synthesis related genes in wide type(WT)and ppdk3 mutant
2.3 淀粉顆粒顯微結構
用掃描電子顯微鏡觀察野生型‘嘉花1號’以及ppdk3突變體的米粒橫切面發現:野生型胚乳淀粉顆粒表面光滑,排列緊密,形狀規則有棱角;而ppdk3突變體胚乳淀粉顆粒排列松散,顆粒明顯變小,淀粉顆粒呈球形和不規則形(圖5)。可見,P PDK基因突變可導致胚乳淀粉顆粒形狀和排列發生很大變化。
2.4 稻米淀粉特征分析
將ppdk3突變體糙米蒸熟后打碎并加水稀釋,加入I-KI溶液,通過溶液顏色變化觀察其米粒中淀粉含量的變化。結果顯示:ppdk3突變體I-KI染色溶液顏色明顯淺于‘嘉花1號’(圖6A),說明其直鏈淀粉含量降低。同時,分別測定其稻米直鏈淀粉和抗性淀粉含量發現:‘嘉花1號’的直鏈淀粉含量為24.4%,而ppdk3突變體為18.8%,與I-KI染色染色結果相符合;另外,ppdk3突變體稻米的抗性淀粉含量(0.039%)比‘嘉花1號’(0.025%)略有上升。
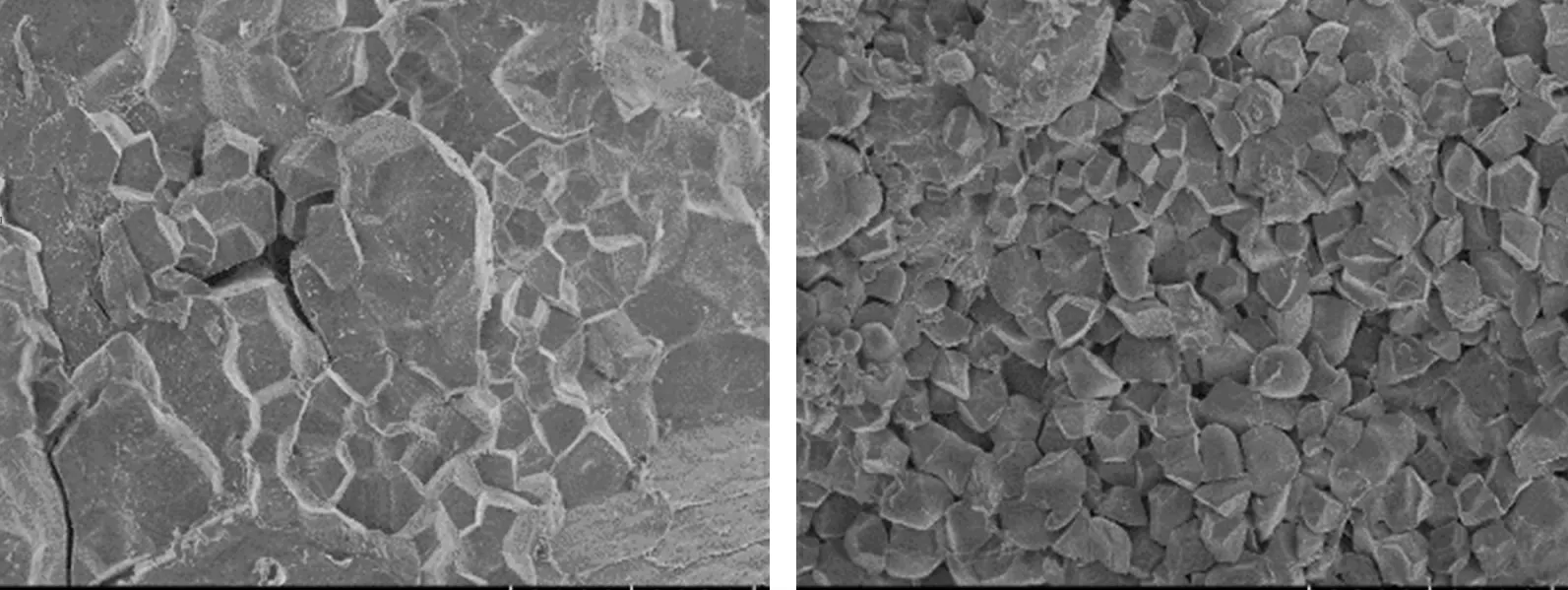
圖5 野生型(WT)與ppdk3突變體的胚乳淀粉顆粒觀察Fig.5 Observation on endosperm starch granules of wild type(WT)and ppdk3 mutant
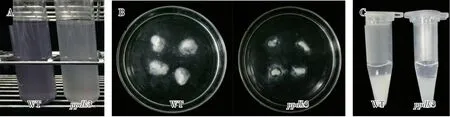
圖6 野生型(WT)和ppdk3突變體的I-KI溶液染色(A)、堿消值測定(B)和尿素溶液中的溶解度(C)Fig.6 I-KI solution staining(A),determination of alkali elimination value(B)and solubility in urea solution(C)of wide type(WT)and ppdk3 mutant
2.5 糊化特性分析
鑒于稻米的堿消值等級與糊化溫度(GT)呈負相關,本試驗采用堿裂解法間接測定稻米糊化溫度[18]。結果表明:ppdk3突變體稻米的堿消值比野生型‘嘉花1號’低(圖6B),說明ppdk3突變體稻米的糊化溫度高于野生型;在尿素溶解性上,突變體稻米較野生型更難溶于尿素(圖6C),說明ppdk3突變體稻米中支鏈淀粉結構發生了改變。
2.6 米粒外觀與農藝性狀調查
對‘嘉花1號’和純合突變體成熟種子的糙米、精米以及橫切面進行觀察,均發現ppdk3突變體稻米的整個胚乳都表現為白色不透明粉質狀(圖7)。另外,該突變體的株高與‘嘉花1號’基本接近,單株穗數明顯減少,千粒重明顯下降,粒長稍有增大而粒寬不變(表3)。可見,水稻PPDK基因突變不僅影響胚乳淀粉特征,還影響其他農藝性狀。

圖7 野生型(WT)與ppdk3突變體的糙米(A、B)、精米(C、D)、米粒橫截面(E、F)及成熟植株(G)觀察Fig.7 Observation on brown rice(A,B),milled rice(C,D),cross section of rice grain(E,F)and mature plants(G)of wild type(WT)and ppdk3 mutant

表3 ‘嘉花1號’和ppdk3突變體的農藝性狀調查Table 3 Investigation on agronomic traits of‘Jiahua 1’and ppdk3 mutant
3 討論
CRISPR∕Cas9技術是近年應用較廣的基因編輯技術,對靶基因進行特異性修飾只需通過一個gRNA和一個Cas9蛋白[19],具有成本低、制作簡便、快速高效等特點。目前,已經成功利用CRISPR∕Cas9技術對水稻多個基因進行編輯。如對水稻直鏈淀粉合成基因Wx進行編輯,獲得穩定遺傳、直鏈淀粉含量適宜的突變體[20];對水稻淀粉分支酶基因SBE3進行編輯,獲得了高直鏈淀粉和高抗性淀粉含量的水稻新品系[21]。本試驗成功利用CRISPR∕Cas9技術對淀粉合成過程中相關基因PPDK進行了編輯,也獲得一種淀粉特征發生改變的突變體。
本試驗在PPDK基因第6外顯子區域設計特異性靶位點,構建單靶點,通過植物組培侵染,獲得一種突變體ppdk3:靶點內缺失一個堿基A,蛋白翻譯提前終止,導致該基因控制合成的蛋白失去了大部分的高級結構。突變體ppdk3的淀粉顆粒呈不規則形狀,排列疏松,存在間隙,可能導致胚乳對光的折射率發生改變而產生白色粉質性狀,這與何冰紓等[22]報道的flo(t)突變體由于不規則、排列疏松的淀粉顆粒造成粉質胚乳相似;同時,盡管突變體的米粒略有增大,但由于淀粉顆粒變小疏松,導致千粒重明顯下降。另外,ppdk3突變體的抗性淀粉含量略有上升,這可能是造成突變體米粒糊化溫度升高的原因之一。由于水稻淀粉合成相關基因尤其是G BSS表達下降,突變體米粒直鏈淀粉含量降低,I-KI染色顏色明顯變淺。由此,推測PPDK基因對淀粉顆粒大小的形成與排列以及淀粉合成具有一定影響。

