早期食管癌的內鏡下診治進展
紀晨光(綜述),劉 麗,馮志杰(審校)
(河北醫科大學第二醫院消化內科,河北 石家莊 050000)
食管癌是臨床上常見的惡性腫瘤,其發病率和病死率在全球均位居前列。我國是食管癌的高發國家之一,嚴重影響人民的健康和生活質量[1]。目前,絕大多數食管癌患者確診時已是進展期,需外科手術或者放化療,患者痛苦大、生活質量低。早期食管癌是指局限于黏膜層的食管浸潤性癌,無論有無區域淋巴結轉移。因早期食管癌的淋巴結轉移率較低,內鏡下切除可以完全治愈,取得與外科手術相當的療效,具有創傷小、痛苦少、恢復快的優勢[2]。因此,如何早期發現、早期診斷和早期治療食管癌,是目前臨床工作的熱點,通過食管癌的早診早治,可降低病死率并提高生存率,提高生活質量,改善食管癌患者預后、節約國家醫療資源、減輕家庭和社會負擔。
1 早期食管癌的診斷
1.1白光內鏡 早期食管癌在普通白光下主要有四種表現:一是色澤的改變(圖1A),黏膜出現發紅或者發白,提示該處可能為炎癥或者早期食管癌,需提高警惕。二是樹枝狀血管網中斷(圖1B),食管黏膜表面可以看到連續及規則分布的樹枝狀血管,如果發現樹枝狀血管中斷,應警惕該處可能存在早期病變。以上兩種表現在內鏡下不容易被發現,漏診率高,內鏡檢查時需要特別仔細觀察。三是異常角化(圖1C),食管發現異常角化時,早期食管癌的可能性非常大,需進一步進行染色、活組織檢查除外早期病變。四是形態的改變(圖1D),如隆起或凹陷性病變,早期食管癌出現形態改變時,內鏡檢查時容易被發現,漏診率較低。
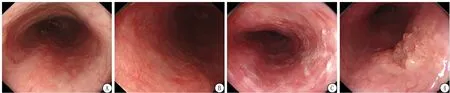
圖1 早期食管癌內鏡下表現
1.2色素內鏡 常用的方法有碘染色法、甲苯胺藍染色法、甲苯胺藍-盧戈液雙重染色法。其中碘染色是發現早期食管癌最常用、最簡單有效的一種輔助檢查。碘染色的原理是鱗狀上皮細胞中富含糖原,糖原與碘接觸后發生反應,呈棕褐色。食管發生炎癥或者早期癌變時, 細胞內的糖原含量減少甚至消失,噴灑碘液后黏膜不著色或呈淡染(圖2)。根據碘染后顏色深淺將碘染色在內鏡下的表現分為4個等級:1級為濃染區,比正常食管黏膜染色深,多見于糖原棘皮癥;2級為正常黏膜,呈棕褐色;3級為淡染區,多見于炎癥或低級別上皮內瘤變;4級為不染區,多見于高級別上皮內瘤變或早期食管癌。只要細胞內的糖原含量減少,碘染色時就會發生顏色深淺的改變,即碘染色的敏感性非常高,由于炎癥時,細胞內的糖原也明顯減少,碘染色后出現不染或者淡染,并不都是高級別上皮內瘤變或早期食管癌,所以碘染色的特異性很差。碘染色后2~3 min不染區出現粉色征,則提示該處高級別上皮內瘤變或早期食管癌的可能性極大,粉色征的敏感度及特異度非常高。有研究證明粉色征的原理可能是高級別上皮內瘤變部位的角質層變薄,該處細胞內的碘排出時間早于正常或者炎癥部位,故能夠較早的恢復原來黏膜的顏色而呈現粉紅色[3],也間接說明該處存在早期食管癌的可能。
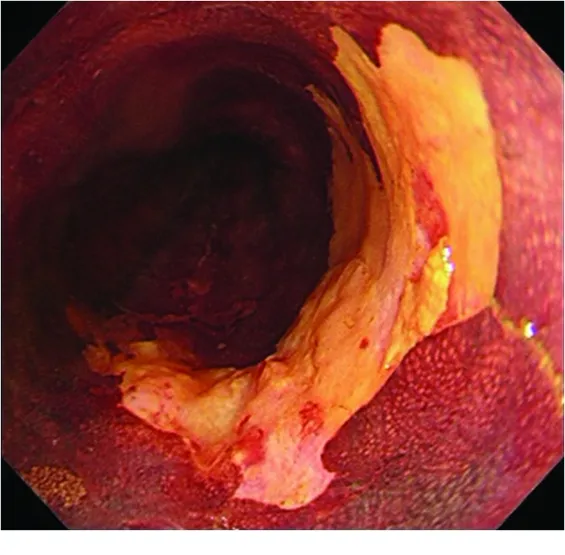
圖2 碘染色后不染區
1.3電子染色 隨著科技的發展,電子染色內鏡越來越普及,目前最常用的電子染色技術是窄帶成像技術(narrow band imaging,NBI),該技術是將紅光濾掉,應用415 nm的藍光和540 nm的綠光觀察黏膜,與色素內鏡相比,電子染色內鏡可以隨時切換,并且對黏膜無任何刺激。在NBI模式下,正常食管黏膜呈現綠色,而早期食管病變會呈現棕色背景。有研究表明出現棕色背景的原理可能是病變處的黏膜層及角質層變薄,照射到黏膜下層的光線增多,反射到眼睛的光線減少,從而呈現較暗的棕色背景[4]。在NBI聯合放大內鏡下,可以清晰的觀察食管上皮乳頭內毛細血管袢(intrapapillary capillary loops,IPCL),根據IPCL的形態變化,可以判斷病變的性質,目前IPCL主要的分型有井上分型、有馬分型及AB分型,最經典的分型是井上分型[5],將IPCL的形態分為五型,Type Ⅰ為正常食管的IPCL,Type Ⅱ/Ⅲ為炎癥或者低級別上皮內瘤變,Type Ⅳ/Ⅴ多為高級別上皮內瘤變或早期食管癌,對病變進行靶向活檢具有指導意義和臨床實用價值。
1.4其他方法 目前一種新型的消化內鏡-共聚焦激光顯微內鏡(confocal laser endomicroscopy,CLE)已經應用于臨床,CLE可以在內鏡檢查的同時直接觀察到組織細胞學形態,并提供無創組織病理學診斷,實現即時“光學活組織檢查”的目的。研究表明CLE能夠有效診斷早期食管癌并判斷其浸潤深度[6]。但是由于共聚焦內鏡成本高昂,目前尚未普及。另外,人工智能在消化道早癌中的應用越來越廣泛[7],國內外對這方面的研究也如火如荼。Hong等[8]利用人工智能模型判斷巴雷特食管癌變,其總體準確率達80.77%,而對于明確為癌前病變的腸上皮化生型巴雷特食管的識別率達100%,這為內鏡醫師早期臨床診治提供了有力的依據。Horie等[9]建立的人工智能模型對1 118張測試圖像進行了分析,并準確地檢測出98%的食管癌病例,其中包括7個小于10 mm的病灶。Kumagai等[10]建立的人工智能系統在診斷食管鱗狀細胞癌方面,其敏感度與特異度均超過90%。因此,借助人工智能技術,將權威專家的知識和經驗更好地惠及大眾,可有效地提高當前內鏡經驗欠缺地區的食管早癌診療水平。
2 浸潤深度判斷
局限于黏膜上皮層及固有層的早期食管癌是內鏡下治療的絕對適應證,而浸潤深度達到黏膜肌層或黏膜下層,淋巴結轉移率明顯增加,所以需要對早期食管癌浸潤深度的進行仔細評估,對治療方式的選擇、患者的預后、術后生活質量均至關重要。
2.1白光內鏡 在白光內鏡下,發現早期病變后,通過吸氣注氣觀察黏膜的柔軟程度,是否僵硬。如果黏膜非常柔軟,說明病變的浸潤深度較淺,一般局限于黏膜上皮層或固有層,如果發現黏膜有僵硬的感覺,說明病變的浸潤深度達到或者超過黏膜肌層。張志宏等[11]通過比較白光內鏡、NBI聯合放大內鏡及超聲內鏡判斷早期食管癌浸潤深度的準確性,認為白光內鏡在判斷早期食管癌浸潤深度方面仍有較大臨床價值。
2.2色素內鏡 主要是在碘染色后觀察病變部位有無席紋征,碘染色后,食管黏膜受到碘的刺激,會出現明顯的席紋征,即環型收縮環,如果病變部位可觀察到席紋征,說明病變多局限于黏膜上皮層或固有層,如果病變部位的席紋征消失,表面病變可能侵及黏膜肌層或黏膜下層。
2.3電子染色內鏡 在NBI聯合放大內鏡下觀察早期食管癌的IPCL形態,根據井上分型,Type Ⅳ/Ⅴ多為高級別上皮內瘤變或早期食管癌,Type Ⅴ型又分為Ⅴ1、Ⅴ2、Ⅴ3、Ⅴn型。Type Ⅳ、Ⅴ1和Ⅴ2型的病變多局限在黏膜上皮層或固有層,Type Ⅴ2和Ⅴ3型的病變多侵及黏膜肌層或黏膜下淺層,而Type Ⅴn型的病變多侵及黏膜下深層。根據日本食管協會AB分型[12],主要分為兩部分,一是微血管的形態,主要分為A型,血管輕度異常,主要為炎癥;B型,血管高度異常,其中B1型血管擴張,蛇形,口徑不一,形狀不均,血管直徑20~30 μm,環狀結構存在,環的起點和終點在一個點上交匯;病變多局限在黏膜上皮層或固有層;B2型血管分支不規則狀,微血管的環狀結構少見,或者環的起點和終點分開,不在一點交匯,病變多侵及黏膜肌層或黏膜下淺層;B3型微血管明顯擴大,管徑直徑3倍于B2型,或直徑>60 μm,病變多侵及黏膜下深層。二是無血管區,無血管區<0.5 mm提示病變局限在黏膜上皮或固有層,無血管區在0.5~3 mm之間,提示病變多侵及黏膜肌層或黏膜下淺層,如果無血管區>3 mm,病變往往侵及黏膜下深層。張志宏等[11]認為在判斷浸潤深度方面,NBI放大內鏡較白光內鏡更有優勢,其中AB分型較井上分型具有一定的優勢。
2.4超聲內鏡 超聲內鏡可以清楚的顯示黏膜的層次,理論上可以顯示早期食管癌浸潤的深度。但是許多研究均發現對于早期食管病變,超聲內鏡并不能準確的反應病變所累及的層次。張志宏等[11]通過比較白光內鏡、NBI聯合放大內鏡及超聲內鏡對判斷早期食管癌浸潤深度的準確性,認為超聲內鏡在判斷黏膜及黏膜下各層浸潤時的準確性不盡如人意,過度判斷率高。Pech等[13]對179例早期食管癌患者在內鏡切除術前應用超聲內鏡進行T分期,與術后病理T分期相比較,認為超聲內鏡在早期食管癌的T分期中的表現并不盡如人意。
2.5光學相干斷層掃描(optical coherence tomography,OCT) OCT是一種用于消化道疾病診斷的新型成像技術,其通過內鏡活組織檢查孔道置入探頭所發出的近紅外光為介質,可對消化道壁各層進行實時顯示。向京元等[14]通過前瞻性研究表明,在評估早期食管癌浸潤深度的準確性方面,OCT與NBI聯合放大內鏡相當。
3 內鏡下治療
目前,早期食管癌的內鏡下治療主要有兩種方式,一是非切除治療,該方法的缺點是無法獲取標本進行病理學檢查;二是切除治療,將病變黏膜分片或者整塊切除,可獲取標本進行病理學檢查,評估病變性質及浸潤深度,目前臨床上多以內鏡下切除治療為主。
3.1內鏡下非切除治療 主要包括射頻消融、氬離子凝固術(argonplasmacoagulation,APC)、光動力療法、激光療法、熱探頭治療、冷凍治療等,都是毀損性治療,不能夠獲得標本,所以目前對于低級別上皮內瘤變多采用非切除治療。例如,有研究納入160例癌前病變患者經APC治療后5年癌變率為3.1%(5/160)。11例早期食管癌患者經APC治療后的5年治愈率僅為27.3%(3/11),5年復發率高達54.5%(6/11)[15]。因此APC治療癌前病變效果較好,但對早期食管癌的治愈率明顯低于食管切除的治愈率。早期食管癌的非切除治療目前臨床應用較少,多應用于癌前病變。
3.2內鏡下切除治療 主要包括內鏡下黏膜切除術(endoscopic mucosal resection,EMR)、內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD),EMR主要適用于較小的病灶,一般病灶直徑不超過2 cm,對于較大的病灶,EMR不能一次性切除,分次切除則不能夠獲得整塊標本。而ESD主要適用于較大的病灶,可以將病灶一次性切除從而獲得整塊標本。EMR操作簡單,并發癥少,ESD的操作難度較大,并發癥多,需要更穩定的控鏡能力。有研究表明在早期食管癌的治療上,ESD優于EMR,因為它的整塊切除率和根治性切除率顯著高于EMR,而局部復發率則明顯低于EMR[16]。隨著ESD在國內的普及,能夠開展ESD的醫院越來越多,目前,ESD已經成為早期食管癌最主要的治療方法。日本食管癌的診療指南里指出食管癌浸潤至上皮層/固有層是ESD的絕對適應證,浸潤至黏膜肌層/黏膜下淺層的淋巴結轉移率增加,是ESD的相對適應證,而浸潤深度超過黏膜下淺層是禁忌證,對于浸潤至上皮層/固有層的患者,應行內鏡下切除,術后不需要追加治療,對于浸潤至黏膜肌層/黏膜下淺層的患者,在內鏡下治療后應考慮追加進一步治療(手術或放化療)[17]。很多研究對比了ESD和外科手術在早期食管癌治療中的效果,認為ESD與外科手術在早期食管癌治療中的療效相當。例如,在一項回顧性研究中,納入了ESD或食管切除術治療浸潤至固有層/黏膜肌層或黏膜下層的早期食管癌患者發現接受ESD治療的患者在中位隨訪時間為21個月后出現圍手術期不良事件或疾病特異性病死率的比例較低,接受ESD治療的T1a或T1b食管鱗癌患者的總體生存率或癌癥復發或轉移與食管癌切除術相比沒有差異[18]。但是也有研究表明對于T1b期的早期食管癌,由于淋巴結轉移率增加,應該行外科手術治療[19]。還有研究顯示,對于T1b的患者,ESD術聯合放化療與外科手術相比,患者2年的無病生存率無明顯差別,但ESD術聯合放化療患者的生活質量更高[20]。
4 并發癥處理
內鏡下切除治療的并發癥主要有出血、穿孔、發熱、術后狹窄等,目前內鏡下非切除治療在國內開展的較少,而ESD是國內早期食管癌的最主要的治療絕大多數,故主要闡述ESD的并發癥。
4.1出血 出血是ESD最常見的并發癥,包括術中及術后出血,術中出血很常見,可以直接應用電凝的方式止血,對于較粗的血管,可以應用電止血鉗夾閉血管,應用柔和電凝的模式止血,也可以應用APC或止血夾等方式止血。ESD術中最主要的是要預防出血,在出血之前,提前處理血管,以保持視野清晰,也避免了術中和術后出血。
4.2穿孔 食管壁很薄,在ESD過程中,很容易損傷固有肌層而發生穿孔。出現小的穿孔,一般應用鈦夾夾閉,術后留置鼻胃管減壓。所以,ESD術中應時刻注意勿損傷肌層,這就要求在ESD術中保持清晰的視野。同時,操作者要有很強的控鏡能力,操作時刀的走向要向遠離肌層的方向,避免損傷肌層。如果較大的穿孔,內鏡下無法處理,要及時行外科手術。
4.3狹窄 ESD術后食管狹窄的發生與性別、年齡無關,而病變大小、浸潤深度、黏膜缺損率、縱向長度對狹窄程度有較大影響。黏膜缺損超過食管周長的四分之三或腫瘤浸潤深度超過食管黏膜固有層是術后狹窄的獨立危險因素[21]。術后食管狹窄的機制尚未完全闡明,但大量研究證明ESD后導致食管狹窄的主要原因是黏膜缺損愈合過程中黏膜下層和固有肌層纖維化形成,導致食管壁彈性和移動度降低[22]。到目前為止,已有許多方法被應用于預防食管狹窄,如激素、內鏡擴張、內鏡支架置入、組織工程、聚乙醇酸片和羧甲基纖維素片等[23-25],每種方法都有自己的優點和局限性。在這些策略中,類固醇預防,特別是在局部注射方面,是目前預防食管ESD后狹窄最常用和最有效的策略。就內鏡預防策略而言,這種預防措施優于通過使用探條擴張和支架置入術進行治療。組織工程技術也顯示出良好的療效。此外,食管黏膜移植、胃黏膜移植、羧甲基纖維素和羧甲基纖維素膜、自助式充氣球囊等新技術由于具有良好的組織相容性和耐受性,為預防食管狹窄打開了新的大門。無論如何,隨著內鏡技術的進步和對食管ESD后狹窄研究的深入,毫不猶豫地相信,更有效、更安全的策略將會到來,食管ESD后狹窄問題最終會得到解決。
5 總 結
綜上所述,早期食管癌的早診早治任重道遠,需要不斷的提高早期發現、早期診斷的能力,早期治療才能得以實現。隨著內鏡設備的不斷更新和普及,早期的食管癌的診斷手段和能力會隨之提高。同樣,隨著治療方法和理念的普及和提高,早期食管癌的患者的治愈率和生活質量也會越來越高。所有這些都需要內鏡及臨床醫師共同努力,在早期食管的診治方面堅持不懈的研究和探索。

