免疫抑制治療IgA腎病97例的效果及預后分析
芮元帆,唐琳
IgA腎病(IgA nephropathy,IgAN)是我國最常見的原發性腎小球腎炎,該疾病通過腎臟免疫病理顯示以IgA為主的免疫復合物在腎小球系膜區沉積診斷。IgAN病人對免疫抑制治療的反應存在顯著差異,其預后也存在顯著差異,既存在長期穩定,亦存在快速進展至終末期腎臟病(End stage renal disease,ESRD)。而這些差異可能與臨床特征及病理特征的多樣化有關,一些回顧性和觀察性研究表明,活性增殖性病變對免疫抑制治療有反應,以及病理特征與臨床特征在某些程度有一定的相關性。然而哪些特征影響免疫抑制治療的結果,臨床病理特征是否對IgAN有預測價值,目前研究尚少。本研究回顧性分析了經免疫抑制治療后不同治療效果的IgAN病人的臨床病理特征,分析臨床特征與病理指標的相關性,并且分析臨床病理特征對IgAN的預測價值。
1 資料與方法
1.1 一般資料
納入標準:2014年6月至2019年6月在鄭州大學第一附屬醫院腎活檢診斷為IgAN的病人;確診后采取至少6個月免疫抑制治療的病人,包括在6個月治療期間進展至終點事件的病人。排除標準:診斷為繼發性IgAN的病人,如狼瘡性腎炎、紫癜性腎炎和肝炎相關腎小球腎炎;在確診前已經接受過免疫抑制治療的病人;未達到終點事件的失訪病人;IgAN病人腎活檢病理為M0E0S0T0-C0,病變與微小病變相似的病人;本研究獲鄭州大學第一附屬醫院醫學科研倫理委員會批準(2019-KY-015),病人或其近親屬對研究方案簽署知情同意書。1.2 方法
1.2.1 病人的分組情況
將納入研究的病人根據治療期間的血肌酐和平均尿蛋白定量水平分為完全緩解組,部分緩解組,未緩解組。完全緩解定義為治療期間平均尿蛋白定量<0.5 g/24 h,血清白蛋白水平≥35 g/L,血肌酐水平穩定(定義為不超過基線值的25%)。部分緩解定義為治療期間0.5 g/24 h≤平均尿蛋白定量<1.0g/24h,血清白蛋白水平≥35g/L,血肌酐水平穩定(定義為不超過基線值的25%)。未緩解被定義為治療期間平均尿蛋白定量≥1.0g/24h,或在治療期間進展到終點事件。記錄病人進展至終點事件的時間,并對未進展至終點事件的病人隨訪至2020年6月。終點事件包括病人進入ESRD或血肌酐水平較基線值翻倍,或因腎臟疾病死亡。1.2.2 資料收集
收集入選病人初次腎活檢時的臨床資料,包括性別、年齡、血壓、血紅蛋白、血白蛋白、總膽固醇、三酰甘油、血尿酸、血肌酐、估計腎小球濾過率(estimated glomerular filtration rate,eGFR)、24小時尿蛋白量和牛津病理分型結果。平均動脈壓采用(1/3×收縮壓+2/3×舒張壓)公式進行計算。用CKDEPI方程估算腎小球濾過率。牛津病理分型定義:采用2016年更新的牛津病理分型系統,包括M(M0,系膜增殖積分<0.5;M1,系膜增殖積分>0.5)、E(E0,無毛細血管內細胞增多;E1,伴毛細血管內細胞增多)、S(S0,無節段性硬化或粘連;S1,伴節段性硬化或粘連)、T(T0,腎小管萎縮/間質纖維化≤25%;T1,腎小管萎縮/間質纖維化26%~50%;T2,腎小管萎縮/間質纖維化>50%)和C(C0,無細胞性/細胞纖維性新月體;C1,細胞性/細胞纖維性新月體0~25%;C2,細胞性/細胞纖維性新月體≥25%)。所有腎臟病理結果由鄭州大學第一附屬醫院腎臟病理實驗室的兩位病理專家分別獨立閱片完成。此外,還記錄治療期間各組不良事件的發生情況。1.2.3 統計學方法
所有統計分析均采用SPSS24.0軟件進行。對于不符合正態分布的定量資料使用M
(P
,P
)描述,兩組間及多組間非正態分布的定量變量采用Jonckheere-Terpstra檢驗進行趨勢比較。分類變量用例(%)描述,用χ
檢驗或Fisher精確檢驗比較組間差異,多組間兩兩比較采用bonferroni校正。將單因素分析有差異的因子納入多變量二元logistics回歸中進行分析,采用OR以及95%CI
表示。利用單因素和多因素Cox回歸評價分析免疫抑制治療后腎臟預后的影響因素。Cox回歸分析結果采用HR及95%CI
表示。P
<0.05表明差異有統計學意義。2 結果
2.1 一般資料及實驗室、病理檢查指標比較
有97例病人符合所有納入標準,并根據治療結果分為三組:完全緩解組(n=44)、部分緩解組(n=17)和未緩解組(n=36)。病人的基線人口學和臨床特征、病理特征見表1。與完全緩解組、部分緩解組的病人相比,未緩解組病人的三酰甘油、平均動脈壓和尿蛋白水平較高,eGFR水平較低,S1、T2的比例高于其他兩組,均差異有統計學意義(P
<0.05),見表1。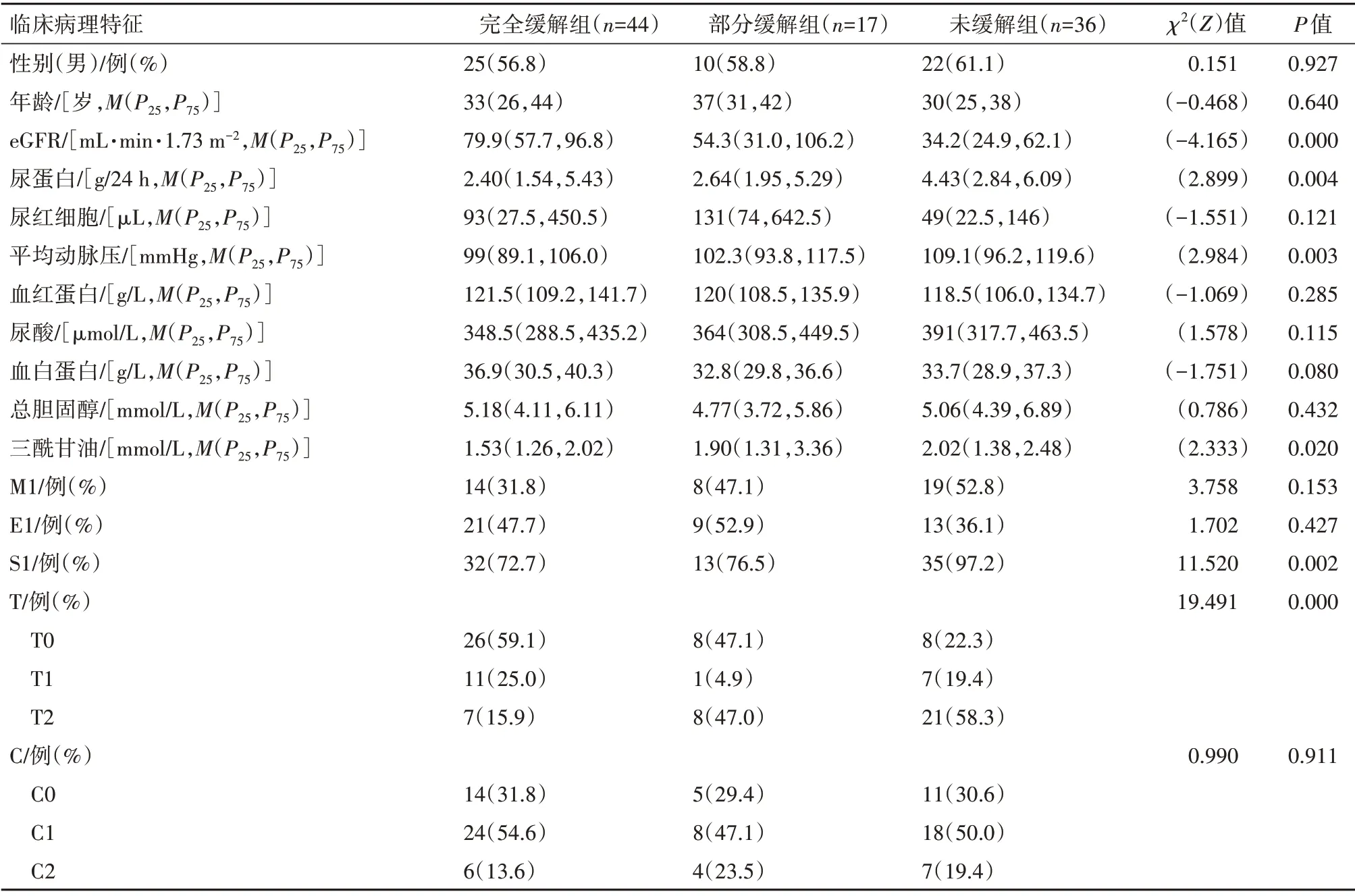
表1 IgA腎病97例不同療效組基線資料對比
2.2 隨訪及腎病結局
三組間中位隨訪時間差異有統計學意義(P
<0.001)。在隨訪期間共有30例病人(30.9%)到達終點事件,其中包括,完全緩解組2例(4.5%),部分緩解組4例(23.5%),未緩解組24例(66.7%),與完全緩解組、部分緩解組相比,未緩解組達到終點事件的發生率更高(P
<0.001),完全緩解組及與部分緩解組之間差異無統計學意義(P
>0.05)。治療期間總不良反應發生率為17.5%(17例),三組間不良反應的差異無統計學意義(P
>0.05),見表2。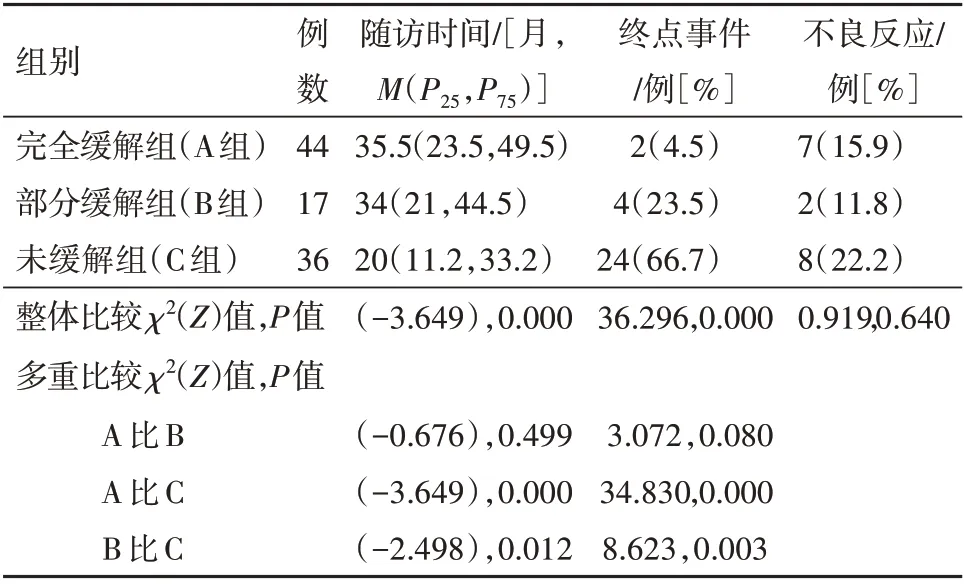
表2 免疫抑制治療IgA腎病97例的不同療效組隨訪情況
2.3 腎活檢時牛津病理分型與臨床特征的相關性分析
本研究將影響治療結果的因素按牛津分型進行分組,得出系膜細胞增生、毛細血管內增生病變嚴重程度與尿蛋白水平相關,呈上升趨勢(均P
<0.05),腎小管間質萎縮/纖維化病變嚴重程度與腎活檢時平均動脈壓、三酰甘油水平相關,呈上升趨勢(P
<0.05);與eGFR也相關,呈下降趨勢(P
<0.05)。新月體病變及節段硬化/粘連與這些臨床特征均無關(均P
>0.05)。見表3。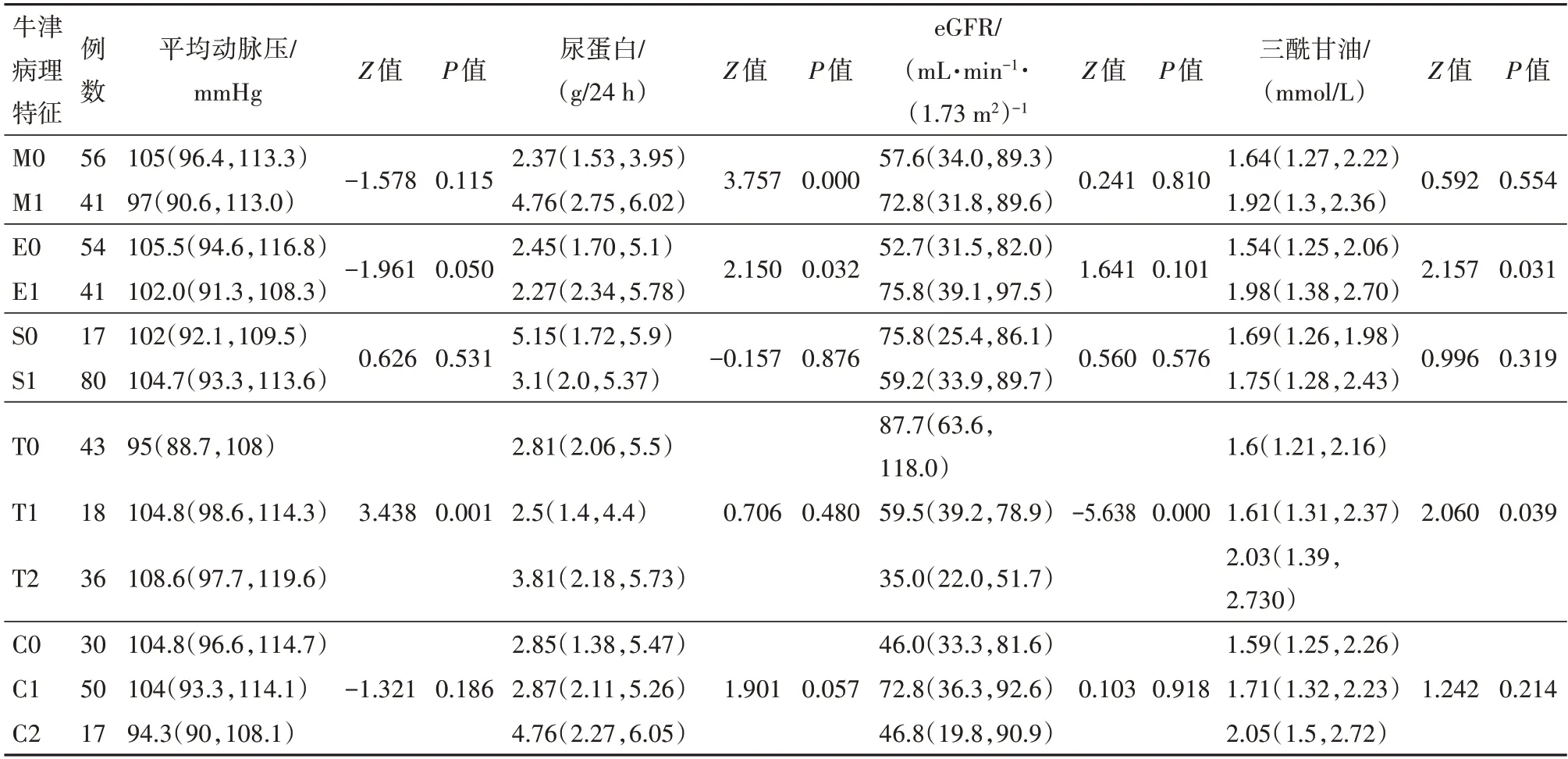
表3 免疫抑制治療IgA腎病97例腎活檢時牛津病理特征與臨床特征的相關性分析
2.4 影響治療結果的多因素logistic分析
將治療結果作為結局變量,分為[0=緩解組(完全緩解組+部分緩解組),1=未緩解組],再將差異有統計學意義的變量(三酰甘油、平均動脈壓、尿蛋白、eGFR、S1、T2)納入多因素logistics回歸分析,納入混雜因素后,結果得出尿蛋白和eGFR水平、以及S病變是影響治療結果的因素,其中尿蛋白以及S病變是免疫抑制治療效果的危險因素(OR
值分別為4.699、99.456,P
<0.05),而eGFR是保護因素(OR
值為0.154,P
=0.002),見表4。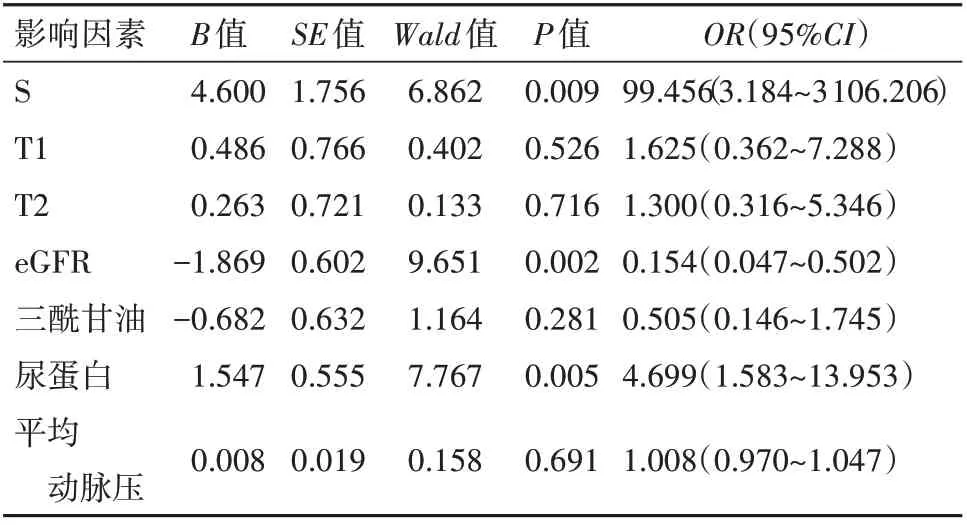
表4 IgA腎病97例影響免疫抑制治療結果的多因素logistics回歸分析結果
2.5 預后分析
單因素Cox比例風險模型分析結果顯示,牛津分型病理特征中,伴有T2病變的IgAN病人進入終點事件風險明顯高于T0病人(HR=18.469,P<0.001)。臨床特征中,腎活檢時eGFR、血紅蛋白水平越低,IgAN病人進入終點事件的風險越高(HR<1,P<0.05),腎活檢時平均動脈壓、24小時尿蛋白定量、三酰甘油水平越高,IgAN病人進入終點事件的風險越高(HR>1.0,P<0.05)。而腎活檢時尿紅細胞、總膽固醇、血白蛋白水平,以及M1、E1、C1和C2是否存在,都與IgAN病人的腎臟預后無關。將上述有統計學意義的變量納入多因素Cox比例風險模型結果顯示,經免疫抑制治療后,T2病變是IgAN病人腎臟不良預后的獨立危險因素(HR
=7.802,95%CI
:1.755~34.697,P
=0.007),并 且 基 線eGFR是腎臟預后的保護因素(HR
=0.211,95%CI
:0.077~0.577,P
=0.002),見表5。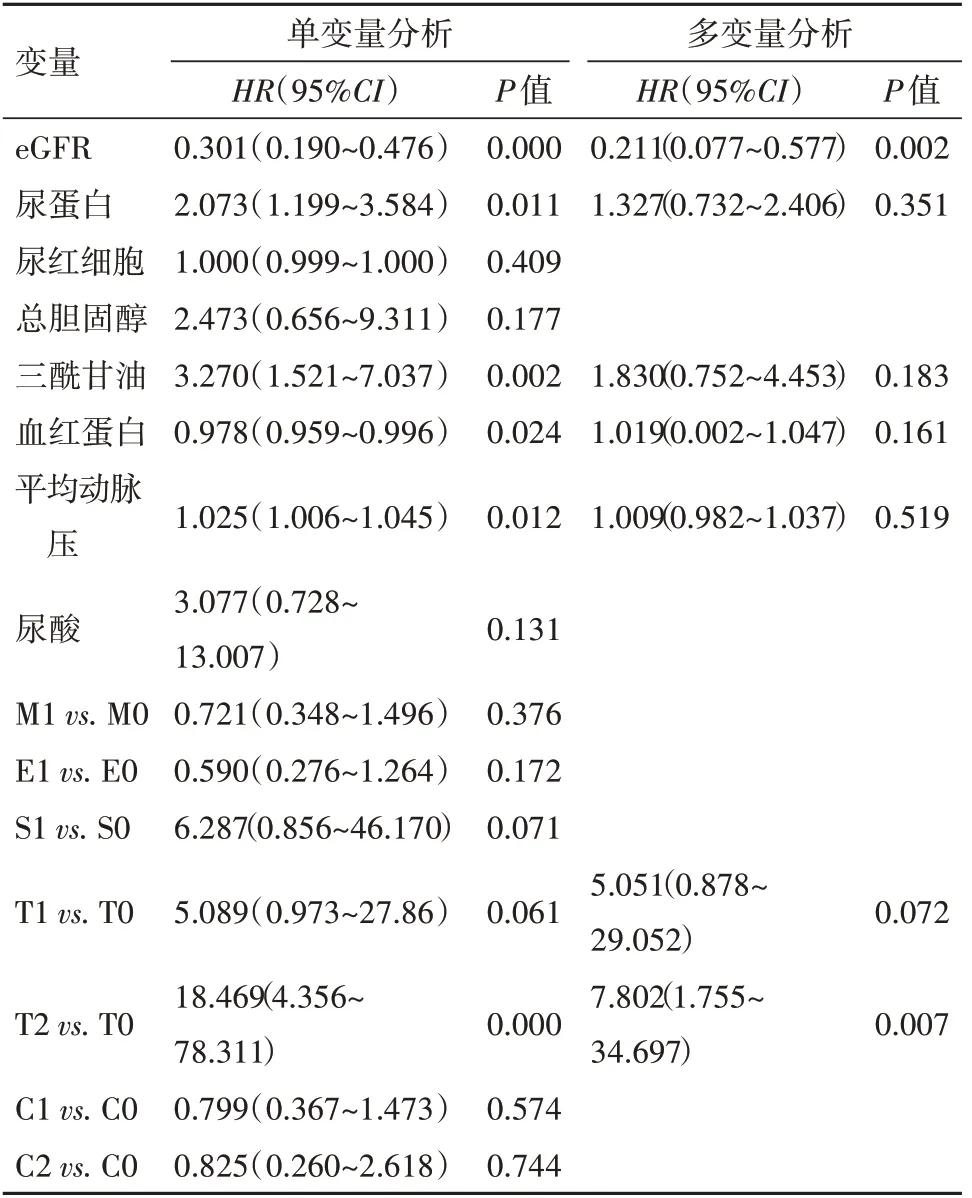
表5 IgA腎病97例不良預后危險因素Cox生存分析結果
3 討論
IgAN治療方案的選擇,尤其選擇免疫抑制治療,在2020年改善全球腎臟病預后組織(Kidney Disease:Improving Global Outcomes,KDIGO)中提出需要個體化評估病人疾病進展和不良反應的風險。本研究作為一項回顧性研究,僅納入了經過免疫抑制治療的IgAN病人進行評估,旨在了解影響免疫治療效果的相關因素,并評估了免疫抑制治療后臨床及病理指標的預測價值。目前臨床上廣泛應用的牛津病理分型,其納入的5項病理指標被認為是IgAN進展的獨立預測危險因子,但最近一項基于VALIGA研究人群的研究指出,M、E、S、C均與使用免疫抑制治療相關,免疫抑制劑的使用可能對病理指標的預測價值產生了影響。并且牛津分型病理指標與臨床指標之間存在一定的相關性,很難單獨討論某一指標對IgAN的價值。本研究通過不同療效組之間對比,得出可能影響IgAN免疫抑制治療效果的因素包括,平均動脈壓、尿蛋白、三酰甘油、eGFR的臨床指標,以及S、T病變的牛津病理指標。其中三酰甘油作為臨床指標,有研究發現,合并高三酰甘油血癥的IgAN病人,其尿蛋白水平較高,eGFR較低,腎臟病理也較差,本研究也發現IgAN病人中未緩解組三酰甘油水平更高,且與毛細血管內細胞增生及腎小管萎縮/間質纖維化病變程度有關。雖然三酰甘油在本研究中并未發現是IgAN進展的獨立危險因素,但仍有影響腎臟預后的作用。這些都可能跟高三酰甘油血癥對腎小動脈、腎小管-腎間質等腎臟結構和功能的損傷有關,且早期的三酰甘油即可以加重腎臟病變。不過有研究指出給予降脂藥物治療能顯著降低IgAN尿蛋白水平,延緩腎功能惡化,改善預后。因此,臨床上應重視IgAN病人的降脂治療,尤其是對于高三酰甘油血癥的及時干預。
本研究發現,腎活檢時尿蛋白水平是免疫抑制治療IgAN的獨立危險因素。而很多研究一致認為尿蛋白(持續>1 g/d)是IgAN病人進展的危險因素,并且蛋白尿水平的降低與腎臟結局的改善獨立相關,因此降低尿蛋白水平是治療IgAN的關鍵。尿蛋白的產生被認為是由活動性病變或腎小球硬化伴高濾過、腎小管損傷等原因引起,其中活動性病變包括腎小球系膜細胞增生、內皮細胞增生以及新月體形成等。本研究中也得出腎活檢時尿蛋白水平與系膜細胞增生及毛細血管內細胞增生病變程度相關。而一項重復腎活檢的研究明確得出,在免疫抑制治療后腎小球內皮細胞增生、系膜細胞增生、新月體病變和袢壞死等活動性病變明顯逆轉,同時組織學病變逆轉的病人,其尿蛋白和血尿水平也明顯下降。同樣地,本研究也發現,免疫抑制治療期間將尿蛋白維持在1 g/24 h以下以及血肌酐穩定的病人,腎臟的隨訪時間更長。且經過免疫抑制治療后,M病變和E病變也不再具備預測腎臟進展的價值。
新月體病變作為牛津分型中新納入的IgAN腎臟進展的獨立預測因子,目前備受爭議。Haas等人通過對3 096名IgAN病人的回顧性研究得出,僅在未使用免疫抑制治療的前提下證實新月體病變具有獨立預測價值。新月體病變,尤其是細胞性/細胞纖維性新月體一直被認為是活動增殖性病變,并且對經過免疫抑制治療的IgAN病人進行重復腎活檢時,發現第1次腎活檢存在的C病變有76.4%(39例)逆轉。但關于IgAN的多項研究卻指出C2無論是否接受免疫抑制治療,腎臟預后都不會明顯改善,這可能與彌漫性腎小球新月體生成促進了腎小管間質的損傷有關,也是各種腎小球疾病轉變成進展性腎病的一個標志。一項多中心研究認為C2是IgAN病人進展至ESRD和eGFR減半的強預測因子,但是該研究共納入3 380例IgAN病人,C2病人僅占1.8%(60例),并且其納入的C2病人中eGFR、尿蛋白和T病變指標,均明顯差于C0和C1病人。而本研究中納入的IgAN病人中C2占17.5%(17例),且不同程度新月體病變病人中eGFR和尿蛋白水平并無差異,且C2不具備IgAN病人進展獨立預測價值,可能與其對免疫抑制治療有反應有關,結合本研究結果,在利用新月體病變判斷IgAN病人腎臟預后時,不能僅考慮其病變程度,還需要同時判斷T病變等指標的嚴重程度。不過本研究納入的C2樣本過少,還需要加大樣本量去證實。
對比其他牛津分型指標,S病變是牛津病理分型最為常見的病變,67%~86%的IgAN病人在初次腎活檢時就存在節段硬化或粘連。本研究中,S1病變是免疫抑制治療效果差的獨立危險因素,但經Cox回歸分析后并未發現其具備IgAN進展的獨立預測價值。這與一項中國的多中心研究得出的結果一致,該研究認為S1病變在人群中過于普遍,例如本研究納入的IgAN病人中S1病變就占了82.4%,且S病變中包含袢粘連和腎小球節段硬化,但該研究得出袢粘連與腎臟預后并無顯著相關,因此認為其與腎小球節段硬化合并為S病變,反而降低了腎小球節段硬化的預測價值。本研究中T2病變雖不能獨立影響免疫抑制治療效果,但未緩解組T2病變比例明顯高于其他兩組,且始終是IgAN進展的獨立危險因素,這一點也已經被很多研究所證明,其中有研究還指出接受免疫抑制治療后腎間質纖維化和腎小管萎縮的病人沒有減少,其eGFR的下降率還明顯高于僅接受腎素-血管緊張素系統阻斷劑(renin-angiotensin system blockade,RASB)治療的病人。本研究在免疫抑制治療期間引起的不良反應的總發生率不高,且不同療效組差異無統計學意義,但不可忽略的是,一項大規模的隨機對照試驗指出,糖皮質激素治療組發生不良事件的風險較安慰劑組增加了11%,尤其是對于低水平的eGFR(<30 mL·min·1.73m),免疫抑制治療的毒性作用顯著,同時本研究也得出低eGFR水平是免疫抑制治療效果和IgAN進展的獨立危險因素。結合以上,對于低eGFR水平且伴有T2病變的IgAN不建議使用免疫抑制治療。
綜上所述,在IgA腎病病人中,臨床指標中,基線eGFR、尿蛋白是影響治療結果的獨立因素,僅eGFR能獨立預測腎臟預后。牛津分型指標中,S1病變是治療效果差的獨立危險因素,伴S1病變的病人腎臟預后差,但其不具備獨立預測價值。僅T2病變不受治療限制,仍然具有獨立預測價值。M、E和C病變在經過免疫抑制治療后均不再具有預測價值。然而,本研究作為一個回顧性研究,一些樣本隨訪時間短,且僅納入單中心的經免疫抑制治療的病人數據,樣本量較小。因此,研究結果尚需更大樣本量、多中心研究以及延長隨訪時間進行驗證。

