外泌體在乳腺癌微環境中的研究進展
李康迪,李文化
1. 武漢大學生命科學學院(武漢 430072)
2. 細胞穩態湖北省重點實驗室(武漢 430072)
乳腺癌是影響女性健康的重大疾病。在2018年全球癌癥的發病率和死亡率排名中,乳腺癌分別高居第二和第五位,而在女性癌癥患者中,乳腺癌是最常見的癌癥類型,全球范圍內四分之一的女性新發癌癥病例均為乳腺癌[1]。國家癌癥中心新發布的2019年全國癌癥報告顯示,在2014年及2015年我國女性癌癥患者中乳腺癌的發病率分別為16.5%和17.1%,均高居第一。研究表明,乳腺癌微環境中的外泌體在乳腺癌的發生發展過程中起著關鍵作用。本文將對外泌體在乳腺癌微環境中的研究進展進行綜述。
1 乳腺癌微環境概述
腫瘤微環境(tumor microenvironment,TME)又被稱為癌癥微環境,它是腫瘤進展過程中由一群復雜且動態變化的細胞群和非細胞組分共同形成的。對于乳腺癌來說,除了癌細胞以外,其他的細胞組分包括成纖維細胞、癌癥干細胞、巨噬細胞、脂肪細胞、內皮細胞等,而非細胞組分則包括細胞外基質和一些細胞因子等(圖1)[2-3]。在發生乳腺癌的轉移時,首先原發位點要有一個適合癌細胞轉移的微環境,以利于癌細胞脫離原位。其次,癌細胞在轉移到新的次級生長位點時,這里會形成一個利于癌細胞生長的轉移前生態位,這個生態位事實上也是一個適合癌細胞生長的微環境,可見乳腺癌微環境的存在對癌細胞本身的進展十分重要。具體來說,腫瘤相關巨噬細胞通過分泌大量促腫瘤原性蛋白、細胞因子和生長因子支持原發性腫瘤生長、血管生成和侵襲,隨著腫瘤的生長,免疫抑制細胞被激活,通過抑制T淋巴和B淋巴細胞的增殖和活化或抑制自然殺傷細胞的細胞毒性幫助腫瘤細胞逃避這些免疫細胞的監視和殺傷[4]。腫瘤微環境中的血管內皮細胞則能通過構建微環境內的新生血管使腫瘤細胞免受缺氧損害,同時也能幫助構建淋巴管以利于腫瘤細胞的轉移[5]。腫瘤微環境中的細胞外基質如膠原蛋白和纖連蛋白也能夠通過其他細胞分泌的一些酶或整連蛋白而改變自身的收縮力或結構以支撐癌細胞的運動(圖1)[6-7]。
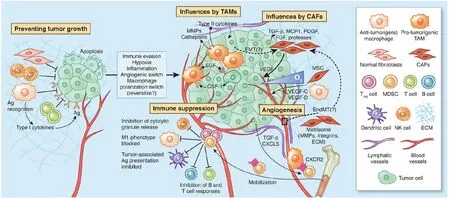
圖1 腫瘤微環境的組分[7]Figure 1. Components of the tumor microenvironment[7]
事實上,乳腺癌微環境和乳腺癌細胞本身是相互促進、共同發展的,癌細胞也能夠主動改造微環境以適應自身生長,比如產生包括FGF、VEGF、PDGF、TGFβ在內的細胞因子和蛋白酶來改造微環境的細胞組分,產生細胞外基質組分來改造細胞外基質,甚至是誘導血管生成(圖2)[8-10]。具體來說,乳腺癌干細胞能夠分泌Shh到癌癥相關的成纖維細胞中促進其增殖,反過來,癌癥相關的成纖維細胞又能夠分泌促進乳腺癌干細胞增殖和自我更新的細胞因子[11]。
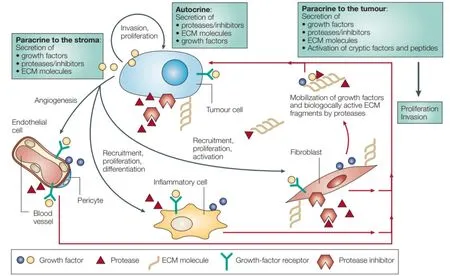
圖2 癌細胞對腫瘤微環境的重塑作用[10]Figure 2. The remodeling effect of cancer cells on the tumor microenvironment[10]
大量研究表明,乳腺癌微環境各細胞之間的通訊主要由細胞外細胞因子和外泌體介導的旁分泌信號來完成[12-14],大多數情況下,乳腺癌微環境的細胞組分可以通過旁分泌信號調控癌癥進展,例如調節乳腺癌細胞的增殖、上皮間充質轉化、干性和化學耐藥性[15]。
2 外泌體概述
自2011年Gy?rgy首次將封閉的脂質雙層膜的胞外結構定義為細胞外囊泡以來[16],對于細胞外囊泡的認識越來越清晰。細胞外囊泡主要包括凋亡小體、微囊泡和外泌體,這三者在粒徑、釋放途徑以及包涵物上有很大區別[17],因此根據細胞外囊泡的區別,可通過差速離心設定不同的離心力和離心時間來分離不同的細胞外囊泡。另外,無論是真核生物還是原核生物,幾乎所有的細胞都能分泌細胞外囊泡[18]。細胞外囊泡能夠通過出芽或內吞的形式參與多囊泡結構與質膜的融合中,導致內腔囊泡向胞外的釋放,從而產生一種細胞外囊泡的亞型——外泌體[19],其中RAB27A蛋白很大程度上控制了外泌體向胞外釋放[20]。外泌體廣泛分布于外周血、唾液、尿液、腹水、胸腔積液、母乳和其他體液中[21],其粒徑大小一般在40 ~160 nm之間,為茶托狀結構,沉降離心力為100 000 g,在蔗糖中的密度為1.13 ~1.19 g /mL,其膜上有著標志蛋白CD81、CD9、CD63等。外泌體中包含著許多細胞成分,主要包括DNA、RNA、蛋白質、脂質等,同時TSG101、Alix也是其特征蛋白(圖3)[18]。根據外泌體上述特征,可通過超速離心結合蔗糖密度梯度離心的方法分離到較為純凈的外泌體,并通過電鏡觀察鑒定分離到的外泌體[22]。細胞分泌外泌體最初被認為是向外排出不必要的細胞成分以維持細胞內環境的穩定性[23-24],然而近年大量研究報道外泌體參與了細胞間的通訊以及多種疾病的發生、發展[25-26]。外泌體通過表面分子如整合素靶向受體細胞,與靶細胞結合后,可通過受體-配體相互作用誘導細胞內信號傳導,或被靶細胞內吞,又或者與靶細胞的膜融合以將其內容物傳遞至其胞質從而達到信息傳遞的目的[27-28]。
3 外泌體在乳腺癌微環境中的作用
外泌體幾乎存在于所有類型的細胞且廣泛分布于各種體液中,極大程度參與了細胞間的通訊,為其在腫瘤微環境的重要作用奠定了基礎。大量研究報道,外泌體在腫瘤微環境中參與細胞存活、細胞轉移、細胞代謝重組以及血管生成等(圖3)[18]。具體來說,外泌體能通過運輸MMPs對細胞外基質進行重塑[29],也能通過纖連蛋白與整合素幫助癌細胞的粘附和提高其遷移速度[30]。其次,從乳腺癌干細胞中釋放的外泌體能影響附近乳腺癌細胞中的信號轉導并促進乳腺癌細胞的干性[21]。乳腺癌細胞分泌的miR-105通過外泌體破壞血管內皮屏障以促進自身的轉移[31]。胰腺癌細胞的外泌體會遷移到遠處的器官,幫助形成富含TGFβ、纖連蛋白和趨化因子的轉移前生態位[32]。此外,最新研究表明,腫瘤微環境中的多種細胞都能夠分泌表達PDL1的外泌體參與到腫瘤免疫逃逸中[33]。本團隊也有大量研究表明,外泌體參與到了乳腺癌相關成纖維細胞與癌細胞,例如異常低表達p85α的成纖維細胞中能夠通過旁分泌WNT10B促進乳腺癌細胞的轉移[34],乳腺癌細胞能通過分泌含有大量Survivin蛋白的外泌體促進成纖維細胞的活化[35]。
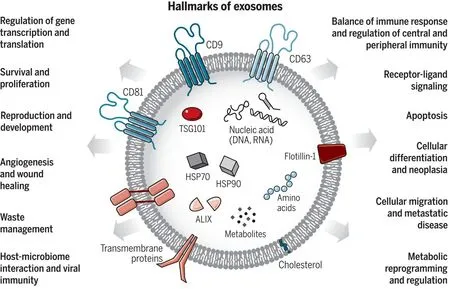
圖3 外泌體的標志與功能[18]Figure 3. Signs and functions of exosomes[18]
外泌體作為腫瘤微環境中細胞通訊的重要介質之一,往往能通過其包含的蛋白質、DNA、RNA等物質起到信息交換與物質傳遞的功能。miRNA是外泌體裝載物中的重要組成部分,在原位腫瘤微環境中發揮了關鍵的作用。例如乳腺癌微環境中,外泌體中的miR-10b可以通過抑制非轉移性癌細胞中的靶基因,如HOXD10和KLF4的蛋白質水平來促進其發生侵襲[36]。轉移前生態位作為癌癥的遠端轉移位點中適合循環癌細胞的生存和生長的微環境,也能受到外泌體miRNA的作用而進行重塑。例如,乳腺癌外泌體中的miR-186、miR-23a和miR-205能促進癌細胞在肝臟形成小生境,從而為轉移癌細胞的生長提供良好的環境[37]。除此之外,乳腺癌微環境中的外泌體miRNA還能夠改變癌細胞的代謝水平,例如乳腺癌來源的外泌體miR-122能夠轉移至腦部和肺部中性粒細胞中的基質細胞來改變其葡萄糖代謝,從而提高乳腺癌細胞的轉移效率[38]。
4 外泌體在乳腺癌中的臨床應用探討
為了進一步降低乳腺癌的發生率,提升乳腺癌的治愈率和患者的生存質量,必須加深對乳腺癌的了解,以開發有效的針對性的治療方法。目前關于乳腺癌的研究大多集中在乳腺癌細胞的發生與發展方面,并且已經發現了許多乳腺癌中易突變的致癌基因,基于此研發了靶向這些基因的抗癌藥物,然而,由于乳腺癌細胞的轉移性與干性,這些抗癌藥物的療效往往不盡人意。根據Hanahan和Weinberg總結出的幾個主要的癌癥標志特點以及Paget提出的癌癥的“種子與土壤”理論可知,癌癥的發生與發展絕不僅僅是由于癌細胞本身造成的,它還需要腫瘤微環境這個豐沃的“土壤”對其生長給予有力的支持。外泌體作為微環境的成纖維細胞、免疫細胞、血管內皮細胞與癌細胞之間重要的交流介質,對癌細胞的轉移、免疫逃逸、血管生成以及干性都有著重要的調控作用[39]。目前有研究表明,通過外泌體包裹的有功能的活性miRNA-1142-3p抑制劑能夠抑制乳腺癌的成瘤能力[40]。基于已取得的研究成果,有理由相信乳腺癌微環境中的重要調控者——外泌體在臨床診斷中的廣闊前景。具體來說,基于目前的RT-PCR、微陣列或RNA 測序等技術,已可以實現在飛摩爾范圍內對體液中相對微量的RNA分子進行檢測[41],再加上外泌體分離技術的迭代更新以及外泌體在人體體液中廣泛存在這一重要特性,均為外泌體miRNA 的檢測提供了有力的支持[42]。因此,目前外泌體miRNA不僅成為了癌癥前期檢測的指標之一,同時也成為了指示癌癥病人預后情況的指標之一。例如,高水平的miR-185或低水平的miR-133b都與結直腸癌的轉移和較差的預后有關[43]。更加重要的是,利用外泌體的載體性質以及能夠穿過血腦屏障這一傳統藥物不具有的優勢,可將與疾病相關的miRNA模擬物或抑制劑裝載到患者的外泌體中,并重新注入血液中,以使患者體內外泌體miRNA水平恢復正常,從而達到治療的目的[44-45]。因此,對外泌體的研究和利用或許能對乳腺癌的治療提供新的方向。
5 結語
與體外培養的貼壁細胞不同,人體內疾病的發生在空間與動態變化上往往呈現較大的復雜性。因此,在腫瘤微環境中的外泌體基礎上研究乳腺癌的發生發展,能夠闡明乳腺癌細胞與腫瘤微環境其他細胞之間溝通的新的分子機制,以及調控癌細胞功能的新的關鍵基因,這樣一種細胞之間相互調控作用更加真實反應了體內的生理現象。當然,疾病的發生絕不可能只是兩種細胞群之間的相互作用,一定是多類群、多方向、多維度的復雜調控網絡。因此,未來針對癌癥的研究還需要更加全面的把握。

