循環水養殖系統微濾機過濾對調節水體細菌群落結構的影響
肖 坤,郝婧薇,王 藝,曲寶成,傅松哲,劉 鷹
(1 大連海洋大學水產設施養殖與裝備工程技術研究中心,遼寧 大連,116023;2 設施漁業教育部重點實驗室,遼寧 大連,116023;3 河北科技師范學院 海洋資源與環境學院,河北 秦皇島,066000)
循環水養殖系統(Recirculating aquaculture system,RAS)因其節水、高效、環保和產品安全被普遍認為是解決水產養殖環境污染、提高產品質量、實現可持續發展的有效途徑[1-4]。然而由于養殖過程中飼料投喂和糞便產生等原因,養殖水體中存在相當數量(3~25 mg/L)的總固體懸浮物(Total suspended solids,TSS)。固體懸浮物包括無機和有機兩種,其中有機固體懸浮物會導致氧的消耗、有機物腐敗和病原菌滋生等問題,而無機固體懸浮物極易堵塞養殖生物的鰓,吸附于懸浮物的大量病原微生物很容易造成宿主的鰓部感染,這些都大大增大了養殖生物的發病概率[5-8]。因此,如何降低循環水養殖系統的懸浮顆粒物質量濃度,減少病害發生的潛在風險,是實現循環水養殖新模式穩定運行的關鍵[9]。
許多研究已表明過濾可以有效降低養殖水體致病菌含量。Huq等[10]于1996年使用家用紗麗材料制作的濾器對含有霍亂弧菌的水源進行過濾試驗,結果表明過濾能夠去除水體中99 %的霍亂弧菌,可以有效地阻止霍亂的傳播。Fu等[11]將27種常見海洋細菌引入養殖鱸魚的循環水養殖系統,之后通過20 μm的尼龍網或4層紗麗網對養殖水體進行過濾,結果表明過濾可以去除養殖水體90 %的弧菌,過濾后養殖池鱸魚的死亡率顯著低于未過濾養殖池。
循環水養殖系統中,微濾機在去除固體懸浮物上起著重要作用[12-14]。然而,微濾機在多大程度上能夠調節養殖水體中細菌種群組成的相關研究還未見報道。特別是長時間運行后,微濾機處理效果的相關研究較少。
采用FISH檢測和16S rDNA擴增子測序技術識別和表征無微濾機的池A及微濾機過濾的池B養殖水體中細菌種群結構的變化,旨在為微濾機過濾對循環水養殖水體細菌種群結構的影響進行探究,為循環水養殖生產中病害的防控提供指導。
1 材料和方法
1.1 循環水養殖試驗系統
以大連海洋大學設施養殖與裝備工程研究中心實驗室內養殖紅鰭東方鲀(Takifugurubripes)的循環水試驗系統進行試驗,每套系統均由相同規格的養殖池、微濾機、蛋白分離器、生物處理系統、臭氧泵和紫外消毒裝置組成。養殖池規格為100 cm×80 cm×130 cm,兩套系統分別編號A和B,A系統無微濾機,表示為“池A”,而B系統安裝200目濾網直徑(約74 μm)的微濾機,表示為“池B”。在保持5%日補充新水量的情況下維持60 d。試驗用魚為紅鰭東方鲀幼魚(15.27 g/尾),每個養殖池投放20尾,初始養殖密度2.55 kg/m3。系統的生物濾池均掛膜30 d后開始進行試驗。養殖試驗中控制養殖水體DO 7~8 mg/L,pH 7.0~7.2,溫度(T)18~23 ℃,鹽度為30~32,水力停留時間(HRT)約為30 min。
1.2 循環水養殖系統水樣采集與處理
自2018年6月29日開始養殖,在試驗第1天,第30天,第60天后分別于A和B養殖池水面以下0.1 m處采集水樣1.5 L,其中0.5 L用于水樣弧菌計數、異養細菌計數和FISH檢測,1 L用于養殖水體總基因組DNA的提取。所有樣品采集后立即在實驗室進行以下處理:1)弧菌和異養細菌計數:取水樣2 mL后混勻備用。2)FISH檢測水樣制備:取100 mL養殖水體室溫下以甲醛(最終濃度,質量/體積為2%)固定30 min后,于0.22 μm無菌醋酸纖維濾器過濾收集,雙蒸水沖洗過濾器收集樣品后于-20 ℃儲存備用。3)提取總基因組DNA水樣制備:參照吳歡歡等[15]的方法,養殖水體以置有 0.22 μm 無菌醋酸纖維素酯膜的濾器進行抽濾,之后將濾膜剪碎裝于無菌離心管中,以水樣微生物總 DNA 提取試劑盒(FOREGENE)對養殖水體細菌進行基因組DNA的提取,瓊脂糖凝膠電泳和紫外分光光度計檢測DNA提取質量,-20 ℃儲存備用。
1.3 循環水養殖系統水體弧菌和異養細菌計數
取養殖水體1 mL做10倍系列梯度稀釋液分別涂布于TCBS和LB平皿內,每個稀釋梯度設置3個平行,于37 ℃培養48 h后進行計數[16]。
1.4 循環水養殖系統水體細菌FISH檢測
篩選典型的r-策略菌群的弧菌屬(Vibrio)、k-策略菌群的紅細菌科(Rhodobacteraceae)的紅細菌屬(Rhodobacter)和玫瑰桿菌屬(Roseolacter)為檢測菌,利用Eilers等[17]設計的特異性寡核苷酸探針G-V(5’-AGGCCACAACCTCCAAGTAG-3’)和G-Rb(5’-GTCAGTATCGAGCCAGTGAG-3’)對養殖水體的r-策略菌群和k-策略菌群空間的分布變化進行FISH檢測。
FISH檢測以Eilers等[17]方法按以下步驟進行:1)將固定的水體樣本轉移至涂有聚四氟乙烯的顯微鏡載玻片上,通過空氣干燥進行固定;2)將已干燥固定樣本依次以50%,80%和100%(wt/vol)乙醇進行脫水和進一步固定;3)脫水后將載玻片上的細胞與寡核苷酸探針G-V和G-Rb雜交;4)對雜交后的樣本進行4,6-二脒基-2-苯基吲哚(DAPI;1 mg/mL)染色;5)將制備好的樣品置于顯微鏡下觀察。
1.5 16S rDNA文庫的構建
提取養殖水體總基因組DNA,委托北京百邁克科技股份有限公司進行16S rDNA V4區高通量測序及16S rDNA文庫的構建。基于 Illumina HiSeq 測序平臺,以雙末端測序(Paired-End)進行小片段文庫的構建,構建后對文庫進行測序,每個樣品重復2次。在對原始測序序列進行過濾、雙端拼接后得到優化序列。利用軟件QIIME(version 1.8.0)[18]中的UCLUST將優化序列進行聚類,進而進行操作分類單元(Operational Taxonomic Unit,OTU)的劃分,并根據OTU的序列組成獲得養殖水體樣本中細菌的物種分類。在OTU結果的基礎上對樣品進行分類學分析,獲得養殖水體細菌的群落結構圖。Alpha多樣性分析研究97%以上相似度水平下的Ace、Chao1及Shannon指數,對養殖水體細菌群落多樣性進行分析。同時運用主成分分析(Principal Component Analysis,PCA)技術對養殖水體細菌群落的差異性進行分析。
1.6 數據分析
數據采用SPSS 20.0統計學軟件對養殖水體弧菌和細菌總數進行配對樣本T檢驗。
2 結果
2.1 循環水養殖系統水體弧菌和異養細菌總數的變化
在養殖試驗周期內,循環水養殖系統運行正常,紅鰭東方鲀幼魚均未出現死亡且攝食與活動均較為正常。
養殖水體中弧菌總數如圖1所示,隨著時間的推移,養殖水體弧菌總數迅速升高,池A養殖水體弧菌總數均高于池B,尤其是第60天時,池A養殖水體弧菌總數顯著高于池B(P<0.05)。
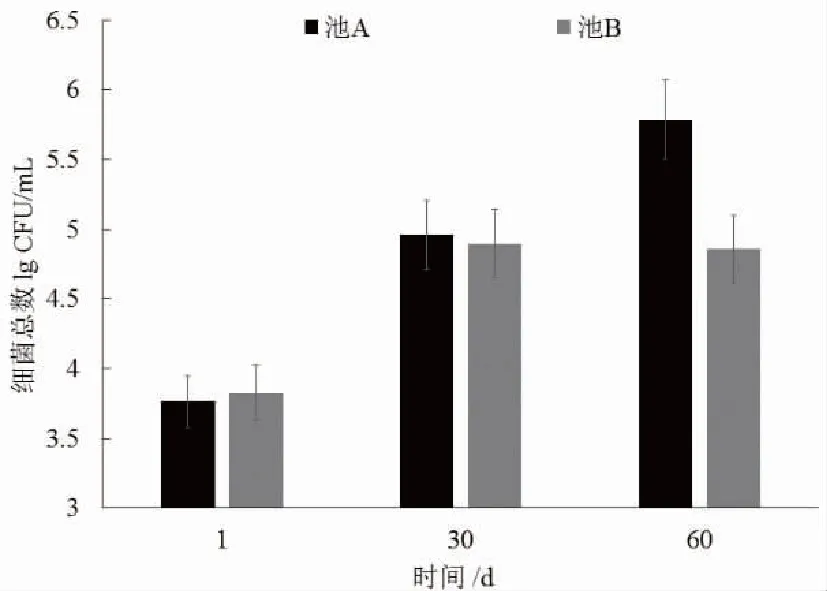
圖1 循環水養殖系統水體弧菌總數變化
養殖水體中異養細菌總數如圖2所示,隨著時間的推移,養殖水體異養細菌總數亦迅速升高,
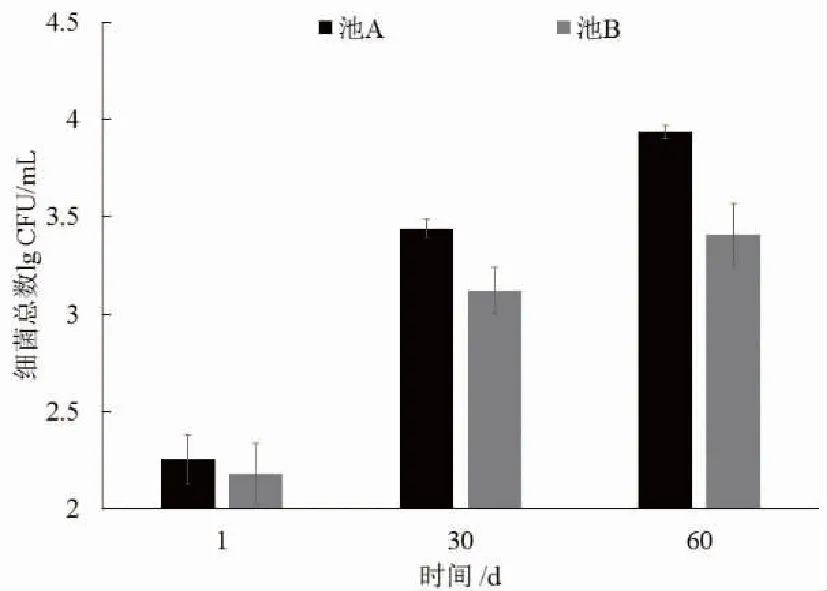
圖2 循環水養殖系統水體異養細菌總數變化
除試驗第1天外,池A養殖水體異養細菌總數均高于池B,第60天時,池A養殖水體異養細菌總數顯著高于池B(P<0.05)。
2.2 循環水養殖系統的水體細菌空間分布變化
結果如圖3所示,養殖起始時,池A和池B養殖水體FISH檢測弧菌屬與紅細菌科信號的強度和數量相近且分布較為均勻。隨著時間的推移,檢測熒光信號強度及數量均逐步增加,表明檢測菌數量逐步增多。池A如圖3A所示,隨時間的推移,養殖水體中檢測弧菌屬熒光信號聚集成點狀,而檢測紅細菌科的熒光信號較均勻地分布于養殖水體中;池B如圖3B所示,隨時間的推移,養殖水體中檢測弧菌屬與紅細菌科熒光信號明顯增加的同時,依然較均勻地分布于養殖水體中。

圖3 循環水養殖系統水體細菌FISH檢測
2.3 16S rDNA擴增測序
2.3.1 循環水養殖系統水體細菌群落組成分析
對養殖水體各采樣點水體進行16S rDNA V4擴增測序,池A 3個采樣時間的水體分別標記為1 A,30 A和60 A,池B 3個采樣時間的水體分別標記為1 B、30 B和60 B。
樣品的覆蓋率(Good’s coverage)指數均達到99.9 %(表1),說明本試驗測序深度足夠大,足以覆蓋樣品的大多數微生物,測序的數據量合理[19]。對OTUs的代表序列進行物種注釋,結果顯示循環水系統水體中細菌主要分布于γ-變形菌綱(γ-Proteobacteria)和α-變形菌綱(α-Proteobacteria)。其中,除1B養殖水體優勢菌為Cobetia屬外,其他養殖水體優勢菌均為弧菌屬、Erythrobacter屬和紅細菌科(Rhodobacteraceae)。池A和池B養殖水體細菌組成結構存在一定差異,采集的養殖水體中,池A養殖水體中弧菌屬所占總細菌的比例隨時間的推移迅速升高,池B養殖水體中弧菌屬所占總細菌的比例在試驗第1天和第30天時均較小,在第60天時迅速升高。兩池相較而言,池A水體中的弧菌屬所占細菌總量的比例均顯著高于池B;除試驗第30天存在波動外,池A水體中具有較好調水作用的紅細菌科所占細菌總量的比例顯著低于池B(圖4)。
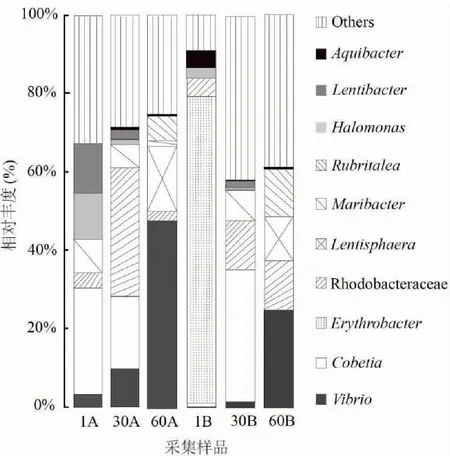
圖4 循環水養殖系統水體細菌種群結構組成
2.3.2 循環水養殖系統水體的細菌群落多樣性分析
對養殖水體細菌群落的Alpha多樣性(Alpha diversity)進行分析,反映養殖水體細菌群落物種豐度及多樣性。結果顯示:試驗第1天,池A養殖水體細菌種群Chao1指數和Ace指數顯著低于池B,其他時間點池A和池B養殖水體Chao1指數、Ace指數及Shannon指數均無明顯變化,即表明試驗第1天,池A養殖水體的細菌豐度和多樣性均高于池B,而其他時間池A與池B養殖水體的細菌豐度和多樣性無顯著變化(表1)。
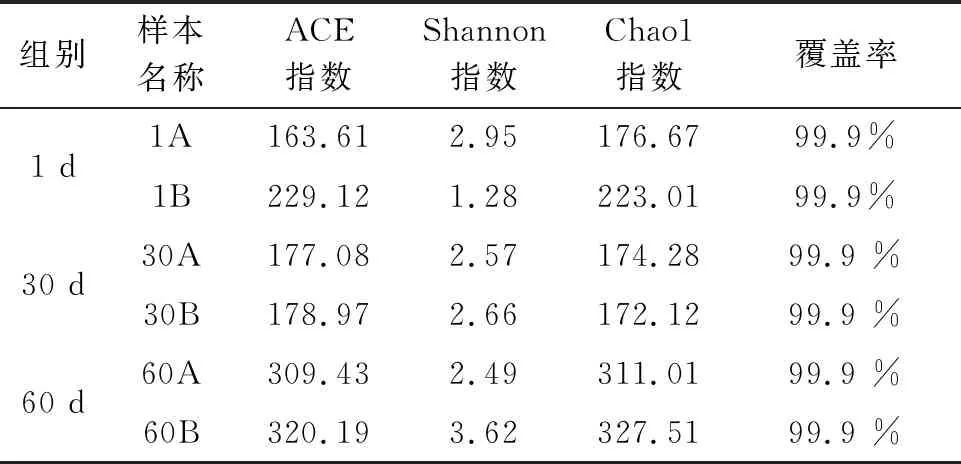
表1 樣品的細菌群落多樣性
2.3.3 循環水養殖系統水體細菌群落相似性分析
對池A和池B養殖水體細菌群落的測序結果進行主成分分析(Principal Component Analysis,PCA)。PC1和PC2解釋了養殖水體中細菌群落 63.10%和 26.85%的信息,兩主成分之和大于89%,較好地代表了樣品中的細菌群落信息。分析結果顯示:除試驗第1天外,池A與池B距離較遠,即表明除試驗第1天外,池A和池B養殖水體的細菌群落組成均存在較大差異(圖5)。
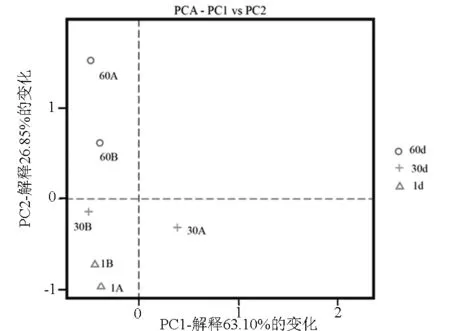
圖5 循環水養殖系統水體細菌主成分分析
3 討論
3.1 微濾機過濾對循環水養殖系統水體弧菌和異養細菌數量的影響
循環水養殖系統水體中細菌數量變動與系統中的有機質、營養鹽狀況密切相關,而養殖水體中營養物質分布并不均勻,微藻、飼料、糞便等固體懸浮物的營養物質往往遠高于周圍水體。營養物質緩慢從固體懸浮物中釋放出來,致使海水中的營養物質分布是作為熱點出現的[20],部分細菌趨向并依附于高營養的區域[21-23]。因此,去除固體懸浮物在大幅降低養殖水體營養物質含量的同時,將附著于固體懸浮物的細菌一并去除,進而導致養殖水體中的細菌總數發生變化。本研究中,以池A與池B養殖水體進行比較,池B弧菌總數均低于池A。同時,除試驗第1天外,池B異養細菌總數亦低于池A。
3.2微濾機過濾對循環水養殖系統水體細菌空間分布的影響
Lauro等[21-23]研究表明水產養殖水體細菌可分為r-策略菌群和k-策略菌群,其中r-策略菌群多數具有較好適應力和較強的運動性,在營養相對貧乏的養殖水體中趨向于營養豐富的固體懸浮物。k-策略菌群多數體積小,能夠最大限度地吸收單位水體的營養,同時由于其代謝可塑性差,無法利用固體懸浮物中組成復雜的營養物質,因而在營養相對貧乏的養殖水體中對固體懸浮物不具有趨向性[21-23]。本試驗對典型r-策略菌群的弧菌屬和k-策略菌群的紅細菌科以FISH技術檢測池A與池B養殖水體細菌空間分布變化,結果顯示,r-策略菌群的弧菌屬對固體懸浮物具有趨向性,而r-策略菌群對固體懸浮物的趨向性可能導致了池A與池B養殖水體細菌空間分布的不同。
3.3 微濾機過濾對循環水養殖系統水體細菌群落結構的影響
在本試驗中,池A和池B養殖水體菌群結構變化明顯,其中池B養殖水體弧菌屬所占細菌總量比例均顯著低于池A;除試驗第30天的紅細菌科所占細菌總量比例存在波動外,其他時間點的池B養殖水體的紅細菌科所占細菌總量比例顯著高于池A。水產養殖中的大多數細菌性疾病是由弧菌屬等機會性病原菌引起的,這些病原菌在海洋環境中無處不在,且多數為r-策略菌群[20,24-25]。Lemire等[26]就曾于2015年報道牡蠣的致病弧菌屬對浮游動物和大顆粒物質具有偏好性。紅細菌科屬于典型k-策略菌群,是海洋生態系統中分布最廣的一類海洋細菌,沿岸地帶和極地分布尤其多[27]。該細菌能夠利用多種基質作為碳源進行混養的光合代謝反應及CO2和氮的固定,在循環水養殖系統的碳、氮循環中具有重要的調節作用[28-29]。本試驗的池B以微濾機過濾了養殖水體中的固體懸浮物,使營養物質分布較均勻,降低了養殖水體菌群中r-策略菌群的弧菌屬組成比例的同時,k-策略菌群的紅細菌科組成比例大幅升高,從而較大限度地降低循環水養殖系統病害爆發的概率[26]。
3.4 微濾機的運行效率
微濾機運行時,大于濾網孔徑的顆粒物被攔截,截留的顆粒物隨時間的推移而增多,進而導致濾膜堵塞,過濾效率降低,即使微濾機頂部設計了反沖洗裝置,但實際應用效果有限[30-31]。本研究在試驗第60天時,池B養殖水體弧菌所占總細菌的比例大幅上升。同時,試驗第30天和第60天的池B養殖水體細菌多樣性無顯著性差異,由此判斷此時微濾機工作已接近飽和。因此,建議微濾機在運行60 d左右時需及時進行濾膜的更換或清洗。未來研究還需要在不同工況下,比較微生物組成差異,從而更科學地對微濾機濾膜的更換時間進行判斷。
4 結論
通過對微濾機過濾前后的細菌種群結構進行系統性分析表明循環水養殖系統中安裝微濾機過濾裝置可以在去除固體懸浮物的同時有效降低潛在病原菌的數量。在養殖第60天時,池A和池B養殖水體弧菌和細菌數量均大幅增長,因此建議微濾機在運行60 d后需及時對濾膜進行更換或清洗。本研究為微濾機的使用方法提供了一定的技術參考。
□

