Koenigs-Knorr糖基化反應的研究進展
田思思
(天津大學 藥物科學與技術學院,天津 300072)
糖,又稱為碳水化合物,廣泛存在于生物體內、各種天然產物和藥物分子中。其中單糖是組成多糖和天然產物中糖組分的最基本單元,通式為Cn(H2O)n。而寡糖與蛋白質、核酸和脂質一起并稱為生命活動過程中的4類重要的生物大分子,在生理過程中起著重要作用。
糖的本質是一類多羥基的醛酮,醛糖的C-1或酮糖的C-2位被稱為糖的端基異構中心,它們是單糖分子中最具活性的部分。在移除活性中心的取代基團后,能夠得到含碳的活性物種(例如陽離子物種,陰離子物種,自由基物種)。活性物種與其他受體結合形成新的C-X鍵,依據環外原子X的不同,可以將其分為氧苷、氮苷、硫苷及碳苷。從合成角度上來說,糖化學本質上是研究糖苷鍵以及糖保護基的化學。
通過對糖結構的分析研究和不斷深入,人們發現糖類藥物在各個治療領域中占據了重要的比重。如抗菌藥物萬古霉素[1];改善高血壓癥狀的葛根素[2]及抗HIV病毒藥物地丹諾辛[3]等都體現了糖類藥物的重要性,因此合成糖類藥物是至關重要的。合成糖類藥物的核心就在于構建糖苷鍵,而糖基化反應在糖苷鍵的構筑中表現出了其獨特的高效性。
1 Koenigs-Knorr糖基化反應簡介
糖基化反應是1879年由Michael首次報道的,幾年后,由Koenigs和Knorr共同改進,發展了Koenigs-Knorr糖基化反應。隨著糖基化反應的進一步探索,人們對其進行了巨大的改進,逐漸形成了一系列糖給體及其活化方法。如鹵代糖給體、三氯乙酰亞胺酯、硫苷給體、亞砜給體、羧酸給體、糖醇給體、糖烯給體等[4]。其中鹵代糖給體制備簡單,合成的構型單一,成為了一類應用非常廣泛的糖給體,最為經典的糖基化反應Koenigs-Knorr糖基化反應就是利用鹵代糖給體來構筑糖苷鍵。
最為經典的Koenigs-Knorr糖基化反應是一種古老而操作簡單的反應,即用鹵代糖和醇在促進劑的作用下反應,生成相應的糖苷化合物。具有如下反應特點:(1)各種鹵代糖的反應活性和穩定性各不相同,氯代糖最穩定,其次是溴代糖,碘代糖最不穩定;(2)鹵代糖的反應活性不僅和自身的性質有關,還與反應溶劑、溫度、催化劑等有關;(3)反應具有很高的非對映立體選擇性;(4)由于鹵代糖的穩定性較差,所以Koenigs-Knorr糖基化反應通常在室溫或低溫條件下進行[5]。隨著Koenigs-Knorr糖基化反應在糖苷合成中的廣泛應用,因此,得到了糖化學家的持續關注。
近年來糖基化反應的進展令人矚目,目前已經有很多關于Koenigs-Knorr糖基化反應的報道,然而傳統的Koenigs-Knorr糖基化反應是氯代糖或溴代糖在重金屬Ag、Hg、Sn等、計量的Lewis酸或相轉移催化劑的催化條件下進行的反應。但這些Koenigs-Knorr糖基化反應往往存在著立體選擇性差、對人體危害較大、對環境嚴苛、底物使用范圍窄等局限性,因此,Koenigs-Knorr糖基化反應成為當今糖化學領域的一個研究熱點。本文對近年來的Koenigs-Knorr糖基化反應的主要研究進展進行了綜述。
2 金屬催化的Koenigs-Knorr糖基化反應
2.1 In催化的Koenigs-Knorr糖基化反應
雖然金屬催化的Koenigs-Knorr糖基化反應已被大量報道,但主要是以重金屬催化劑促進的Koenigs-Knorr糖基化反應,而采用較溫和的金屬催化劑的例子還是比較少見。2017年,Xue等[6]報道了使用催化量的InI3作為催化劑催化2-O-苯甲酰基-3,4,6-三-O-芐基氟代葡萄糖給體生成糖苷化產物的新型糖基化策略。該策略可用于組裝β-連接的功能性糖綴化合物,并且該反應具有廣泛的底物適用性的特點,比如類天然產物醇,氨基酸類醇以及糖醇類等受體,共得到了28例糖苷化產物,產率高達95%(圖1a)。該體系中所使用的催化劑InI3耐水性好、可商業獲得、且體系中不需要添加額外的助催化劑或添加劑。該方法對于氟代葡萄糖的活化具有很重要的意義。特別地,在立體選擇性允許的條件下構建帶有可選擇性除去的2-O-苯甲酰基的部分芐基保護的吡喃葡萄糖苷,其作為糖基受體具有巨大的潛力,可以進一步構建1,2-O-糖苷鍵。
一年后,Xue等[7]又開發了一種有效的糖基化反應策略,該策略是采用催化劑In(NTf)3催化全芐基溴代葡萄糖的Koenigs-Knorr糖基化反應。該反應的特點是反應條件溫和、官能團耐受性好、不需要任何添加劑、以令人滿意的收率和良好的立體選擇性得到各種糖苷(圖1b)。同時使用NMR光譜的機理研究表明,反應是通過形成烷氧基-銦加合物進行的,該烷氧基-銦加合物對于游離醇顯示出較強的以氧為中心的親核性。這種通過促進劑活化受體以此來介導Koenigs-Knorr糖基化反應已成為構筑糖苷鍵的代表性新策略。
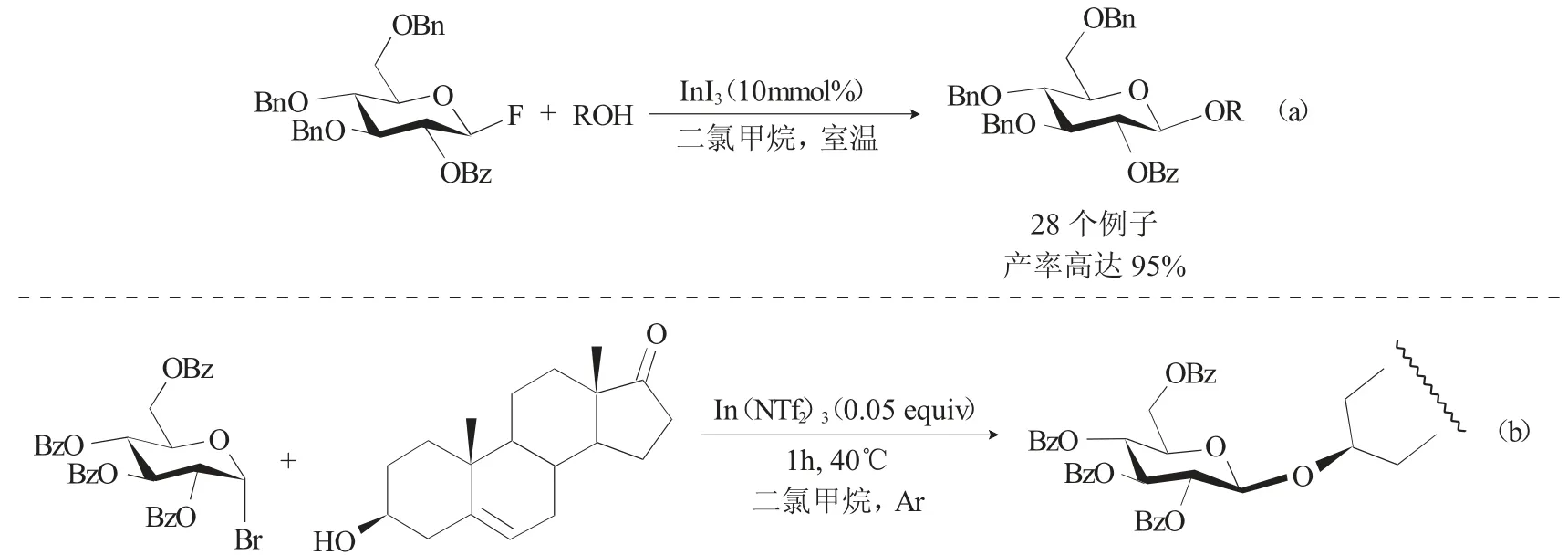
圖1 In催化的Koenigs-Knorr糖基化反應Fig.1 In catalyzed the Koenigs-Knorr glycosylation reaction
2019年,Suh等[8]開發了一種高效的Koenigs-Knorr糖基化反應方法,該方法采用一種溫和、穩定、綠色且易于處理的固體催化劑In(OTf)3(III),可催化活化全芐基氟代糖給體在室溫下就可進行新型糖基化反應。該糖基化過程簡單便捷、不需要預活化、預蒸餾或繁瑣的后處理步驟,且在該反應條件下催化糖基化可兼容各種糖基受體,包括一些酸敏感性醇和電子富集的酚。值得注意的是,在相同條件下也能夠順利合成具有立體選擇性的C-糖苷(圖2b)。這種通用的方法在糖苷的合成中具有一定的突破。Suh等開發的此方法不僅能被用于糖苷的立體選擇性形成,且將廣泛應用于各種糖綴合物的合成中。
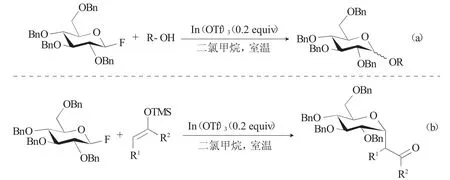
圖2 In(OTf)3催化氟代糖給體的糖基化反應Fig.2 In(OTf)3 catalyzed the glycosylation of glycosyl fluoride
2.2 Fe催化的Koenigs-Knorr糖基化反應
2018年,Demchenko等[9]報道了一種簡單廉價、使用催化量的FeCl3(III)作為催化劑來活化各種氯代糖的糖基化反應。與先前的方法相比,即使在較苛刻且對環境不友好的條件下,該方法也可實現較溫和的活化氯代糖給體,只是糖基化反應的產率不理想。但本文獲得的大多數結果與Ye等[10]和Jacobsen等[11]最近開發的有機催化反應相當。由于體系中未添加任何添加劑或催化劑和助劑,所以與2,3,4,6-四-O-芐基-氯代糖反應得到的糖苷化產物并未取得較好的立體選擇性,但該方法可作為將來完善立體選擇性的基礎(圖3)。此外,該作者還探討FeCl3的作用,認為化學計量的FeCl3的作用可能優先由于糖基化后的異構化反應優先。
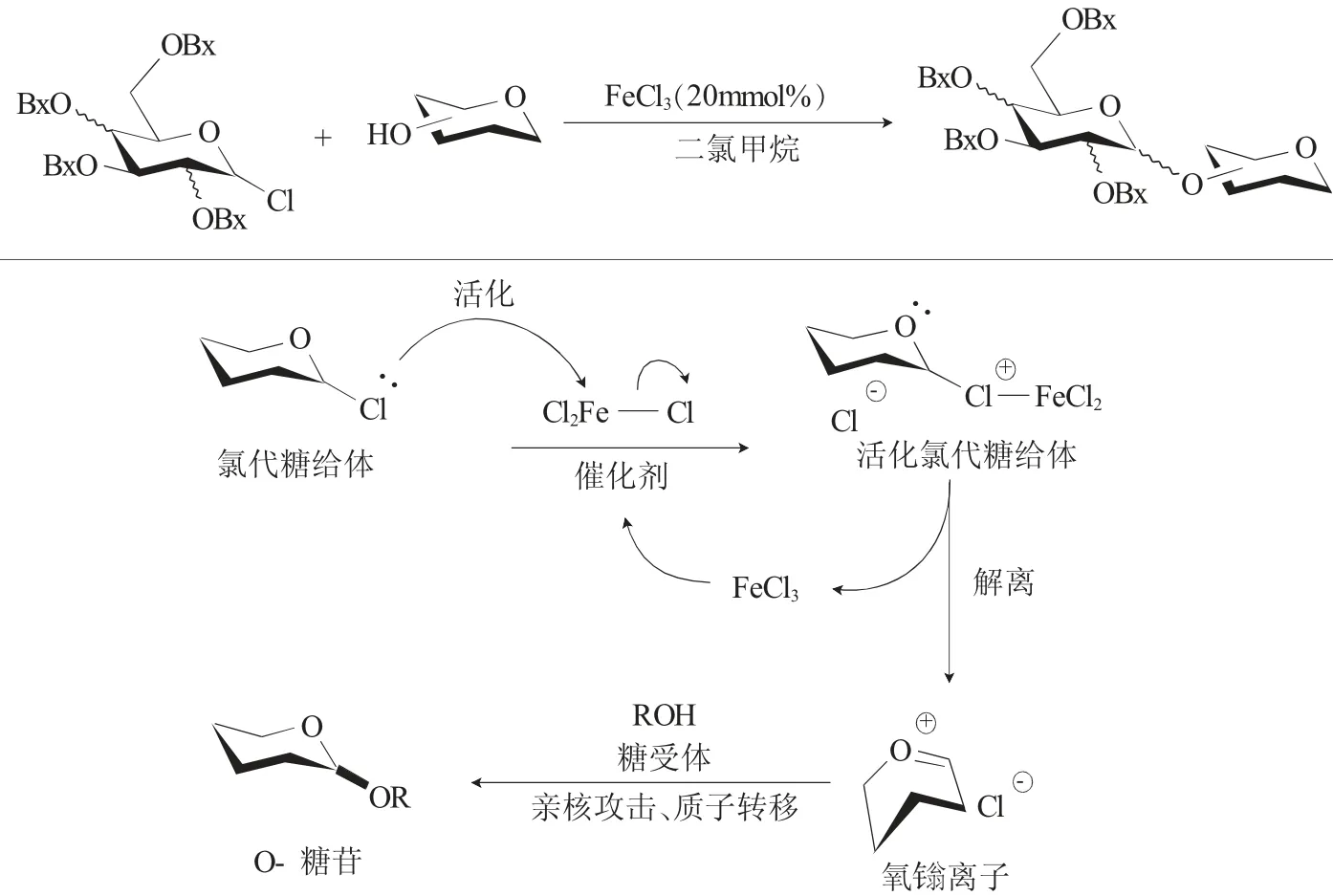
圖3 FeCl3活化氯代糖的糖基化反應Fig.3 FeCl3 activated glycosylation of glycosyl chlorides
3 非金屬催化的Koenigs-Knorr糖基化反應
3.1 脲催化的Koenigs-Knorr糖基化反應
眾所周知,傳統Koenigs-Knorr糖基化反應是在重金屬等的催化條件下進行的反應,其危害較大,因此,發展環境友好型的Koenigs-Knorr糖基化反應在糖化學領域迫在眉睫。2016年,Ye等[10]采用尿素作為催化劑,活化氯代糖與醇進行Koenigs-Knorr糖基化反應,并對其立體選擇性進行了改進。該方法的優異性體現在尿素介導的氫鍵活化相對應的氯代糖或溴代糖進行糖基化反應,在大多數情況下,都可以實現出色的產率和高異頭選擇性。當用2,3,4,6-四-O-芐基-葡萄糖給體時雖然觀察到較低的α-立體選擇性,但可以通過添加TTMPP(三(2,4,6-三甲氧基苯基)膦)使其提高選擇性(圖4a)。與現有的Koenigs-Knorr糖基化[4,12]方法相比,該方法具有立體選擇性和無重金屬催化等優點。
2017年,Jacobsen等[11]報道了大環雙硫脲衍生物在糖基化反應中的應用(圖4b)。該反應采用大環雙硫脲衍生物作為催化劑來催化氯代糖給體,采用SN2機制使其α-氯代糖給體立體構型定向轉變生成相應的β-糖苷化合物。由于糖基化反應中的立體化學選擇性高度依賴于偶聯部分的空間和電子性質,因此碳水化合物的合成不容易被預測。在這里,Jacobsen等發現大環雙硫脲衍生物作為促進劑催化氯代甘露糖給體的立體定向轉化取代途徑。在合成反式1,2-,順式1,2-和2-脫氧-β-糖苷中證明了該催化劑的效用。該反應機制中,親電試劑和親核試劑能夠同時被活化來進行立體定向取代的Koenigs-Knorr糖基化反應。
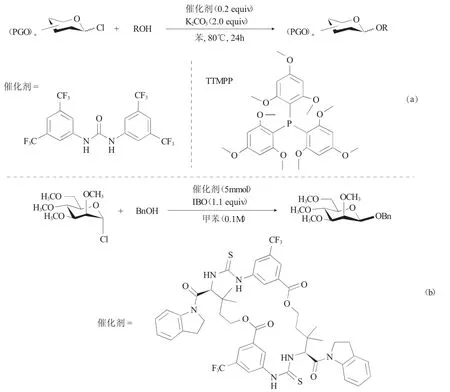
圖4 脲催化Koenigs-Knorr糖基化反應Fig.4 Urea-catalyzed Koenigs-Knorr glycosylation
3.2 TMSOTf參與的Koenigs-Knorr糖基化反應
2018年,Demchenko等[14]發展了3,3-二氟吲哚(HOFox)介導的Koenigs-Knorr糖基化反應。在該反應中3,3-二氟-3H-吲哚-2-基(OFox)的酰亞胺被發現是一個關鍵中間體,原位合成的溴代葡萄糖和OFox酰亞胺化物的活化都可以以再生的方式進行糖基化反應,而且該反應適用于不同糖系列的各種糖苷鍵的合成,在提高糖基化反應的產量的同時還能夠縮短反應時間。對于該類反應,這種再生糖基化反應具有以下3個優點:(1)生成的少量反應型OFox亞氨酸鹽給體有助于最大程度地減少副反應;(2)OFox給體不斷再生,確保使用"新鮮"給體進入循環體系;(3)可以使用穩定的前體,并且詳細監測糖基化反應以確保僅使用必要量的試劑(圖5)。此外,該方法也可用于多步再生合成寡糖,為一些寡糖的合成提供了便利有效的方法。
2019年,Demchenko等[13]報道了一種由非金屬催化劑三甲基甲硅烷基三氟甲磺酸鹽(TMSOTf)催化的快速Koenigs-Knorr糖基化反應。該反應在傳統的Ag(I)氧化促進的溴代糖苷化(Koenigs-Knorr糖基化反應)中添加Lewis酸TMSOTf,可大大加速反應的進行(圖5)。該反應具有反應條件非常溫和,可以保持實用的中性pH值,同時具有高速率和高糖基化產率等優點。另外,該反應還呈現了一系列不同保護的糖基溴化物之間的異常反應趨勢。更特別地是,在該反應條件下,苯甲酰化的α-溴化糖比其芐基化的對應物更具活性。反應性差異通過競爭實驗證明,Demchenko等還研究了Koenigs-Knorr糖基化反應的助催化劑Ag2O與路易斯酸催化劑協同作用的反應機理。在他們的實驗室中,仍然在進一步研究,優化反應條件以應用于其他給體和體系。

圖5 Demchenko發展的糖基化反應Fig.5 The glycosylation developed by Demchenko
3.3 非金屬催化的無揮發性溶劑Koenigs-Knorr糖基化反應
碳水化合物在生物識別過程中起著至關重要的作用。自從Michael和Fischer等為糖基化反應建立基礎以來,已經有許多糖基化方法被發展。但糖綴化合物的復雜性和多樣性(如分支結構、不同的端基構型、可能出現的區域異構體和各種各樣的寡糖)仍然存在。與其他生物聚合物(蛋白質和核酸)相對簡單的序列相關的問題要求使用有效的合成方法并限制自動化方法。2017年,Mathue等[14]發展了在超臨界二氧化碳(scCO2)中無金屬無揮發性溶劑的Koenigs-Knorr糖基化反應(圖6)。超臨界二氧化碳(scCO2)可在不存在揮發性有機溶劑(VOC)的情況下使用鹵代糖作為糖基給體來進行無過渡金屬催化的Koenigs-Knorr糖基化反應。他們發展的此反應條件,可用于在完全綠色反應中獲得糖苷以及原酸酯。該方法對溫度的變化比對壓力的變化更敏感,因為氯代糖需要比溴代糖更高的溫度才能被活化。其中新戊酰基是良好的親CO2單元,其被證明是獲得良好立體選擇性的最佳選擇,此外也證明了流體性質和超臨界條件的相關性。該方法具有避免了揮發性溶劑(VOCs)的使用、無過渡金屬催化劑、溶劑可循環使用等優勢。
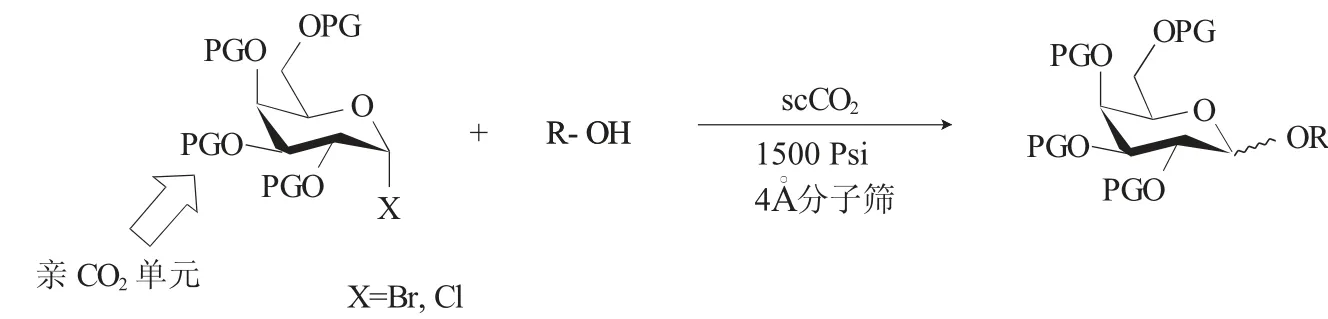
圖6 scCO2中的糖基化反應Fig.6 Glycosylation in scCO2
4 總結與展望
本文綜述了近年涌現的一些Koenigs-Knorr糖基化反應。這些Koenigs-Knorr糖基化反應制備糖苷化合物大多具有立體選擇性好、產率高、反應條件溫和且底物適用范圍廣等優點。但由于Koenigs-Knorr糖基化反應不僅受鹵代糖的反應活性及其自身的性質的影響,還與反應溶劑、溫度、催化劑等有關,這為接下來進一步利用催化量的、環境友好型的催化劑實現Koenigs-Knorr糖基化反應提供了更多可能的機會。

