綿羊子宮內膜上皮細胞和基質細胞的分離與鑒定
凌芳,郝科興,陳慧慧,龍德智,王靜,胡廣東
(石河子大學動物科技學院,新疆 石河子 832000)
胚胎附植是妊娠成功的關鍵步驟,在早期胚胎附植階段,子宮內膜會經歷一系列結構和功能的變化,從而建立最佳的子宮內環境允許胚胎植入[1]。此過程也稱子宮內膜蛻膜化,子宮內膜蛻膜化的實質是子宮內膜上皮細胞和基質細胞的增殖和凋亡過程[2-3]。為了更好地研究這一過程中母體子宮內膜變化的相關機制,需要可靠的細胞模型,而在體外分離培養原代子宮內膜上皮細胞和基質細胞是解決此問題的有效手段。
近年來,子宮內膜上皮細胞和基質細胞體外分離培養方法建立的相關研究在不同動物上均獲得成功,包括人[4]、小鼠[5]、家兔[6]、牛[7]、山羊[8]等,涉及細胞分離培養的方法有組織培養法和酶消化法。然而,在實際操作過程中,利用上述方法分離獲得的細胞均為子宮內膜上皮細胞和基質細胞的混合細胞,難以完全分離純化。因此,本研究采用組織塊培養法獲得原代綿羊子宮內膜上皮細胞和基質細胞,再通過胰酶差時消化法獲得純化的原代細胞,并分別對其進行免疫熒光鑒定,以期建立一種綿羊子宮內膜上皮細胞和基質細胞獲取方法及分離純化方法,為更好地研究綿羊胚胎附植過程提供可靠的細胞模型。
1 材料與方法
1.1 試驗動物
綿羊子宮采自新疆石河子市牛羊定點屠宰場,動物經過嚴格的健康檢疫流程,符合試驗要求。
1.2 試劑
胎牛血清(FBS)、DMEM/F12 培養基、0.25%胰蛋白酶購自Gibco;20×PBS購自上海生工;青-鏈霉素購自HyClone;鼠抗角蛋白18(CK18)單克隆抗體購自Abcam;兔抗波形蛋白抗體購自博士德;DAPI購自碧云天生物技術公司;羅丹明標記山羊抗兔二抗購自中杉金橋;山羊抗鼠綠色熒光二抗購自賽默飛。
1.3 試驗方法
1.3.1 組織塊培養法獲得原代細胞
用含5%雙抗的PBS沖洗從屠宰場采得的綿羊子宮3~5遍,在無菌條件下剪取子宮角后2/3處置于一次性培養皿中,將子宮角縱向切開后展開,露出位于子宮腔面的子宮阜并用眼科剪剪下子宮阜。含5%雙抗的PBS沖洗剪下的子宮阜3~5遍。將子宮阜用鑷子夾入2 mL的EP管中,用剪刀將子宮阜剪碎成1 mm3小塊,加1.5 mL PBS到管中,將組織吹打混勻后1 500 r/min離心5 min,棄PBS,重復3次。
用移液槍吸取500 μL剪碎的組織塊接種于6孔板中,加入2 mL 完全培養基(DMEM/F12、10%FBS、1%雙抗)置于37 ℃、5% CO2中培養箱中培養,以后每隔3 d換1次液。
1.3.2 差時消化法分離純化細胞
原代細胞生長匯合達80%~90%時,移棄培養液,PBS洗2次,向6孔板中每孔加入0.25%胰蛋白酶溶液1 mL,消化90 s,然后將6孔板置于倒置顯微鏡下觀察,待多數基質細胞變圓,脫落成游離細胞時,立即棄胰酶,加入2 mL完全培養基,終止消化。用槍頭輕輕吹打板底部細胞后將細胞懸液移入2 mL EP管,1 500 r/min離心5 min收集基質細胞,加入1 mL PBS吹打洗滌,1 500 r/min離心5 min后收集細胞,再加2 mL完全培養基吹打混勻后接種到另一6孔板中。然后加2 mL完全培養基沖洗2次未脫落的上皮細胞混勻后繼續培養,培養約2 d,期間每隔24 h于倒置顯微鏡下觀察一次細胞形態,若還有梭形成束的基質細胞,則再重復一次胰酶差時消化,重復1~2次即可得到較純的子宮內膜上皮細胞。
1.3.3 免疫熒光法鑒定細胞
將6孔板中培養的細胞消化后計數,以每孔1×104個的密度接種于24孔板中,待細胞貼壁后,用PBS洗滌,然后每孔加500 μL 4%多聚甲醛固定,室溫固定10 min,棄多聚甲醛,用PBS沖洗3次,每次5 min。加200 μL 0.5% TritonX-100通透15 min,PBS 沖洗3次,每次5 min。每孔加200 μL 1% BSA封閉液,室溫下孵育 30 min。棄上清,PBS洗3次,上皮細胞和基質細胞分別滴加鼠抗CK18一抗(1/100稀釋)和兔抗波形蛋白一抗(1/30稀釋),并分別滴加PBS(做陰性對照)覆蓋細胞標本,4 ℃過夜。一抗孵育完成后用 PBS 沖洗3次,每次5 min,滴加與一抗相對應的稀釋后的二抗工作液,37 ℃避光溫育30 min。然后用PBS沖洗3次,每次5 min,5 μg/mL DAPI核染3 min,PBS清洗3次,然后在熒光倒置顯微鏡下觀察,拍照。
2 結果
2.1 組織塊培養獲得原代細胞
顯微鏡下觀察發現,組織塊培養第3天開始有細胞從組織塊爬出(圖1a),5~6 d時單層細胞鋪開,呈梭形細胞和鋪路石狀,2種細胞交織在一起(圖1b)。7~8 d時細胞長至90%,適合傳代(圖1c),若不傳代,細胞會重疊生長導致部分細胞空泡化從而死亡懸浮。
2.2 差時消化分離純化綿羊子宮內膜上皮細胞和基質細胞
組織塊培養法獲得的原代細胞包括呈梭形的基質細胞與鋪路石狀上皮細胞,且表現混合生長態勢,經2~3次0.25%胰蛋白酶差時消化(圖 2a、2b),獲得較純的綿羊子宮內膜上皮細胞和基質細胞(圖 2c、2d)。
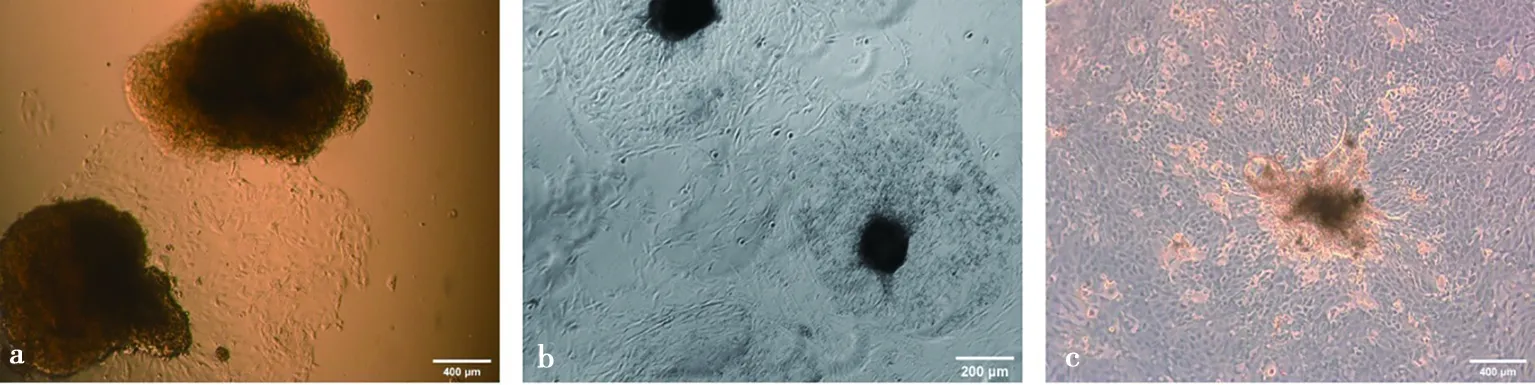
a. 組織塊培養第3天有細胞爬出;b. 第6天組織塊間上皮細胞和基質細胞交匯生長;c. 第8天細胞長滿培養板開始出現細胞空泡化
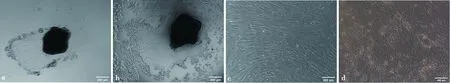
a,b. 胰蛋白酶消化中,細胞變圓脫落過程;c. 純化后得到的基質細胞;d. 2~3次差時消化得到的上皮細胞
2.3 免疫熒光鑒定
免疫熒光結果顯示,綿羊子宮內膜上皮細胞呈角蛋白染色陽性(圖3a、3b、3c),波形蛋白染色陰性(圖3d、3e、3f),陽性率大于95%;陽性細胞胞質染為綠色熒光,核藍染,陰性對照細胞不著色。基質細胞呈波形蛋白染色陽性(圖4a、4b、4c),角蛋白染色陰性(圖4d、4e、4f),陽性率大于95%;陽性細胞胞質染為紅色熒光,核藍染,陰性對照細胞不著色。
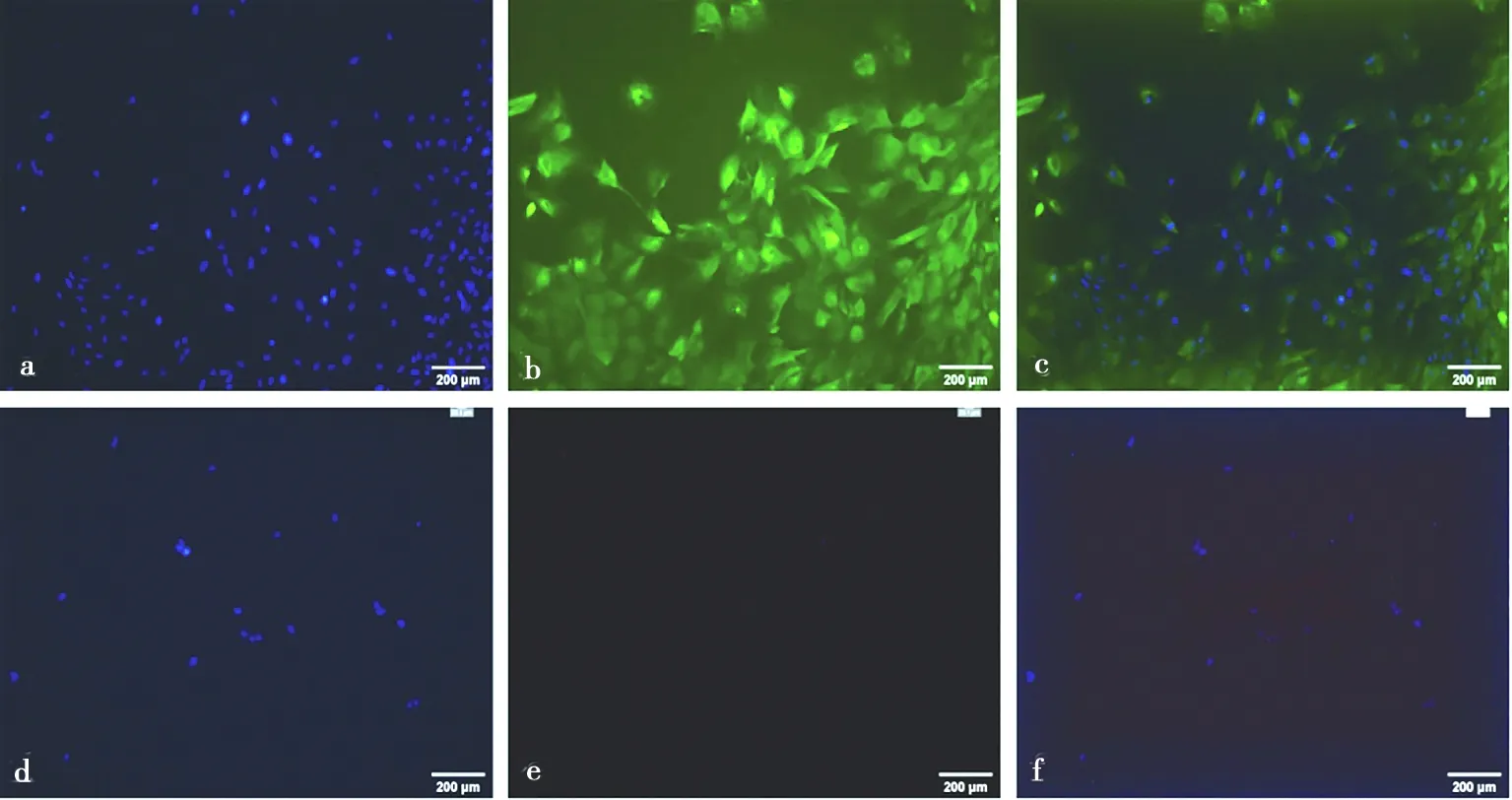
a.上皮細胞核染;b. 上皮細胞角蛋白鑒定;c. 上皮細胞核染和角蛋白合成圖;d. 上皮細胞核染;e.上皮細胞波形蛋白對照;f. 上皮細胞核染和波形蛋白對照合成圖
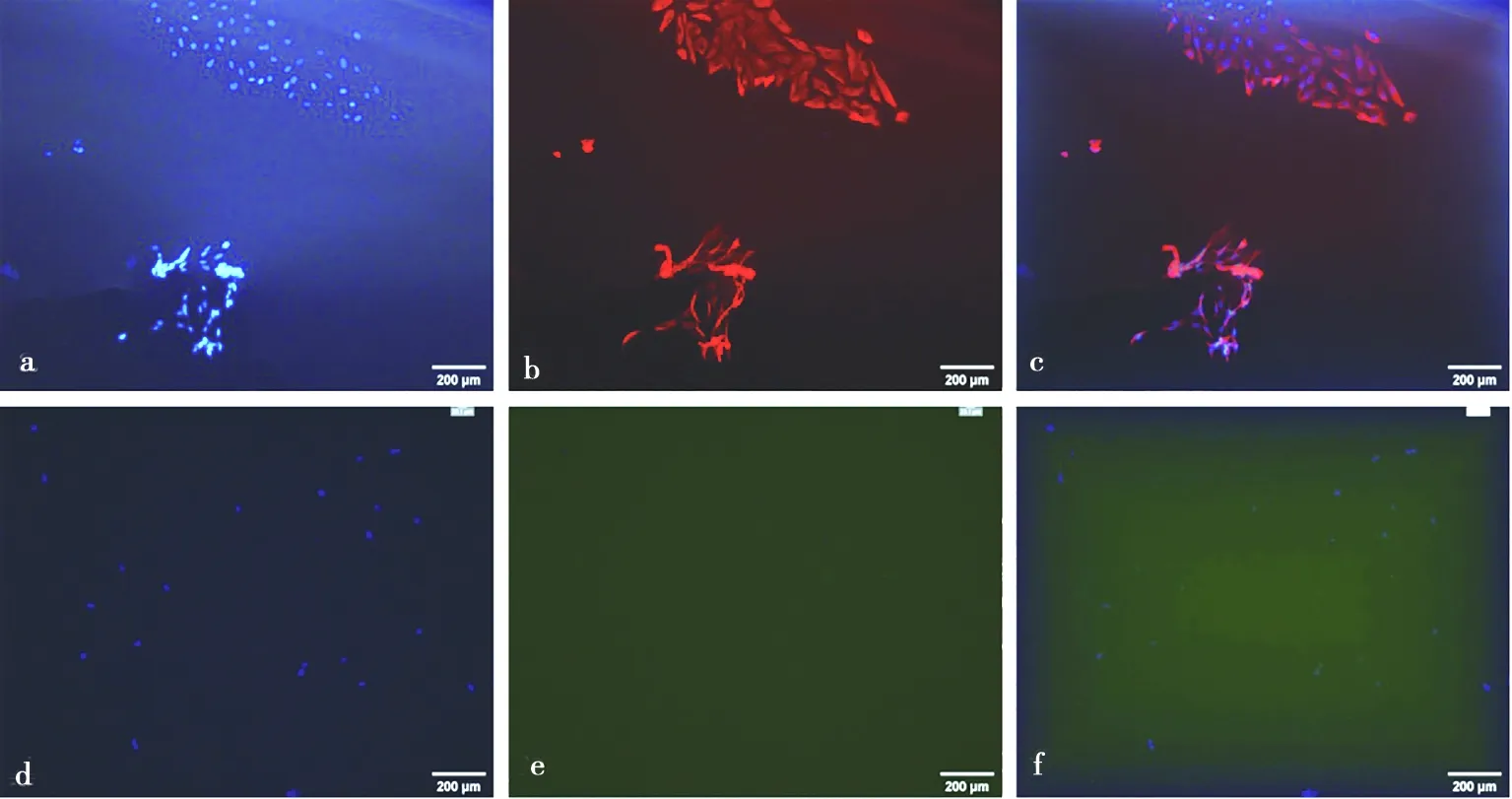
a.基質細胞核染;b. 基質細胞波形蛋白鑒定;c. 基質細胞核染和波形蛋白合成圖;d. 基質細胞核染;e. 基質細胞角蛋白對照;f. 基質細胞核染和角蛋白對照合成圖
3 討論
子宮內膜上皮細胞和基質細胞是在體外研究胚胎附植所必需的細胞模型,分離和純化生物功能完整的原代細胞是開展相關研究的前提條件。本研究利用組織塊培養法結合胰酶差時消化法成功獲得了純度較高的綿羊子宮內膜上皮細胞和基質細胞。
常用的原代子宮內膜細胞分離培養的方法包括組織塊培養法和酶消化法,不同動物子宮內膜組織存在差異,為分離活性較高的原代細胞,需對細胞分離培養方法進行優化[9-14]。有研究發現膠原酶消化作用溫和,但由于消化時間過長且膠原酶價格昂貴[15-16],導致其使用成本較高。與膠原酶消化法相比,組織塊培養法操作簡便,細胞分離效率較高,成本較低,是原代細胞分離培養的首選方式。常用的組織塊培養法在操作過程中以手術鑷子和剪刀剝離子宮外層和脂肪,獲得薄膜狀子宮內膜功能層,然后取子宮角,縱向剪開后去除外層脂肪、肌肉等組織,取最內層半透明狀膜上皮分離細胞[17-18],此過程較為繁瑣,不易推廣。因此,本研究對原有程序進行優化,選擇將子宮角縱向剪開后剪下子宮阜,再將子宮阜剪碎后分離細胞,獲得大量活性較好的綿羊子宮內膜上皮細胞和基質細胞。
為研究子宮內膜上皮細胞和基質細胞在胚胎附植過程中的不同作用,需對2種細胞分別進行純化。常用純化方法包括篩網過濾及貼壁純化法、差時消化法和差速貼壁法。有研究采用細胞過濾網的方式成功得到純化的上皮細胞和基質細胞[19],但此方法操作過程中,由于消化液黏性大而使過篩網過度損耗導致細胞純化率不高,且易發生細胞污染。因此,本研究根據上皮細胞和基質細胞對胰蛋白酶的耐受程度不同[20],而采用胰酶差時消化法對細胞進行純化。奶牛子宮內膜細胞純化過程中,胰酶消化1 min時基質細胞開始變圓,10 min后全部脫落,此時上皮細胞開始變圓[21]。而本研究發現,胰酶消化時,綿羊子宮內膜基質細胞約90 s開始變圓,2 min后全部脫落,而上皮細胞則需要6 min開始變圓,這可能是由于動物品種不同造成的差異。純化的子宮內膜上皮細胞和基質細胞,分別利用2種細胞特異性表達蛋白角蛋白18和波形蛋白抗體進行免疫熒光鑒定,結果呈陽性,且純度在95%以上,表明利用胰酶差時消化法可有效獲得純度較高的綿羊子宮內膜上皮細胞和基質細胞。
綜上,本研究成功分離并純化了綿羊子宮內膜上皮細胞和基質細胞,為綿羊早期胚胎附植機理的研究提供了體外細胞模型。

