羽扇豆醇抗腫瘤作用研究進展
韋燕飛,金麗杰,劉莎莎,陳婉君,成 桃,劉 紅,劉 歡
(廣西中醫藥大學 1.基礎醫學院,廣西 南寧 530200;2.第一附屬醫院,廣西 南寧 530024)
隨著人口的增長和老齡化以及社會經濟的發展,全球癌癥發病率和死亡率快速增長,腫瘤已成為威脅人類健康的主要因素。天然產物是抗腫瘤藥物的重要來源,在人類防治腫瘤及其他疾病中起到十分重要的作用。目前化療藥物是臨床治療惡性腫瘤重要手段之一,然而由于耐藥性、細胞毒性等方面的影響,患者容易出現副作用和預后不良等情況。那么尋找高效、低毒,甚至是對腫瘤細胞具有靶向作用的新型抗腫瘤藥物便成為當前研究的熱點。
1 羽扇豆醇簡介
羽扇豆醇(lupeol)是一種存在于橄欖、芒果、榆木、蘆薈等多種食源性植物和羽扇豆、鵝不食草、星刺衛矛、鹿藿等中草藥中的三萜烯,其化學式為C30H50O,結構式如Fig 1所示。近年來的研究結果顯示,羽扇豆醇具有抗炎、抗腫瘤、抗氧化、促進傷口愈合等作用,并對關節炎、糖尿病、心臟病、腎毒性損傷和肝毒性損傷具有一定的療效。在抗腫瘤方面,許多研究結果表明羽扇豆醇可抑制肝癌、肺癌、結腸癌、前列腺癌、骨肉瘤、胰腺癌、胃癌、黑色素瘤等惡性腫瘤,其藥理學活性主要體現在抑制腫瘤細胞增殖、誘導腫瘤細胞凋亡、誘導細胞周期阻滯、抑制腫瘤細胞遷移及侵襲、誘導腫瘤細胞分化、抑制腫瘤血管生成等方面。本文通過搜集近年來國內外有關羽扇豆醇抗腫瘤的體內外基礎研究,對羽扇豆醇的抗腫瘤作用及其分子機制作一綜述,為羽扇豆醇的抗腫瘤藥理作用及其機制的進一步研究和臨床應用開發提供一定的理論參考。
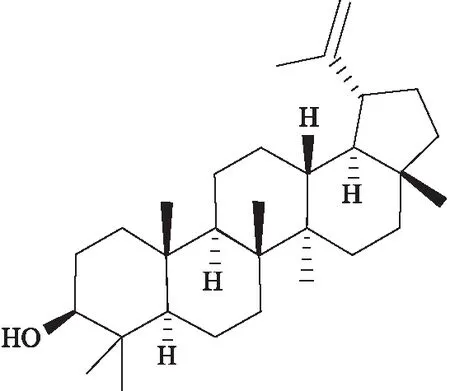
Fig 1 The chemical formula of lupeol
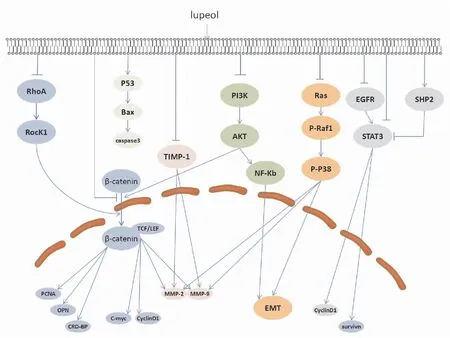
Fig 2 Schematic presentation of mechanisms for anticancer activities of lupeol
2 抗腫瘤作用
2.1 抑制腫瘤細胞增殖腫瘤細胞的增殖能力體現了其惡性程度,尋找一種能夠抑制其細胞增殖的藥物對于治療癌癥是首要任務。已有的研究指出,羽扇豆醇可通過Ras同源基因家族A(Ras homolog gene family member A,RhoA)-Rho激酶1(Rho associated kinases1,ROCK1)、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、Wnt/β-連環蛋白(β-catenin)等多個信號通路抑制腫瘤細胞增殖。羽扇豆醇通過下調結腸癌細胞HCT116、SW620內RhoA、ROCK1及β-catenin蛋白表達水平,使得RhoA-ROCK1-β-Catenin信號通路蛋白受到抑制,進而抑制結腸癌細胞的增殖[1]。研究發現羽扇豆醇對人乳腺癌MCF-7細胞的增殖具有顯著的抑制作用,其機制可能與提高細胞外調節蛋白激酶1/2(exracellular regulated protein kinases 1 and 2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38等MAPK信號通路相關調控蛋白的磷酸化水平有關[2]。羽扇豆醇作用于黑色素瘤細胞Mel 928、Mel1241之后,細胞內β-catenin的轉錄活性及核轉位受到抑制,且Wnt信號通路的靶基因c-Myc、細胞周期蛋白D1(Cyclin D1)顯著下調[3]。
2.2 誘導腫瘤細胞凋亡細胞凋亡是由一系列凋亡相關基因嚴密控制,為應對衰老、損傷等情況而做出的程序性死亡過程。而腫瘤細胞往往可以避免這種程序性死亡過程,因而獲得無限增殖能力。近幾十年來,通過誘導細胞凋亡以有效消除體內腫瘤細胞一直是癌癥治療的熱點之一。細胞凋亡的啟動可通過內源的線粒體途徑和外源的死亡受體途徑進行,細胞凋亡信號通路與其他信號通路的相互作用也可以誘導細胞凋亡。大量研究顯示,羽扇豆醇可以顯著誘導多種類型腫瘤細胞的凋亡,且對正常細胞無明顯毒副作用,具有很大的臨床應用潛力。目前已發現多個信號通路參與羽扇豆醇誘導腫瘤細胞凋亡過程:(1)p53內源性途徑:羽扇豆醇可以上調p53表達,進而誘導Bax蛋白表達和激活caspase-3,引起頭頸癌細胞凋亡[4]。(2)信號轉導與轉錄激活因子3(signal transducers and activators of transcription, STAT3)途徑:Min等利用分子對接分析發現,羽扇豆醇可直接結合表皮生長因子受體(epidermal growth factor receptor,EGFR)的酪氨酸激酶活性域;隨后抑制EGFR及其下游效應分子STAT3的磷酸化,導致STAT3靶基因凋亡抑制蛋白(survivin)及細胞周期蛋白Cyclin D1轉錄水平下降,進而誘導非小細胞肺癌(non-small cell lung cancer,NSCLC)細胞凋亡[5]。在肝癌的研究中發現,羽扇豆醇也可通過抑制STAT3的磷酸化及核轉位,進而誘導細胞凋亡。然而不同于直接結合作用,羽扇豆醇對STAT3活性的抑制作用是通過上調肝癌細胞內磷酸酶SHP-2的表達而實現的[6],提示羽扇豆醇對腫瘤細胞STAT3的活性具有多種作用方式。(3)Wnt/β-catenin信號通路:在經典的Wnt/β-catenin信號通路中,β-catenin是控制Wnt信號通路開關的中心分子,該蛋白的生物學作用與磷酸化修飾和核定位密切相關[7]。Tarapore等[8]研究指出羽扇豆醇抑制結腸癌細胞增殖、誘導細胞凋亡的作用主要源于對Wnt/β-catenin信號通路的抑制作用。在前列腺癌細胞、黑色素瘤細胞等研究中也發現,羽扇豆醇對腫瘤細胞內β-catenin的磷酸化及核定位具有抑制作用[3, 9]。鑒于羽扇豆醇對于β-catenin活性的顯著抑制作用及Wnt/β-catenin信號通路在腫瘤細胞增殖、分化和凋亡過程的重要功能,提示該通路可能是羽扇豆醇重要的作用靶點之一。(4)MAPK信號通路:羽扇豆醇處理肝癌細胞后,Bcl-2表達下降,Bax、caspase-3、8、9等蛋白表達上調;與此同時,細胞內p38和JNK2蛋白磷酸化水平升高,提示MAPK信號通路參與了該過程[10]。(5)死亡受體途徑:細胞FLICE樣抑制蛋白(cellular FLICE-like inhibitory protein,cFLIP)是一種凋亡抑制蛋白,它的過表達會抑制細胞凋亡,并且使細胞對腫瘤壞死因子相關凋亡誘導配體(TNF-related apoptosis-inducing ligand,TRAIL)產生耐受性。Murtaza等[11]研究指出,羽扇豆醇通過下調cFLIP以提高胰腺癌細胞對TRAIL的敏感性,促進細胞凋亡。
2.3 調控腫瘤細胞周期細胞周期是由細胞周期相關蛋白(Cyclins)、細胞周期依賴性激酶(cyclin-dependent kinases,CDKs)以及部分抑制因子(Ink4、Cip、Kip)等嚴密調控的生理學過程。然而由于基因突變或者表觀遺傳學變異,腫瘤細胞的細胞周期通常處于失控狀態,從而滿足無限增殖的需求。羽扇豆醇可引起多種腫瘤細胞內周期相關蛋白表達變化,進而導致細胞周期阻滯和凋亡。羽扇豆醇可將宮頸癌HeLa細胞周期阻滯于S期,細胞內S期調控蛋白Cyclin E、Cyclin A、CDK2表達下調,以及CDK抑制因子p21表達上調[12]。在頭頸癌的研究中指出,羽扇豆醇可誘導G1期細胞周期阻滯,可能是通過上調細胞內多重腫瘤抑制基因CDKN2A,進而抑制CyclinD1的表達而實現的[4]。與之類似,羽扇豆醇同樣可導致黑色素瘤細胞G1期周期阻滯和CyclinD1、CyclinD2蛋白、CDK2表達下調[13]。由此可知,對于不同的腫瘤細胞,羽扇豆醇均發揮一定的細胞周期阻滯作用,然而具體阻滯的周期不盡相同。
2.4 抑制腫瘤細胞遷移、侵襲腫瘤的轉移是腫瘤治療失敗的主要原因,也是導致癌癥患者死亡的主要因素。王明等[14]發現羽扇豆醇在體外能夠有效地抑制人乳腺癌 MDAMB-231細胞侵襲和轉移,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/核轉錄因子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)信號通路可能是羽扇豆醇抑制乳腺癌侵襲、轉移的作用途徑。劉博佳等[15]通過體內體外實驗證實羽扇豆醇可抑制肝癌細胞的遷移、侵襲作用,誘導上皮-間質轉化(epithelial-mesenchymal transition,EMT)相關蛋白上皮型鈣黏蛋白素(E-cadherin)表達,而神經型鈣黏附素(N-cadherin)、血管平滑肌肌動蛋白(α-SMA)、波形蛋白(vimentin)和金屬基質蛋白9(matrix metalloproteinase 9,MMP-9)表達下降,提示羽扇豆醇抑制肝癌細胞侵襲轉移可能是通過調控EMT進行的。另外一項研究中,羽扇豆醇可通過P38 MAPK和PI3K/AKT信號通路調控EMT抑制人骨肉瘤細胞的侵襲轉移[16]。近期研究發現,羽扇豆醇和微小RNA-145-5p(miR-145-5p)均可抑制前列腺癌細胞的增殖,遷移和侵襲,并且羽扇豆醇可以增強miR-145-5p誘導前列腺癌細胞凋亡的作用,提示羽扇豆醇可與microRNA聯合發揮作用[17]。
2.5 誘導腫瘤細胞分化腫瘤的惡性程度與其分化程度有關,羽扇豆醇可以通過誘導腫瘤細胞分化,達到抗腫瘤作用。黑色素分泌及樹突狀形態改變是黑色素瘤細胞的分化標志,Hata等[18-19]的研究中,羽扇豆醇作用于黑色素瘤細胞,使其形態上產生樹突狀改變,并且通過激活MAPK信號通路誘導黑色素的分泌。當黑色素細胞受到紫外線照射等刺激作用時,黑素小體被運輸到樹突的頂端,并分泌到周圍的角質形成細胞中,保護其免受紫外線引起的損傷,在此過程需要黑素小體運輸蛋白(肌動蛋白-va、Slac2-a、Rab27a等)的參與。Ogiwara等[20]又進一步研究了羽扇豆醇對黑素小體運輸蛋白的影響,結果顯示羽扇豆醇顯著提高肌動蛋白-va和Rab27a的表達。
2.6 提高免疫細胞的腫瘤殺傷活性腫瘤細胞對于機體本身屬于有害異物,機體自身所具備的的免疫細胞可以防御殺傷腫瘤細胞。研究表明,羽扇豆醇可以通過提高機體的免疫作用發揮抗腫瘤作用。γδT細胞以MHC非限制性方式殺傷癌細胞,具有抗腫瘤和抗感染作用,是人體固有免疫系統的重要組成部分。羅冠琴等[21]研究發現,羽扇豆醇可以明顯抑制胰腺癌細胞的生長,并且有望通過促進γδT細胞增殖來非特異性免疫殺傷胰腺癌細胞。在常規細胞因子誘導的殺傷細胞(cytokine-induced killer,CIK)培養基中加入細胞因子,將細胞因子刺激后得到的T細胞稱為共刺激細胞。畢亭亭等[22]的研究中,一定濃度下的羽扇豆醇可以促進共刺激細胞的增殖,并且可以提高共刺激細胞對結腸癌細胞的殺傷活性。羽扇豆醇可以抑制結腸癌細胞增殖,經過羽扇豆醇處理后的結腸癌細胞對共刺激細胞的敏感性也有顯著提高。自然殺傷細胞(natural killer cell,NK細胞)是一種先天免疫細胞,它們具有廣泛的免疫功能,參與適應性免疫反應,是抗腫瘤的關鍵因素[23]。Wu等[24]的研究中,羽扇豆醇通過提高NK細胞對胃癌細胞的殺傷作用來抑制癌細胞增殖。由此可見,羽扇豆醇通過不同方式提高免疫細胞腫瘤殺傷活性,利用羽扇豆醇與免疫治療相結合的方法可能會產生協同作用,為抗腫瘤治療提供新的思路。
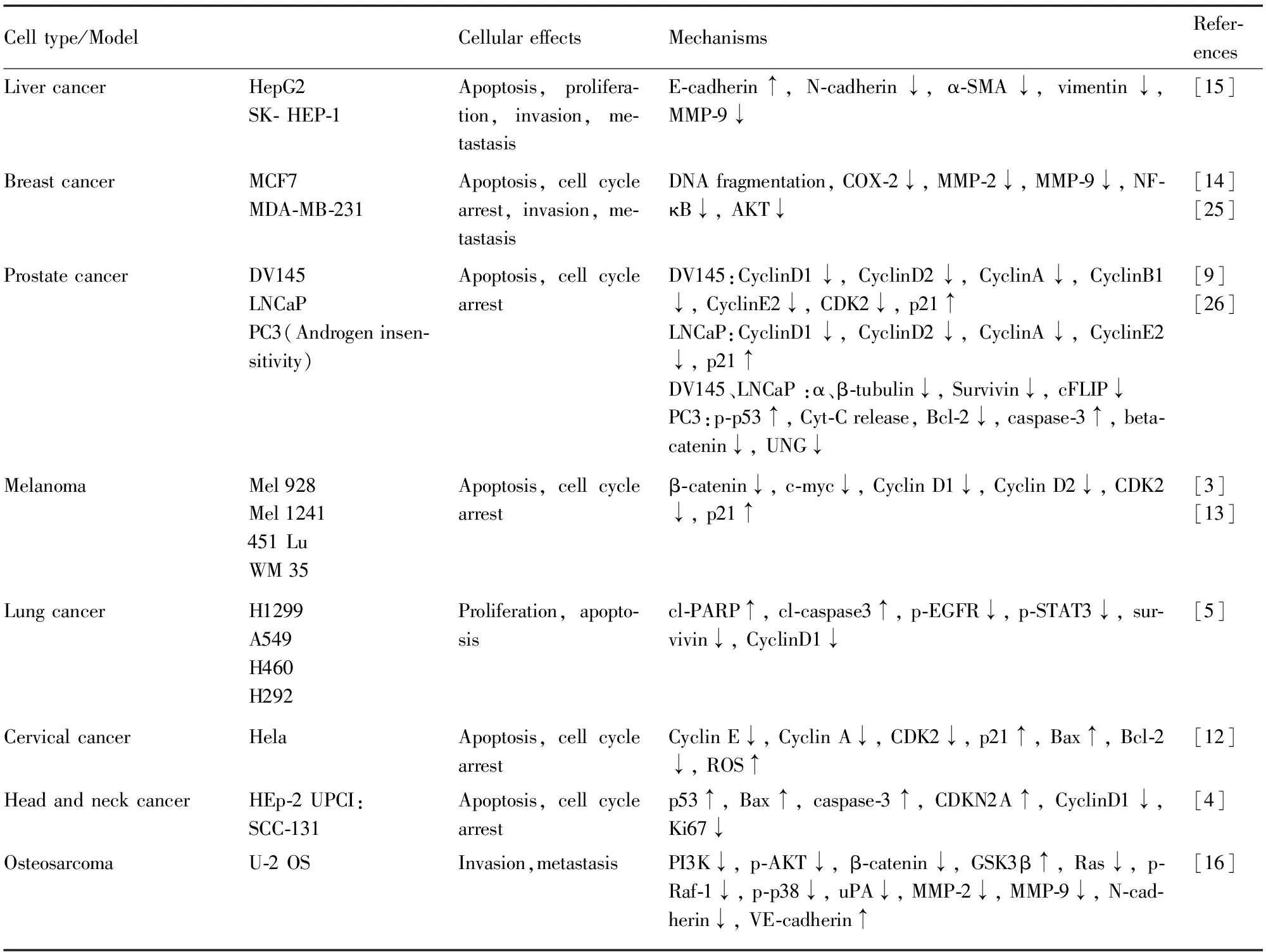
Tab 1 Anticancer effects and mechanisms of lupeol in vitro
3 其他作用
3.1 抗炎作用Beserra等[27-28]的研究中發現羽扇豆醇在促進大鼠傷口愈合的同時具有抗炎作用,并顯著增加了促血管生成和再上皮化的標志物。同時對高血糖大鼠的傷口愈合具有類似作用,抑制炎癥介質和生長因子的產生與活性。Ahmad等[29]的體內實驗中,羽扇豆醇對胸腔積液中白細胞介素-2(interleukin-2,IL-2)、IFN-γ和TNF-α均有劑量依賴性抑制作用,其中以100 mg·kg-1劑量作用最明顯。對IL-4、IL-5水平無明顯抑制作用。
3.2 抗氧化應激作用Prasad等[30]表明,羽扇豆醇對雄激素誘導的氧化應激具有保護作用。口服羽扇豆醇和芒果果肉提取物給注射睪酮的瑞士白化小鼠,可以抑制睪酮誘導的小鼠前列腺活性氧水平的增加,耗盡過氧化氫酶和超氧化物歧化酶等抗氧化酶,并增加小鼠前列腺的脂質過氧化。
4 總結與展望
羽扇豆醇作為一種來源于中草藥及食源性植物中的單體化合物,具有抗炎、抗氧化應激等作用,并且可以通過多種信號轉導途徑誘導癌細胞凋亡,抑制其增殖,侵襲,轉移,血管生成,發揮抗腫瘤作用。Min等[5]用羽扇豆醇處理NSCLC細胞和WI38人肺成纖維細胞,發現成纖維細胞的活力高于腫瘤細胞,提示羽扇豆醇對正常細胞安全無毒或毒性較低。長期慢性炎癥是腫瘤發生的原因之一,羽扇豆醇具有很強的抗炎作用,將抗炎與抗腫瘤研究結合在一起,使羽扇豆醇有望成為強效、安全、無毒、副作用低的抗癌藥。然而目前的研究多集中在體外實驗,細胞株單一,無法模擬腫瘤患者實際病理狀態,因此開展相應的體內實驗以及臨床試驗將有力的促進羽扇豆醇的抗腫瘤作用的研究。

