龍鱉膠囊含藥血清對YAP抑制劑誘導(dǎo)人軟骨細胞凋亡的保護作用及機制研究
梁桂洪 黃和濤 潘建科 曾令烽 楊偉毅 羅明輝 楊園 陳紅云 韓燕鴻 趙金龍 劉軍


摘 要 目的:探索龍鱉膠囊含藥血清(后文簡寫為“LBJN”)對Yes結(jié)構(gòu)結(jié)合蛋白(YAP)抑制劑維替泊芬(verteporfin)誘導(dǎo)軟骨細胞凋亡的保護作用及機制。方法:通過兩步酶消化法提取原代人膝骨性關(guān)節(jié)炎軟骨細胞,利用甲苯胺藍染色法和Ⅱ型膠原蛋白免疫熒光染色法對細胞進行鑒定。采用流式細胞術(shù)檢測2、5 μmol/L verteporfin單用和分別與5%LBJN聯(lián)用48 h后對細胞凋亡的影響,并設(shè)置溶劑對照[0.1%二甲基亞砜(DMSO)]和5%LBJN對照。采用Western blot法檢測0.1%DMSO(溶劑對照)、2 μmol/L verteporfin、2 μmol/L verteporfin+5%LBJN和0(空白對照)、2.5%LBJN、5%LBJN處理48 h后細胞中凋亡相關(guān)蛋白[YAP、B細胞淋巴瘤2(Bcl-2)、活化胱天蛋白酶3(cleaved-caspase-3)]的表達水平;采用Western blot法檢測0(空白對照)、2.5%、5%LBJN處理48 h后細胞中自噬相關(guān)蛋白[哺乳動物雷帕霉素靶蛋白(mTOR)、Beclin-1、LC3A/B ]的表達水平。結(jié)果:分離出的細胞符合軟骨細胞的特征。與0.1%DMSO比較,2、5 μmol/L verteporfin作用后細胞的凋亡率均顯著升高(P<0.05),且兩個濃度的作用效果相當(dāng)(P>0.05);與單用verteporfin比較,2、5 μmol/L verteporfin與5%LBJN聯(lián)用后細胞的凋亡率均顯著降低(P<0.05)。與0.1%DMSO比較,2 μmol/L verteporfin作用后細胞中YAP、Bcl-2蛋白表達水平均顯著降低(P<0.05),而cleaved-caspase-3蛋白表達水平顯著升高(P<0.05);與2 μmol/L verteporfin比較,2 μmol/L verteporfin+5%LBJN作用后細胞中YAP、Bcl-2蛋白的表達水平均顯著升高(P<0.05),而cleaved-caspase-3蛋白的表達水平顯著降低(P<0.05)。與空白對照比較,2.5%、5%LBJN作用后細胞中YAP、Bcl-2、Beclin-1蛋白的表達水平和LC3A/B-Ⅱ/LC3A/B-Ⅰ比值均顯著升高(P<0.05),而cleaved-caspase-3、mTOR蛋白的表達水平均顯著降低(P<0.05)。結(jié)論:LBJN具有阻斷YAP抑制劑verteporfin誘導(dǎo)的軟骨細胞凋亡的作用,其機制可能與調(diào)節(jié)軟骨細胞中凋亡相關(guān)蛋白的表達和增強軟骨細胞的自噬有關(guān)。
關(guān)鍵詞 龍鱉膠囊;含藥血清;骨性關(guān)節(jié)炎;軟骨細胞;Yes結(jié)構(gòu)結(jié)合蛋白抑制劑;凋亡;自噬
ABSTRACT ? OBJECTIVE: To explore the protective effects of Longbie capsule contained serum (called “LBJN” for short) on the apoptosis of chondrocytes induced by YAP inhibitor verteporfin and its mechanism. METHODS: Primary human knee osteoarthritis(OA) chondrocytes were extracted by two-step enzymatic digestion, and then identified by toluidine blue staining and type Ⅱ collagen immunofluorescence staining. The effects of 2, 5 μmol/L verteporfin alone or combined with 5%LBJN on cell apoptosis were detected by flow cytometry. Solvent control(0.1% DMSO) and 5% LBJN were set. Western blot assay was adopted to detect the expression of apoptosis related proteins (YAP, Bcl-2, cleaved-caspase-3) after treated with 0.1%DMSO (solvent control), 2 μmol/L verteporfin, 2 μmol/L verteporfin+5%LBJN和0(blank control), 2.5% LBJN and 5% LBJN for 48 h. The expression of autophagy related proteins (mTOR, Beclin-1, LC3A/B) after treated with 0(blank control), 2.5%, 5% LBJN for 48 h were detected by Western blot assay. RESULTS: The isolated cells accorded with the characteristics of chondrocytes. Compared with 0.1%DMSO, the apoptosis rates of cells were increased significantly after treated with 2, 5 μmol/L verteporfin (P<0.05), and the effects of the two concentrations were similar (P>0.05). Compared with verteporfin alone, 2, 5 μmol/L verteporfin combined with 5%LBJN could significantly decrease the apoptotic rate of cells (P<0.05). Compared with 0.1%DMSO, the protein expression of YAP and Bcl-2 were decreased significantly after treated with 2 μmol/L verteporfin (P<0.05), while the protein expression of cleaved-caspase-3 were increased significantly(P<0.05). Compared with 2 μmol/L verteporfin, protein expression of YAP and Bcl-2 were increased significantly after treated with 2 μmol/L verteporfin+5%LBJN (P<0.05), while the protein expression of cleaved-caspase-3 were decreased significantly(P<0.05). Compared with blank control, the protein expression of YAP,Bcl-2 and Beclin-1 were increased significantly after treated with 2.5%, 5%LBJN (P<0.05), while protein expression of cleaved-caspase-3 and mTOR were decreased significantly (P<0.05). CONCLUSIONS: LBJN can block the apoptosis of chondrocytes induced by YAP inhibitor verteporfin, and its mechanism may be related to regulating the expression of apoptosis related proteins and enhancing autophagy of chondrocytes.
KEYWORDS ? Longbie capsule; Contained serum; Osteoarthritis; Chondrocytes; YAP inhibitor; Apoptosis; Autophagy
骨性關(guān)節(jié)炎(osteoarthritis,OA)是以關(guān)節(jié)軟骨的破壞性改變?yōu)橹饕±硖卣鞯穆酝诵行约膊1]。軟骨細胞發(fā)生凋亡是導(dǎo)致關(guān)節(jié)軟骨退變的主要因素,因此抑制軟骨細胞凋亡是緩解軟骨退變的有效途徑[2]。Yes結(jié)構(gòu)結(jié)合蛋白(YAP)是Hippo信號通路下游的效應(yīng)因子,同時也是轉(zhuǎn)錄共激活因子,其不僅能參與調(diào)節(jié)細胞的增殖、凋亡、侵襲和遷移等各項生物學(xué)行為,而且還能以不同的方式調(diào)控軟骨細胞的成熟和分化,并能維持軟骨細胞的軟骨表型[3-4]。因此,本課題組擬利用YAP抑制劑維替泊芬(verteporfin)誘導(dǎo)軟骨細胞發(fā)生凋亡,借此探索藥物對軟骨細胞凋亡的影響。
中醫(yī)學(xué)認為,OA的主要病機是腎虛血瘀,因此補腎活血是該病對應(yīng)的治則[5]。本課題組前期通過循證研究證實了補腎活血中藥在治療OA方面具有確切的療效[6]。在補腎活血治則的指導(dǎo)下,本院骨傷科研發(fā)了補腎活血中藥龍鱉膠囊,該方由巴戟天、仙茅等多味中藥組成。方中以巴戟天、仙茅為君藥,溫腎助陽;土鱉蟲、全蝎、蜈蚣、蘄蛇等為臣藥,透骨搜風(fēng)、通絡(luò)止痛;丹參、制川烏等為佐藥,活血化瘀、散寒止痛;黃芪、牛膝為使藥,益氣升陽、補肝腎、強筋骨,引藥下行。諸藥合用,共奏補腎活血之效。該方在臨床上用于治療OA取得了較為滿意的療效[7]。同時,本課題組前期通過動物實驗發(fā)現(xiàn),龍鱉膠囊具有抑制OA炎癥反應(yīng)的作用[8]。然而,該方對軟骨細胞增殖和凋亡等相關(guān)生物學(xué)行為的影響尚不明確,阻礙了其后續(xù)改良和研發(fā)。
中藥復(fù)方含藥血清可模擬藥物在人體內(nèi)的代謝過程,從而準確地反映藥物在體外實驗中的實際情況[9]。因此,本課題組擬利用血清藥理學(xué)方法[10],探索龍鱉膠囊含藥血清(后文簡寫為“LBJN”)對體外OA軟骨細胞凋亡的影響。此外,有研究表明,軟骨細胞自噬失調(diào)是軟骨退行性病變的重要特征之一[11-13],而且通過上調(diào)細胞的自噬水平可抑制軟骨細胞凋亡[14]。因此,本課題組擬同時研究LBJN對OA軟骨細胞自噬水平的影響,為揭示補腎活血中藥龍鱉膠囊防治OA的分子機制提供參考。
1 材料
1.1 主要儀器
TI2-E型熒光倒置顯微鏡購自日本Nikon公司;Novo Quanteon型流式細胞儀購自安捷倫生物(杭州)有限公司;Advantage A10型純水系統(tǒng)購自美國Millipore公司;Forma 型CO2培養(yǎng)箱、A2型生物安全柜均購自美國Thermo Fisher Scientific公司;ChemiDoc Touch型高靈敏度化學(xué)發(fā)光成像分析系統(tǒng)購自美國Bio-Rad公司;M1000 Pro型多功能酶標儀購自瑞士Tecan公司。
1.2 主要藥品與試劑
龍鱉膠囊(批準文號為粵藥制字Z20071030,規(guī)格為每粒0.5 g)由廣東省中醫(yī)院藥劑中心生產(chǎn),成人劑量為每次2 g、每天給藥3次;青-鏈霉素雙抗(批號15140-122)、高糖DMEM培養(yǎng)基(批號C11995500BT)、澳洲胎牛血清(批號10099141)、含乙二胺四乙酸(EDTA)的0.25%胰酶(批號25200072)、0.25%胰酶(批號15050065)、磷酸鹽緩沖液(PBS,pH 7.4)均購自美國Gbico公司;二甲基亞砜(DMSO)、Ⅱ型膠原蛋白酶(批號C6885)均購自美國Sigma公司;YAP抑制劑verteporfin原料藥(批號S1786,純度99.31%)購自美國Selleck公司;甲苯胺藍染色液試劑盒(批號G3663)購自北京索萊寶科技有限公司;二喹啉甲酸(BCA)蛋白質(zhì)定量檢測試劑盒(批號K300)購自上海博彩生物科技有限公司;FITC/Annexin V凋亡檢測試劑盒(批號556547)購自美國BD公司;發(fā)光試劑ECL試劑盒(批號WBKLS0100)購自美國Millipore公司;Western及碘化丙啶(PI)細胞裂解液(批號P0013)、苯甲基磺酰氟(PMSF,批號ST506)、蛋白酶抑制劑混合物(批號P1005)均購自上海碧云天生物技術(shù)有限公司;兔抗人YAP單克隆抗體(批號14074)、兔抗人B細胞淋巴瘤2(Bcl-2)單克隆抗體(批號3498)、兔抗人活化胱天蛋白酶3(cleaved-caspase-3)單克隆抗體(批號9664)、兔抗人哺乳動物雷帕霉素靶蛋白(mTOR)單克隆抗體(批號2983)、兔抗人自噬相關(guān)蛋白Beclin-1單克隆抗體(批號3495)、兔抗人自噬相關(guān)蛋白LC3A/B單克隆抗體(批號12741)、小鼠抗人β-肌動蛋白(β-actin)單克隆抗體(批號3700)、辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白G(IgG)二抗(批號7074)、HRP標記的山羊抗鼠IgG二抗(批號7076)均購自美國CST公司;兔抗人Ⅱ型膠原蛋白(ColⅡ)多克隆抗體(批號ab34712)購自美國Abcam公司;其余試劑均為分析純或?qū)嶒炇页S靡?guī)格,水為超純水。
1.3 動物
SPF級SD大鼠10只,1.5月齡,雌雄各半,體質(zhì)量為(200±10) g,由南方醫(yī)科大學(xué)實驗動物中心提供,實驗動物質(zhì)量合格號44002100025404,實驗動物使用許可證號為SYXK(粵)2018-0094。大鼠購入后于廣東省中醫(yī)藥科學(xué)院實驗動物中心SPF級環(huán)境中飼養(yǎng),飼養(yǎng)期間自由飲水和進食。本研究的動物實驗方案由廣東省中醫(yī)院動物倫理委員會批準后實施。
1.4 人OA關(guān)節(jié)軟骨組織
在獲得于廣東省中醫(yī)院明確診斷為原發(fā)性膝關(guān)節(jié)OA并住院行關(guān)節(jié)置換術(shù)患者的知情同意后,收集其術(shù)后丟棄的關(guān)節(jié)軟骨組織樣本,用以提取原代OA軟骨細胞。本研究臨床組織樣本的獲取過程嚴格遵循《赫爾辛基宣言》以及我國有關(guān)臨床試驗研究法規(guī)、規(guī)范進行,并由廣東省中醫(yī)院醫(yī)學(xué)倫理委員會審核、批準后實施,倫理批件號為BE2019-103。
2 方法
2.1 LBJN的制備
根據(jù)龍鱉膠囊的成人臨床用量,按體表面積法換算得大鼠的使用劑量為0.625 g/kg,于每天9:00和15:00左右根據(jù)大鼠體質(zhì)量分別灌胃給藥(以水為溶劑,灌胃體積為2 mL)1次,連續(xù)灌胃7天。末次灌胃1 h后,在大鼠麻醉狀態(tài)下于腹主動脈采血,將血樣以3 000 r/min離心10 min,收集上清液(即為含藥血清),隨后在56 ℃水浴中孵育、滅活30 min,然后用0.22 μm針頭過濾器過濾除菌。將10只大鼠的血清獨立分裝后放置在-80 ℃冰箱中保存,備用。
2.2 原代人OA軟骨細胞的提取與鑒定
通過兩步酶消化法提取原代人膝關(guān)節(jié)OA軟骨細胞。取患者因膝關(guān)節(jié)置換手術(shù)而丟棄的關(guān)節(jié)軟骨組織,置于50 mL離心管中(含1%青-鏈霉素雙抗的PBS),將軟骨組織剪成大小約0.5 cm×0.5 cm的碎片,加入適量0.25%胰酶,在37 ℃搖床上以180 r/min振蕩30 min;隨后,將軟骨組織剪成大小約0.1 cm×0.1 cm的小碎片,加入0.2%Ⅱ型膠原蛋白酶,繼續(xù)在37 ℃搖床上以180 r/min振蕩4 h。結(jié)束后,將細胞懸液過200目篩網(wǎng),然后以1 500 r/min離心5 min,棄去上清液;細胞沉淀以PBS重懸后,以1 500 r/min 離心5 min,棄去上清液;用含1%青-鏈霉素雙抗和10%胎牛血清的高糖DMEM培養(yǎng)基重懸細胞,并將其接種于含上述培養(yǎng)基的培養(yǎng)瓶中,常規(guī)培養(yǎng)3天后首次換液,之后按常規(guī)細胞培養(yǎng)方式進行培養(yǎng)和傳代。取第2或第3代細胞,采用甲苯胺藍染色法和ColⅡ免疫熒光染色法對其進行鑒定[15]。
2.3 細胞凋亡檢測
采用流式細胞術(shù)進行檢測。取“2.2”項下對數(shù)生長期的OA軟骨細胞,用含EDTA的0.25%胰酶消化后,制成密度為5×104 ?mL-1的細胞懸液,按每孔2 mL接種到6孔板中,常規(guī)培養(yǎng)24 h。將細胞分為溶劑對照組[0.1%二甲基亞砜(DMSO)]、2 μmol/L verteporfin組(verteporfin以0.1%DMSO溶解,下同)、5 μmol/L verteporfin組、5%LBJN組、2 μmol/L verteporfin+5%LBJN組和5 μmol/L verteporfin+5%LBJN組,每組設(shè)置2個復(fù)孔(各組濃度均根據(jù)前期預(yù)實驗結(jié)果設(shè)置)。各組細胞經(jīng)相應(yīng)試劑或藥物處理48 h后,收集各孔上清液,以3 000 r/mim離心5 min后,棄去上清液;用不含EDTA的0.25%胰酶消化并收集細胞,然后以3 000 r/mim離心5 min,棄去上清液;用PBS重懸細胞,然后以3 000 r/mim離心5 min,棄去上清液;用1×binding buffer100 μL重懸細胞,然后每孔分別加入FITC、PI染料各5 μL,輕輕混勻,常溫下避光孵育15 min。孵育結(jié)束后,用1×binding buffer 400 μL重懸細胞,然后轉(zhuǎn)移至流式管中,上機檢測。實驗重復(fù)3次。
2.4 細胞中凋亡相關(guān)蛋白YAP、Bcl-2、cleaved-caspase-3表達檢測
采用Western blot法進行檢測。取“2.2”項下對數(shù)生長期的OA軟骨細胞,用含EDTA的0.25%胰酶消化后,制成密度為2×105 mL-1的細胞懸液,按每孔2 mL接種到6 cm皿中,常規(guī)培養(yǎng)24 h。將細胞分為溶劑對照組(0.1%DMSO)、2 μmol/L verteporfin組、2 μmol/L verteporfin+5%LBJN組和不同濃度[0(空白對照)、2.5%、5%]LBJN組。各組細胞經(jīng)相應(yīng)試劑或藥物處理48 h后,收集各孔細胞,以5 000 r/mim離心5 min,棄去上清液;沉淀加入適量細胞裂解液(Western及PI細胞裂解液-PMSF-蛋白酶抑制劑混合物=100 ∶ 1 ∶ 1,V/V/V),充分裂解后,以12 000 r/mim離心10 min,收集上清液,采用BCA法測定蛋白濃度。將蛋白高溫變性后,取變性蛋白在60 V電壓下行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳30 min,再調(diào)節(jié)電壓至100 V繼續(xù)電泳1 h,然后在245 mA電流下轉(zhuǎn)膜(聚偏二氟乙烯膜)90 min。以5%脫脂奶粉室溫封閉1 h,分別加入稀釋比例均為1 ∶ 1 000的YAP、Bcl-2、cleaved-caspase-3一抗和稀釋比例為1 ∶ 2 000的β-actin一抗,4 ℃下孵育過夜;以TBST溶液洗膜5 min×3次,加入稀釋比例均為1 ∶ 1 000的相應(yīng)二抗,室溫下孵育1 h;以TBST溶液洗膜5 min×3次,加入ECL顯色,放入化學(xué)發(fā)光成像分析系統(tǒng)中曝光顯影。采用Image J 1.46 r軟件測定蛋白條帶的灰度值,以目標蛋白與內(nèi)參蛋白(β-actin)條帶灰度值的比值表示目標蛋白的表達水平。實驗重復(fù)3次,結(jié)果分別以溶劑或空白對照組為參照進行標準化處理。
2.5 細胞中自噬相關(guān)蛋白mTOR、 Beclin-1和LC3A/B的檢測
采用Western blot法進行檢測。按“2.4”項下方法制備細胞懸液、接種并常規(guī)培養(yǎng)24 h。將細胞分為0(空白對照)、2.5%LBJN、5%LBJN組。各組細胞經(jīng)相應(yīng)試劑或藥物作用48 h后,檢測細胞中mTOR、Beclin-1和LC3A/B蛋白的表達水平。其中,mTOR、Beclin-1、LC3A/B一抗稀釋比例均為1 ∶ 1 000,HRP標記的山羊抗兔IgG二抗的稀釋比例為1 ∶ 1 000,其余條件均同“2.4”項下。實驗重復(fù)3次,結(jié)果以空白對照組為參照進行標準化處理。
2.6 統(tǒng)計學(xué)方法
采用SPSS 20.0軟件對數(shù)據(jù)進行統(tǒng)計分析。計量資料以x±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗。P<0.05表示差異具有統(tǒng)計學(xué)意義。
3 結(jié)果
3.1 人OA軟骨細胞的提取和鑒定結(jié)果
細胞經(jīng)分離后正常貼壁生長,于倒置顯微鏡下觀察到其呈長梭形和多邊形(圖1A)。經(jīng)甲苯胺藍染色后,細胞核呈深藍色,細胞質(zhì)顏色則較淺;細胞界限清楚,呈長梭形或多邊形(圖1B)。經(jīng)免疫熒光染色后,細胞均表現(xiàn)出較強的紅色熒光(圖1C),表明ColⅡ熒光染色為陽性(ColⅡ是構(gòu)成軟骨基質(zhì)的主要成分之一,故可通過檢測其表達情況對軟骨細胞進行鑒定[16])。以上結(jié)果均符合OA軟骨細胞的特征,故鑒定分離出的細胞為OA軟骨細胞。
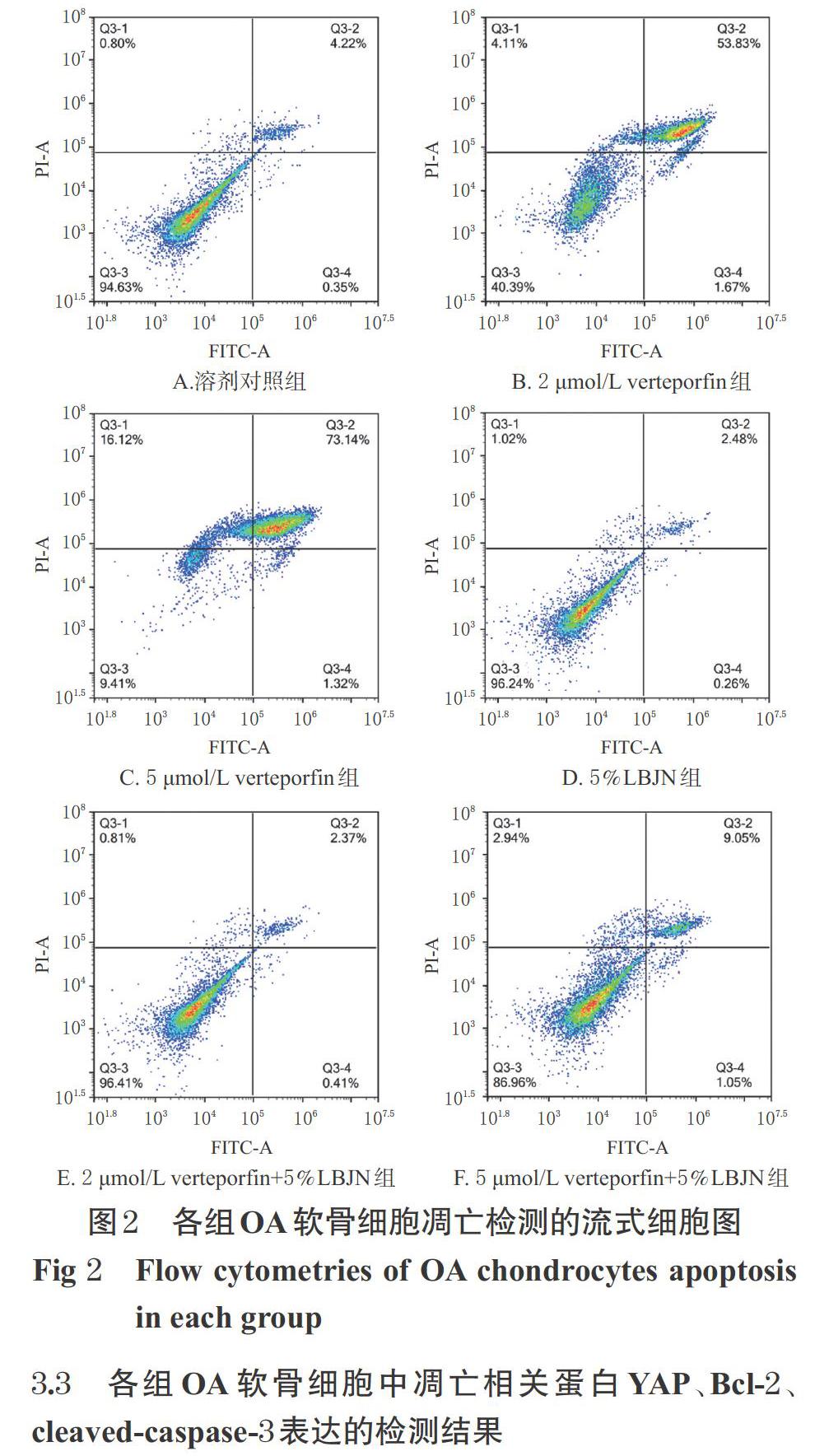
3.2 細胞凋亡的檢測結(jié)果
與溶劑對照組比較,2、5 μmol/L verteporfin組細胞的凋亡率均顯著升高(P<0.05),且2、5 μmol/L verteporfin組細胞凋亡率組間比較差異無統(tǒng)計學(xué)意義(P>0.05)。以上結(jié)果表明,2、5 μmol/L verteporfin均可誘導(dǎo)細胞凋亡,且兩個濃度的作用效果相當(dāng)。與溶劑對照組比較,5%LBJN組細胞凋亡率的差異無統(tǒng)計學(xué)意義(P<0.05),表明正常情況下LBJN對細胞凋亡無影響;與單用verteporfin組比較,對應(yīng)濃度的verteporfin+LBJN聯(lián)用組細胞的凋亡率均顯著降低(P<0.05),表明LBJN具有抑制軟骨細胞凋亡的作用。各組OA軟骨細胞凋亡檢測的流式細胞圖見圖2,凋亡率的檢測結(jié)果見表1。
3.3 各組OA軟骨細胞中凋亡相關(guān)蛋白YAP、Bcl-2、cleaved-caspase-3表達的檢測結(jié)果
與溶劑對照組比較,2 μmol/L verteporfin組細胞中YAP、Bcl-2蛋白的表達水平均顯著降低(P<0.05),而cleaved-caspase-3蛋白的表達水平顯著升高(P<0.05);與2 μmol/L verteporfin組比較,2 μmol/L verteporfin+5%LBJN組細胞中YAP、Bcl-2蛋白的表達水平均顯著升高(P<0.05),而cleaved-caspase-3蛋白的表達水平顯著降低(P<0.05)。與空白對照組比較,2.5%、5%LBJN組細胞中YAP、Bcl-2蛋白的表達水平均顯著升高(P<0.05),而cleaved-caspase-3蛋白的表達水平均顯著降低(P<0.05)。各組細胞中YAP、Bcl-2和cleaved-caspase-3蛋白表達的電泳圖見圖3,表達水平的檢測結(jié)果見表2。
3.4 各組OA軟骨細胞中自噬相關(guān)蛋白mTOR、 Beclin-1和LC3A/B表達的檢測結(jié)果
與空白對照組比較,2.5%、5%LBJN組細胞中mTOR蛋白表達水平均顯著降低(P<0.05),而Beclin-1蛋白表達水平和LC3A/B-Ⅱ/LC3A/B-Ⅰ比值均顯著升高(P<0.05)。各組細胞中mTOR、Beclin-1和LC3A/B蛋白表達的電泳圖見圖4,表達水平的檢測結(jié)果見表3。
4 討論
關(guān)節(jié)軟骨中的細胞外基質(zhì)是維持正常軟骨功能的重要物質(zhì),其由分布在關(guān)節(jié)軟骨中唯一的軟骨細胞分泌而成,而異常的軟骨細胞凋亡是導(dǎo)致軟骨細胞減弱或喪失相關(guān)分泌功能,從而導(dǎo)致關(guān)節(jié)軟骨退變的主要病理因素[17-18]。因此,通過有效的途徑抑制軟骨細胞凋亡將可能成為防治OA的重要手段。相關(guān)研究發(fā)現(xiàn),YAP可調(diào)控軟骨細胞成熟、增殖、分化并維持軟骨表型特征[19],且在OA軟骨組織中YAP的表達下降[3]。因此,本研究利用YAP抑制劑verteporfin構(gòu)建軟骨細胞凋亡模型。通過流式細胞術(shù)檢測后發(fā)現(xiàn),2、5 μmol/L verteporfin均能促進軟骨細胞凋亡;且與單用verteporfin組比較,對應(yīng)濃度的verteporfin+LBJN聯(lián)用組細胞的凋亡率均顯著降低。以上結(jié)果表明,LBJN具有抑制軟骨細胞凋亡的作用。Bcl-2是重要的凋亡抑制因子,其可通過抑制下游caspase-3的激活,有效地抑制細胞凋亡的發(fā)生[20]。caspase-3是細胞凋亡過程中最主要的終末剪切酶,而cleaved-caspase-3是caspase-3的活化形式,在細胞凋亡的發(fā)生過程中cleaved-caspase-3的表達水平會明顯升高[21]。由于2、5 μmol/L verteporfin對軟骨細胞凋亡的影響無明顯差異,因此本研究以2 μmol/L verteporfin為凋亡誘導(dǎo)劑進行了后續(xù)凋亡相關(guān)蛋白表達的檢測實驗。結(jié)果發(fā)現(xiàn),2 μmol/L verteporfin可下調(diào)細胞中Bcl-2蛋白并上調(diào)細胞中cleaved-caspase-3蛋白的表達;而5%LBJN則可上調(diào)細胞中Bcl-2蛋白的表達并下調(diào)cleaved-caspase-3蛋白的表達。這表明LBJN可能是通過調(diào)節(jié)凋亡相關(guān)蛋白的表達而起到抑制OA軟骨細胞凋亡的作用。
細胞自噬是細胞自身通過降解其內(nèi)部受損細胞器和大分子物質(zhì),利用物質(zhì)的循環(huán)和再利用達到維持細胞穩(wěn)態(tài)和正常功能的重要活動形式[22]。近年來有研究表明,軟骨細胞自噬的增強可以抑制其凋亡和衰老,改善軟骨基質(zhì)代謝活性,從而延緩OA的進展[23]。細胞自噬過程受mTOR等基因的調(diào)控,抑制mTOR蛋白表達可誘導(dǎo)細胞自噬[24-25]。Beclin-1和LC3A/B均為自噬標記蛋白,其表達水平的高低可反映細胞自噬的情況。其中,Beclin-1是自噬體形成過程中所必需的重要元件,LC3A/B則是構(gòu)成自噬體的重要結(jié)構(gòu)[26]。當(dāng)自噬形成時,胞漿型LC3A/B(即LC3A/B-Ⅰ)會轉(zhuǎn)變?yōu)樽允审w中的膜型LC3A/B(即LC3A/B-Ⅱ),因此可通過檢測LC3A/B-Ⅱ/LC3A/B-Ⅰ比值的大小來判斷細胞自噬的水平[26]。本研究結(jié)果顯示,LBJN可抑制OA軟骨細胞中mTOR蛋白的表達、上調(diào)細胞中Beclin-1蛋白的表達、升高細胞中LC3A/B-Ⅱ/LC3A/B-Ⅰ比值,從而提高軟骨細胞的自噬水平。
綜上所述,LBJN具有阻斷YAP抑制劑verteporfin致OA軟骨細胞凋亡的作用,其作用機制可能與調(diào)節(jié)細胞中凋亡相關(guān)蛋白 YAP、Bcl-2、cleaved-caspase-3和自噬相關(guān)蛋白mTOR、 Beclin-1、LC3A/B的表達有關(guān)。因細胞凋亡與自噬水平之間調(diào)控關(guān)系復(fù)雜,后續(xù)將深入探索龍鱉膠囊是否可通過調(diào)節(jié)mTOR及其下游相關(guān)信號通路的活性來調(diào)控細胞的自噬水平,進一步闡明該方調(diào)控OA軟骨細胞凋亡的作用靶點和分子機制。
參考文獻
[ 1 ] HE Y,LI Z,ALEXANDER P G,et al. Pathogenesis of osteoarthritis:risk factors,regulatory pathways in chondrocytes,and rxperimental models[J]. Biology(Basel),2020,9(8):194.
[ 2 ] HWANG H S,KIM H A. Chondrocyte apoptosis in the pathogenesis of osteoarthritis[J]. Int J MolSci,2015,16(11):26035-26054.
[ 3 ] DENG Y J,LU J Q,LI W L,et al. Reciprocal inhibition of YAP/TAZ and NF-κB regulates osteoarthritic cartilage degradation[J]. Nature Communications,2018,9(1):4564.
[ 4 ] DELVE E,CO V,REGMI S C,et al. YAP/TAZ regulates the expression of proteoglycan 4 and tenascin C in superficial-zone chondrocytes[J]. Eur Cell Mater,2020,39:48- 64.
[ 5 ] 潘建科,洪坤豪,劉軍,等.基于關(guān)聯(lián)規(guī)則和復(fù)雜系統(tǒng)嫡聚類的膝骨關(guān)節(jié)炎用藥規(guī)律研究[J].中國實驗方劑學(xué)雜志,2015,21(12):229-232.
[ 6 ] 梁桂洪,梁祖建,林勇凱,等.補腎活血中藥對比塞來昔布治療膝骨性關(guān)節(jié)炎療效與安全性的Meta分析[J].中國藥房,2016,27(27):3810-3814.
[ 7 ] 潘建科,楊偉毅,劉軍,等.龍鱉膠囊治療膝骨關(guān)節(jié)炎臨床療效及其對生活質(zhì)量的影響[J].中華中醫(yī)藥學(xué)刊,2017,35(3):558-561.
[ 8 ] 潘建科,謝輝,劉軍,等.龍鱉膠囊對骨關(guān)節(jié)炎滑膜細胞p38 MAPK信號通路及NF-κB p65的調(diào)控研究[J].中華中醫(yī)藥學(xué)刊,2017,35(1):65-69,261-276.
[ 9 ] 策力木格,張小峰,蘇都娜,等.血清藥物化學(xué)在中藥領(lǐng)域的應(yīng)用現(xiàn)狀[J].中國藥房,2017,28(7):978-981.
[10] 李若飛,于春萍,蘭丁璇,等.中藥血清藥理學(xué)實驗方法與相關(guān)問題探討[J/OL].全科口腔醫(yī)學(xué)電子雜志,2019,6(31):125,136[2021-1-15]. http://wenku.baidu.com/view/d61394484935eefdc8d376eeaeaad1f34793117e.
[11] MUSUMECI G,CASTROGIOVANNI P,TROVATO F M,et al. Biomarkers of chondrocyte apoptosis and autophagy in osteoarthritis[J]. Int J MolSci,2015,16(9):20560- 20575.
[12] JIANG S,LIU Y,XU B,et al. Noncoding RNAs:new re- gulatory code in chondrocyte apoptosis and autophagy[J]. Wiley Interdiscip Rev RNA,2020,11(4):e1584.
[13] DUAN R,XIE H,LIU Z Z. The role of autophagy in osteoarthritis[J]. Front Cell DevBiol,2020,25(8):608388.
[14] YANG H,WEN Y,ZHANG M,et al. MTORC1 coordinates the autophagy and apoptosis signaling in articular chondrocytes in osteoarthritic temporomandibularjoint[J]. Autophagy,2020,16(2):271-288.
[15] 潘建科,謝輝,劉軍,等.龍鱉膠囊對膝骨關(guān)節(jié)炎大鼠體質(zhì)量及臟器指數(shù)的影響[J].中華中醫(yī)藥雜志,2016,31(8):3234-3237.
[16] 魏鈺,魏民.人骨關(guān)節(jié)炎軟骨細胞的體外分離與培養(yǎng)[J].中國組織工程研究,2019,23(25):4056-4061.
[17] THOMAS C M,F(xiàn)ULLER C J,WHITTLES C E,et al. Chondrocyte death by apoptosis is associated with the initiation and severity of articular cartilage degradation[J]. Int J Rheum Dis,2011,14(2):191-198.
[18] BARRETO G,MANNINEN M,K EKLUND K. Osteoarthritis and Toll-like receptors:when innate immunity meets chondrocyte apoptosis[J]. Biology(Basel),2020,9(4):65.
[19] XIE W,XIAO W,TANG K,et al. Yes-associated protein 1:role and treatment prospects in orthopedic degenerative diseases[J]. Front Cell Dev Biol,2020,15(8):573455.
[20] WARREN C F A,WONG-BROWN M W,BOWDEN N A. Bcl-2 family isoforms in apoptosis and cancer[J]. Cell Death Dis,2019,10(3):177.
[21] SAVITSKAYA M A,ONISHCHENKO G E. Mechanisms of apoptosis[J]. Biochemistry(Mosc),2015,80(11):1393-1405.
[22] GALLUZZI L,GREEN D R. Autophagy-independent functions of the autophagy machinery[J]. Cell,2019,177(7):1682-1699.
[23] LUO P,GAO F,NIU D,et al. The role of autophagy in chondrocyte metabolism and osteoarthritis:a comprehensive research review[J]. Biomed Res Int,2019,2019:5171602.
[24] KIM Y C,GUAN K L. mTOR:a pharmacologic target for autophagy regulation[J]. J Clin Invest,2015,125(1):25- 32.
[25] ZHANG Y,VASHEGHANI F,LI Y H,et al. Cartilage- specific deletion of mTOR upregulates autophagy and protects mice from osteoarthritis[J]. Ann Rheum Dis,2015,74(7):1432-1440.
[26] NEW J,THOMAS S M. Autophagy-dependent secretion:mechanism,factors secreted,and disease implications[J]. Autophagy,2019,15(10):1682-1693.
(收稿日期:2021-01-20 修回日期:2021-05-21)
(編輯:林 靜)

