翹嘴鲌胰島素樣生長因子igf3基因的克隆及表達分析
鄭建波 賈永義 蔡李娜, 顧志敏 劉士力 遲美麗 程 順
(1. 浙江省淡水水產研究所, 湖州 313001; 2. 上海海洋大學, 上海 200000)
魚類在所有脊椎動物中擁有最復雜的性別決定方式, 不僅存在雌雄同體、雌雄異體和順序性雌雄同體, 其性別決定類型有遺傳調控、環境調控或者兩者共同決定的調控方式[1—3]。胰島素樣生長因子(Insulin like growth factors, IGFs)是一類進化上比較保守的基因家族, 調控多種細胞生物學過程, 包括生長、增殖、生存、遷移和分化[4—6]。基于哺乳動物中的研究發現, 胰島素樣生長因子系統包括IGF配體、IGF受體及6種IGF蛋白[7,8]。當前大量研究證實IGFs家族在魚類等脊椎動物性腺發育與分化中具有重要作用, 但大多偏向于igf1和igf2基因和受體的研究[9]。2008年有研究者在斑馬魚(Danio rerio)[10]和羅非魚(Oreochromis niloticus)[11]卵巢中首次分離到一種新穎的IGF類型家族基因(igf3), 隨后陸續在斜帶石斑魚(Epinephelus coioides)[12]、雙棘黃姑魚(Protonibea diacanthus)[13]和鯉(Cyprinus carpio)[14]中獲得相關序列信息。初步研究證實igf3基因僅在魚類的卵巢和精巢中特異表達, 并始于性別決定分化早期, 在性腺發育過程中持續高表達。由于igf3基因發現較晚, 目前盡管圍繞igf3基因的相關研究逐漸在增多, 但其在魚類性腺發育中的調控機制仍然不清楚, 有待深入的研究來闡明igf3如何發揮重要的生理學功能。
在魚類性別決定和性腺分化的過程中, 許多環境因素(如溫度、外源激素)可以影響雌雄性別比例或性別分化, 這種性別決定與分化大多依賴于表觀遺傳調控, 特別是DNA甲基化修飾[15]。大量研究表明許多類固醇合成酶和轉錄因子的表達受到表觀遺傳修飾調控, 如在溫度依賴的海龜性別分化過程中, 高溫處理下重要類固醇合成酶CYP19A在雌性幼龜中的甲基化水平增加, 致使cyp19a基因表達抑制繼而誘導成雄性[16—18]; 此外, 有文獻報道一些性別相關基因的啟動子CpG島甲基化修飾通過介導時空表達水平影響性別比例[19—22]。但是, 對于甲基化調控性別決定的分子機制尚需更深入的研究。
翹嘴鲌(Culter alburnusBasilewsky)俗稱白魚,廣泛分布于長江流域各水系及附屬湖泊, 肉白而細嫩, 味美而不腥, 一貫被視為上等經濟魚類, 在湖泊和水庫漁業中占有重要的地位[23]。翹嘴鲌有著明顯的性別異型特征, 雌性個體在生長速度和商品規格方面比雄魚更有優勢[24]。因此, 探索性別決定及性腺分化相關的分子調控機制, 進而尋求性別決定基因, 開展全雌翹嘴鲌育種技術, 對于增加經濟效益和提升產業體系意義重大。近年來, 我們已經克隆了一些翹嘴鲌性別決定和分化通路中的重要基因, 如Sox9、Dmrt1及Cyp19a[25—27],并對它們進行了初步的功能分析, 結果表明盡管這些基因在翹嘴鲌雌雄間存在二態性表達特征, 但并不是性別決定主效基因。本研究我們以翹嘴鲌為實驗對象, 運用RT-PCR和RACE等克隆手段首次成功鑒定并獲得了igf3基因的cDNA全長序列, 隨后通過實時熒光定量技術檢測了其在不同組織的表達水平。為進一步研究DNA甲基化修飾在該基因性二態性表達特征中的調控作用, 利用重亞硫酸鹽測序技術分析了性腺組織的DNA甲基化修飾水平, 這些初步實驗結果可為進一步研究igf3基因在翹嘴鲌中的功能及其在性別控制育種中的價值提供參考資料。
1 材料與方法
1.1 實驗材料
本實驗使用的性成熟翹嘴鲌(雌雄各3尾)收集于浙江省淡水水產研究所八里店綜合試驗養殖基地, 魚活體運回實驗室, 在冰浴中解剖魚體取出肝、心臟、腎、肌肉、腦和雌雄翹嘴鲌的性腺等組織, 液氮凍存, 用于提取基因組DNA和總RNA。
1.2 RNA提取和cDNA合成
本實驗采用Trizon法提取總RNA, 各組織樣品在Trizon提取試劑中充分裂解, 加入氯仿離心后收集上層清液, 經異丙醇沉淀回收得到Total RNA。選取質量和完整性較好的卵巢RNA為模板, 按照HiFiScript cDNA第一鏈合成試劑盒(康為 北京)方法合成cDNA第一條鏈。
1.3 翹嘴鲌igf3編碼區的克隆及cDNA末端擴增
根據已知的斑馬魚等物種igf3 cDNA序列信息設計簡并引物, 以反轉錄合成的第一鏈cDNA為模板, PCR擴增獲得翹嘴鲌igf3編碼區中間片段。在已知序列區域分別設計正反向引物5′RACE-1、5′RACE-2和3′RACE-1、3′RACE-2, 并參照SMARTerTMRACE (Clontech Japan)試劑盒說明書進行cDNA末端擴增, 最后進行連鎖分析獲得igf3基因全長序列。
1.4 氨基酸預測、比對及進化樹分析
利用JELLYFISH軟件分析了翹嘴鲌igf3基因的核苷酸序列及開放閱讀框和氨基酸序列的預測;DNAMAN軟件對不同物種IGF3氨基酸序列進行了同源性比對; 應用MEGA 5. 0軟件的鄰接法(Neighbor-joining)法構建了系統進化樹, 每個點的計算重復為1000次。
1.5 igf3基因組織表達特征分析
首先利用Primer Express 5.0設計跨內含子的igf3靶基因和ef-1α內參定量引物(表1), 我們使用的是北京康為世紀生物科技有限公司的UltraSYBR Mixture染料用于實時熒光定量PCR檢測。反應條件為: 95℃, 10min, 1個循環; 95℃, 15s, 60℃, 60s,40個循環。實時定量PCR反應及后續信息都在LightCycler 480 System(Roche 瑞士)上進行。由于定量反應非常敏感, 我們對每個反應設定了3個平行, 最后采用2–ΔΔCt法計算表達量[28]并使用Graph-Pad Prism 5軟件獲得直方圖。

表1 用于本實驗的引物序列Tab. 1 Primers used in this study
1.6 igf3啟動子區域擴增及CpG島甲基化檢測
基于前面擴增獲得的igf3 mRNA序列設計了鄰近翻譯起始位點的兩條反向引物Walking-AS1和Walking-AS2, 以翹嘴鲌卵巢基因組DNA為材料, 根據Genome WalkerTMUniversal Kit (CloneTech, 日本)試劑盒方法構建基因組文庫, 利用特異性引物PCR擴增未知的近端啟動子區域。隨后對近端啟動子序列通過在線軟件MethPrimer (http://www.urogene.org/methprimer/)和ALGGEN (http://alggen.lsi.upc.es/)分別進行了CpG島和轉錄因子結合位點的預測分析。在線軟件MethPrimer預測結果顯示有一個符合標準的CpG島(CG堿基比例>60%且CpG觀測值/預測值>0.6)。隨后按照CpGenomeTMDNA Modification Kit (Chemicon, USA)試劑盒說明書對翹嘴鲌精巢和卵巢基因組樣品(各3尾)進行重亞硫酸氫鹽處理, 以處理完成的樣品組織為模板,利用預測獲得的甲基化分析引物對igf3-BSP-F和igf3-BSP-R進行甲基化特異性擴增, 最后將產物進行純化、連接和測序分析。在測序結果中, 甲基化的胞嘧啶不發生變化, 不甲基化的則轉變為胸腺嘧啶, 根據是否發生轉變便可辨別甲基化修飾模式。
2 結果
2.1 igf3基因的cDNA全長克隆
本實驗通過已經報道的鯉igf3(GenBank 登錄號: KT895500)基因序列設計簡并引物igf3-F和igf3-R, PCR擴增到長度接近260 bp的電泳條帶, 經測序和BLAST同源性分析, 證明其為斑馬魚和鯉igf3的同源片段。隨后利用SMARTerTMRACE試劑盒分別進行5′/3′-RACE末端擴增, 最后通過RT-PCR全長序列克隆和連鎖分析成功獲得了igf3基因的完整cDNA序列。該序列全長901 bp (GenBank登錄號:MT418905), 其中包含92 bp的5′端非編碼區和203 bp的3′端非編碼區, 開放閱讀框(ORF) 606 bp, 編碼201個氨基酸。序列分析顯示, 類似于其他IGF家族成員igf1和igf2,igf3同樣存在保守的特征結構域, 主要劃分為前體信號肽、B、C、A、D和E區。
2.2 翹嘴鲌IGF3氨基酸序列比對及進化分析
使用JELLYFISH軟件對翹嘴鲌igf3核苷酸序列推測出的氨基酸與其他脊椎動物的同源性分析表明, 與鯉(Cyprinus carpio, GenBank登錄號: KT895 500)的序列同源性最高, 為85.64%; 與斑馬魚(D.rerio, GenBank登錄號: ADO16599)次之, 為70.65%;其次為點帶石斑魚(36.57%,E. coioides, GenBank登錄號: AML84199)、尼羅羅非魚(30.20%,Oreochromis niloticus, GenBank登錄號: ABY88870)、海鱸(29.25%,Dicentrarchus labrax, GenBank登錄號: AGB 51126)、斑紋隱小鳉(25.74%,Kryptolebias marmoratus, GenBank登錄號: AGA82753); 和爪蟾(Xenopus laevis, GenBank登錄號: NP_001082137)的同源性最低, 為18.93%。采用MEGA 5.0軟件的NJ鄰接法構建了翹嘴鲌IGF3蛋白與其他7個物種的系統進化樹(圖1)。結果顯示翹嘴鲌與鯉發生聚類, 較其他物種具有最接近的親緣關系, 所有魚類聚為一支, 爪蟾單獨構成一支。
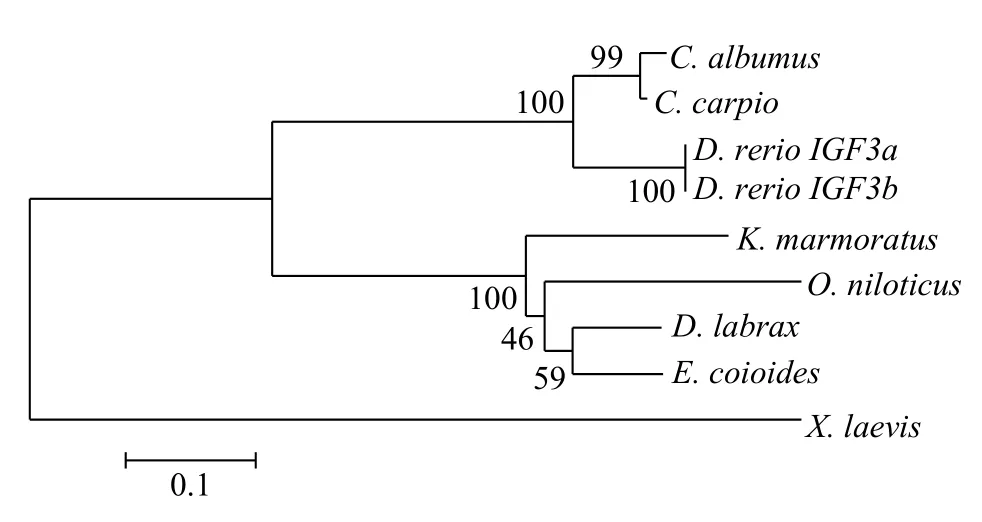
圖1 翹嘴鲌IGF3系統進化樹分析Fig. 1 Phylogenetic tree analysis of IGF3 in C. alburnus
2.3 翹嘴鲌igf3表達水平分析
以ef-1α為內參基因, 采用qRT-PCR方法對igf3基因mRNA在翹嘴鲌各組織的表達豐度進行了分析。結果顯示igf3基因在翹嘴鲌不同組織中的表達豐度差異明顯, 在卵巢中表達量最高, 其次是精巢組織, 而在腦、心臟、脾臟、肝臟、肌肉和腎臟中表達豐度極低(圖2)。這表明igf3基因在性腺中的表達水平顯著高于其他組織, 提示其在性腺形成或功能維持方面具有重要作用。
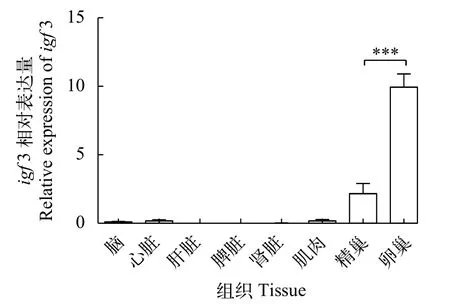
圖2 igf3在翹嘴鲌各種組織中的表達水平Fig. 2 Relative expression of igf3 in different tissues in C. alburnus
2.4 翹嘴鲌igf3啟動子區域CpG島甲基化分析
為了解翹嘴鲌的卵巢和精巢中igf3基因啟動子CpG島甲基化程度, 我們對該基因近端啟動子序列進行了擴增和CpG島預測。結果表明該基因啟動子區域存在一段包含8個CG位點的CpG島(圖3a)。經重亞硫酸氫鹽處理翹嘴鲌精巢和卵巢基因組,PCR檢測結果顯示在卵巢中的10個隨機挑選克隆所有CG位點幾乎不發生甲基化修飾, 相反精巢中高度甲基化(只有一個克隆的CG位點沒有發生甲基化), 兩個性腺組織甲基化修飾水平差異顯著(圖3b和3c)。這個結果表明igf3在性腺組織中的表達豐度與DNA甲基化修飾程度正好呈負相關, 提示翹嘴鲌性別二態性表達特征可能受其啟動子區域CpG島甲基化修飾的調控。

圖3 翹嘴鲌igf3基因啟動子CpG島甲基化分析Fig. 3 CpGs DNA methylation of igf3 in C. alburnus
3 討論
魚類擁有所有脊椎動物都有可能出現的性別決定類型, 因此研究其性別決定和性別分化具有重要的學術價值。更為重要的是, 大多數魚類在生長過程中存在明顯的性別二態性, 即雌雄個體的生長速率、個頭大小差異顯著, 通過性別調控發展單性養殖技術有著較高的經濟價值[29]。已有研究表明IGFs家族除對脊椎動物的生長發育方面具有重要調控作用外, 在性別決定與分化中的作用也受到廣泛關注[30]。近年來, 在硬骨魚中發現一種特有的新型IGF因子(igf3), 且僅出現在精巢和卵巢中的間質細胞[31], 因此其在性腺發育中的作用受到了廣泛關注。到目前為止, 已在多個魚類物種中分離鑒定到igf3基因, 包括斑馬魚、羅非魚、斜帶石斑魚、雙棘黃姑魚、鯉、虹鱒(Oncorhynchus mykiss)[31]和雀鯛(Chrysiptera cyanea)[32]并進行了一些初步的表達水平和功能機制分析。
3.1 翹嘴鲌igf3的克隆鑒定和保守性分析
本研究報道了翹嘴鲌igf3基因全長cDNA序列,該基因全長901 bp, 包含開放閱讀框606 bp, 92 bp的5′端非編碼區和203 bp的3′端非編碼區, 編碼201個氨基酸。蛋白質結構分析顯示翹嘴鲌IGF3同樣存在IGF家族特有的典型結構域, 主要劃分為前體信號肽、B、C、A、D和E區, 這與羅非魚、斑馬魚和鯉魚中的結構較為一致[9,10,14]。多重氨基酸序列結果顯示所有魚類物種的IGF3蛋白在保守結構域區域相似度較高, 表明這些保守結構域對于IGF家族發揮功能作用是必需的[12]。根據系統進化樹結果, 選擇分析的魚類物種都聚為一支, 這一結果表明IGF3的系統進化關系與物種的分類地位保持一致。此外, 我們還發現igf3基因組啟動子區域存在多個與性別相關的轉錄因子結合位點, 如SRY、Sox2和HMG等, 這些數據有力地證明igf3作為下游基因可能參與翹嘴鲌的性別決定與分化過程。
3.2 翹嘴鲌igf3基因的功能研究
目前發表的研究數據表明igf3在硬骨魚類性腺中的表達水平都要遠高于其他組織, 暗示其在性腺中具有重要的作用[9,10,12—14]。翹嘴鲌igf3基因在成體各組織的qRT-PCR結果顯示: 該基因主要在卵巢中表達, 其次在精巢中有少量表達, 而其他組織基本無法檢測到igf3的表達, 且卵巢中的表達水平顯著高于其他組織(P<0.001)。翹嘴鲌成體組織的表達模式推測該基因可能參與成體卵巢的功能維持,由于igf3基因在精巢中也有少量表達, 提示其功能不僅限于卵巢方面的作用, 對于2個不同性腺組織的形成可能都具有重要的功能。在羅非魚中的研究表明igf3參與調控性別分化相關基因(cyp19a1a、foxl2和dmrt1)的表達, 同時igf3的表達也受到這些轉錄因子和雌激素的調控[33]。
在研究魚類等脊椎動物性別發育調控時會發現許多性別相關基因是雌性或雄性相關基因, 其表達模式顯示了明顯的性別二態性[34]。本實驗對翹嘴鲌性腺組織qRT-PCR的檢測結果顯示, 卵巢表達量約為精巢的3倍, 說明該基因的表達呈顯著的性別二態性。為了解涉及性二態性表達特征的調控機制, 我們對性腺組織的igf3基因啟動子區域進行了甲基化分析, 結果表明基因表達水平與DNA甲基化修飾呈負相關關系。在其他魚類物種中, 如牙鲆(Paralichthys olivaceus)、斑馬魚和黃鱔(Monopterus albus)等脊椎動物, 一些性別調控基因(cyp19a、cyp17和dmrt1)也被發現有兩性性腺甲基化水平和基因表達的差異[18,35]。已知CpG島所在啟動子區域富含轉錄因子結合位點,igf3在精巢中的高度甲基化可能阻礙了一些轉錄因子的結合及轉錄復合物的形成, 進而抑制了該基因的表達, 至于具體的阻礙機制仍需進一步的研究。
本研究基于RACE方法成功克隆了翹嘴鲌igf3 cDNA序列, 并對其蛋白質結構、氨基酸序列同源性、組織表達模式及啟動子甲基化修飾水平進行了系統的檢測分析, 為進一步揭示igf3對于翹嘴鲌性腺發育的作用奠定了研究基礎。但igf3在性別調控和性腺發育中如何發揮作用及表觀遺傳修飾的具體調控機制仍未可知, 為此后續實驗應該圍繞如下兩方面進行深入研究: (1)通過CRISPR/Cas9基因編輯技術建立功能基因敲除模型, 研究各個基因間的相互作用, 最終闡明翹嘴鲌性別決定與分化過程的調控網絡; (2)挖掘igf3潛在的轉錄因子, 分析其在性別決定與分化關鍵時期的基因表達和甲基化動態水平的檢測分析, 設計體外實驗研究轉錄因子對igf3基因的調控關系。

