對腫瘤內miR-21表達進行契倫科夫光學成像的新方法:基于HSV1-tk報告基因
李 淼,張衛善
西安交通大學第一附屬醫院1Med-X研究院腫瘤精準治療研究室,2醫學影像科,陜西 西安 710061
微小核糖核酸(microRNA)是一類可互補結合靶基因信使核糖核酸(mRNA)3’-端非翻譯區(3’-UTR),繼而降解靶基因mRNA或抑制其翻譯的內源非編碼單鏈核酸[1-2]。其中miR-21是一種表達于多數實體腫瘤的常見microRNA,是可靠的惡性腫瘤標志物[3],以及反義RNA 干擾抗腫瘤治療的潛在靶點[4]。目前檢測microRNA 常用的Northern 雜交、實時聚合酶鏈式反應、微陣列等體外方法[5],存在操作復雜、難以觀察活細胞內microRNA表達等問題。將分子影像學與報告基因方法相結合,可展示基因的原位表達情況,一定程度上彌補了上述不足[6]。典型的報告基因體系,如I型單純皰疹病毒胸苷激酶(HSV1-tk)報告基因,結合9-[4-[18F]氟-3-(羥甲基)丁基]鳥嘌呤([18F]FHBG)示蹤劑和正電子發生斷層成像(PET),已獲美國食藥監局批準用于臨床成像[7]。
已報道的microRNA表達報告基因活體成像策略有[8]:(1)整合原microRNA啟動子基因與光學報告基因,構建直接展示相應microRNA表達調控的融合基因,即經典的直接表征策略,僅能反映microRNA表達調控而非實際表達水平[9];(2)新興的基于納米材料的核酸雜交活化傳感靶向探針,激發光學或磁共振信號的策略,需構建復雜的包裝探針,其生物相容性尚不夠理想[10];(3)構建含有報告基因與microRNA互補結合靶序列的融合表達載體策略,是目前最常用的策略,可直接響應內源性microRNA的調控效應,且應用不受成像模態的限制[11-12]。有鑒于光學模態在檢測便捷性方面相較其他成像模態有明顯優勢,已廣泛應用于報告基因成像,而前述成熟的HSV1-tk/[18F]FHBG體系是基于放射性示蹤劑的報告基因體系。為嘗試基于單一種類放射性示蹤劑實現光學/核素協同成像[13],本研究擬整合策略(3)與HSV1-tk/[18F]FHBG體系,構建通過契倫科夫光學模態對腫瘤細胞內miR-21的表達進行可視化表征的新型報告基因成像方法。
1 材料與方法
1.1 試劑
A549肺癌細胞系(典型培養物保藏中心ATCC);添加了葡萄糖、1%青-鏈霉素雙抗和10%胎牛血清(Gemini)的RPMI-1640培養基(Gibco),Lipofectamine脂質體及配套轉染試劑盒、胰酶和乙二胺基四乙酸(EDTA)(Invitrogen);In vivo-jetPEI陽離子聚合物活體轉染載體試劑(Polyplus Transfection);陰離子交換樹脂/中性氧化鋁/十八烷基鍵合硅膠固相萃取小柱(Sep-Pak Accell QMA/Alumina N/C18 Light;Waters),4,7,13,16,21,24-六氧雜-1,10-二氮雜雙環[8,8,8]廿六烷(Kryptofix 2.2.2,K222;Merck),N2-(對甲氧苯基二苯基甲基)-9-[(4-甲苯磺酰基)-3-對甲氧苯基二苯基甲氧基-甲基丁基]鳥嘌呤前體(ABX);無水乙腈、鹽酸(HCl)、氫氧化鈉(NaOH)均為分析純(Sigma-Aldrich),乙醇為藥典級(Merck)。
1.2 質粒載體構建、轉染及細胞培養
PCR擴增HSV1-tk基因并插入pcDNA3.1質粒的XhoI和EcoRI位點,構建轉染載體。合成三聯miR-21互補結合靶基因(3×miR-21t)序列并退火:有義鏈5'-GGCCGCTAGCTTATCAGACTGATGTTGATAGCTT ATCAGACTGATGTTGATAGCTTATCAGACTGATG TTGAT-3'及反義鏈5'-CTAGATCAACATCAGTCT GATAAGCTATCAACATCAGTCTGATAAGCTATCA ACATCAGTCTGATAAGCTAGC-3',然后插入CMVHSV1-tk基因下游3’-UTR區域的KpnI和BamHI位點,構建CMV-HSV1-tk-3×miR-21t報告基因載體(圖1)[14]。
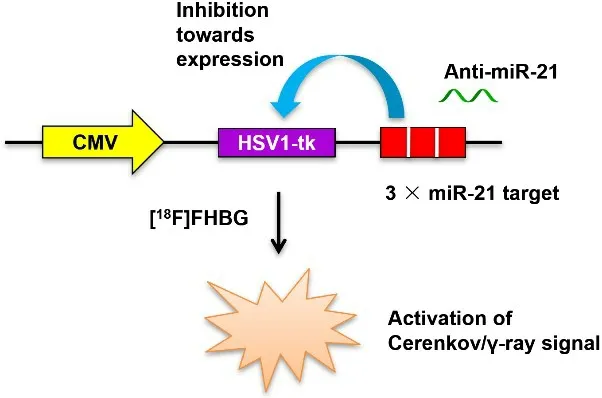
圖1 CMV-HSV1-tk-3×miR-21t/[18F]FHBG報告基因成像體系原理示意圖.Fig.1 Schematic diagram of the CMV-HSV1-tk-3×miR-21t/[18F]FHBG reporter gene system.
采用上述轉染試劑盒將上述報告基因載體瞬轉入A549細胞,得穩定表達CMV-HSV1-tk-3×miR-21t報告基因載體的A549細胞(A549T細胞)。所有細胞置于37 ℃、5%CO2環境中培養,至鋪滿瓶底70%面積時傳代。
1.3 [18F]FHBG制備
[18F]F-離子基于PETtrace回旋加速器(GE)通過核反應18O(p,n)18F制備。用能量為16.4 MeV、強度5 mA的質子束流轟擊靶水[18O]H2O(純度97%)30 min。富集靶水中的[18F]F-到QMA柱,用K2CO3(3 mg,0.5 mL水溶液)與K222(15 mg,1 mL 無水乙腈溶液)洗脫收集。[18F]FHBG的標記制備在TRACERLab FXFN自動合成儀(GE)上通過親核取代反應進行:將[18F]F-加熱抽真空共沸,另加無水乙腈同法干燥,加前體(2 mg,0.6 mL無水乙腈溶液),120 ℃反應10 min,冷卻后加HCl(1 mol/L,0.5 mL),95 ℃水解5 min,冷卻后加NaOH(2 mol/L,0.25 mL)中和,反應體系過Alumina N/C18串聯柱,水(5 mL)洗滌C18柱,乙醇(2 mL)洗脫產物,加磷酸鹽緩沖生理鹽水(PBS)稀釋,過濾除菌后立即用于后續實驗[15]。
1.4 轉染細胞成像及γ計數
將A549T 細胞接種于12 孔板中[(0.31~5)×105/孔],培養12 h貼底。加[18F]FHBG(107kBq/孔)孵育120 min。加4 °C預冷PBS洗3次,0.25%胰酶-0.02%EDTA溶液消化;細胞懸液轉入96孔板進行契倫科夫光學成像和γ計數;另將A549T細胞接種于12孔板中(5×105/孔),培養12 h貼底后,采用脂質體2000轉染試劑轉染反義寡聚miR-21(Anti-miR-21;終濃度25~100 nmol/L),培養24 h;同法加[18F]FHBG成像及γ計數[16]。
契倫科夫成像采用IVIS Spectrum光學成像系統(PerkinElmer)曝光5 min,其余參數為默認值。用Advanced Acquisition and Analysis Tools 軟件(PerkinElmer)手動勾劃感興趣區(ROI)并提取發射光強度。采用Wizard 2480自動γ計數器(PerkinElmer)測定γ計數率。
1.5 轉染細胞系移植瘤模型成像
所有動物實驗操作依照當地官方和作者所在單位的動物福利及研究倫理相關規定設計和執行。移植瘤模型采用4~5周齡無胸腺雌裸鼠(Envigo)構建。接種前將A549T細胞重懸于預冷PBS并與基質膠混合(1∶1,v/v)并置于冰上。細胞懸液注射至右后肢外側皮下(5×106/只)。卡尺測定移植瘤體直徑,待其體積(瘤體積=π×短徑2×長徑/6)≥200 mm3時,將小鼠分為對照組和實驗組,5只/組。實驗組采用In vivo-jetPEI 試劑(0.1 mL)與Anti-miR-21(50 mg)混合,于小鼠瘤內注射,對照組小鼠瘤內注射In vivo-jetPEI 試劑與對照RNA 混合物(50 mg)。24 h后,實驗組、對照組小鼠分別經尾靜脈注射[18F]FHBG(3.7 MBq/300 μL),1 h后以異氟烷吸入法麻醉小鼠;取俯臥位采集契倫科夫光學圖像,曝光2 min,其余參數為默認值。
1.6 統計學分析
采用SPSS 22.0軟件進行統計分析,定量資料的組間比較均采用Student'st檢驗,以P<0.05為差異有統計學意義。線性相關回歸分析在Prism 8軟件(GraphPad)上進行。
2 結果
2.1 細胞數量與成像信號強度的相關性
A549T細胞與[18F]FHBG共孵育后,成像信號強度與細胞數量之間的線性回歸分析結果顯示,契倫科夫光學圖像上顯示的信號強度隨著細胞數量倍增而同步增強(圖2A)。契倫科夫光學信號強度與細胞數量呈現良好的線性正相關(R2=0.9962,圖2B)。此外,放射性γ計數率與A549T細胞數量之間也呈現顯著的線性正相關(R2=0.9807,圖2C)。
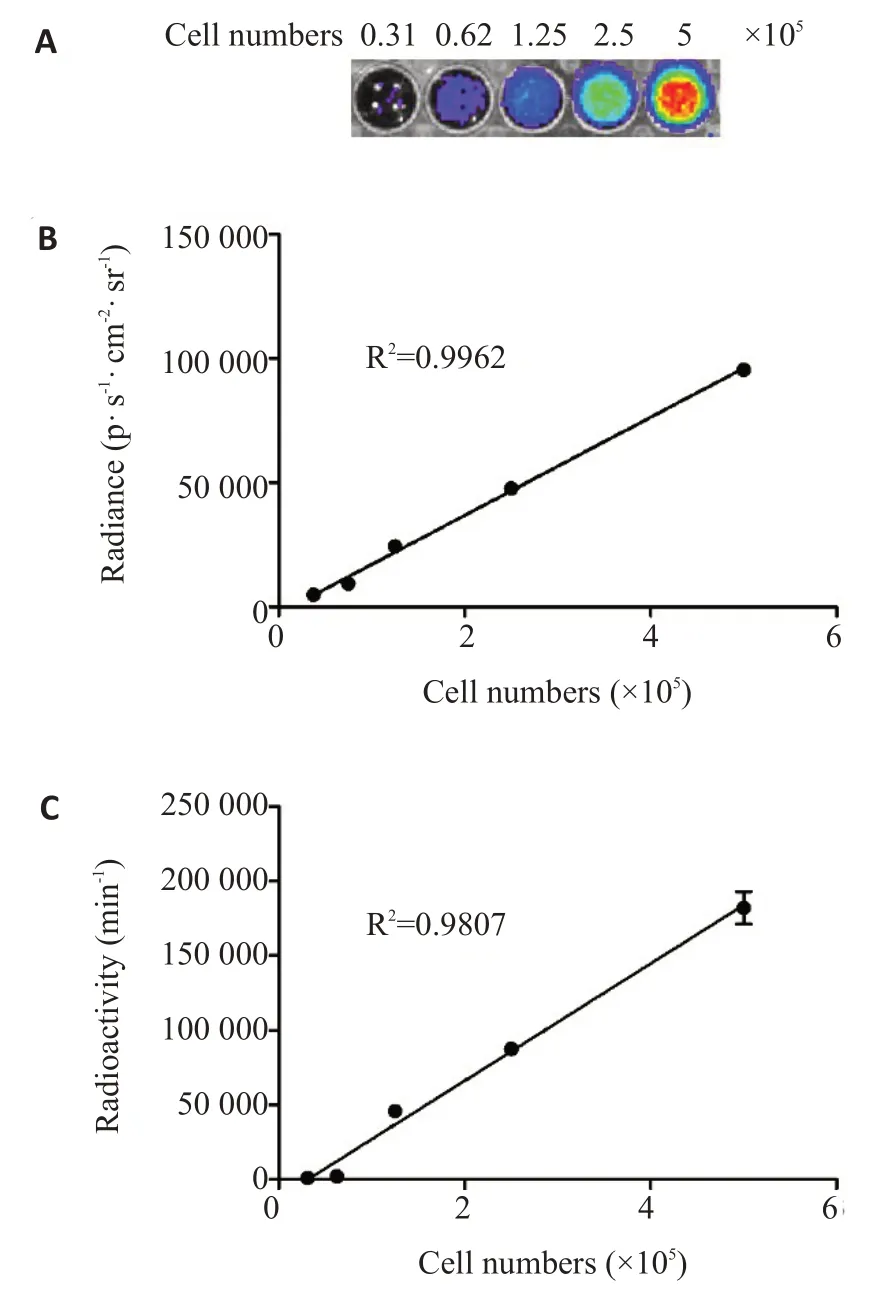
圖2 穩定表達報告基因載體的梯度數量A549T細胞與[18F]FHBG共孵育120 min后的成像信號.Fig.2 The signals transmitted by the A549T cells in gratitude number stably expressing the reporter gene vector after the incubation with[18F]FHBG for 120 min.
2.2 反義寡聚miR-21對成像信號的調控作用
經梯度劑量Anti-miR-21 處理的A549T 細胞與[18F]FHBG孵育后的成像信號強度測定結果顯示,契倫科夫光學圖像上顯示的信號強度隨著Anti-miR-21濃度倍增而同步增強(圖3A);契倫科夫光學信號強度與Anti-miR-21濃度呈現正向劑量依賴關系(圖3B)。此外,放射性γ計數率也隨著Anti-miR-21濃度倍增而同步上升,呈劑量依賴性正相關(圖3C)。
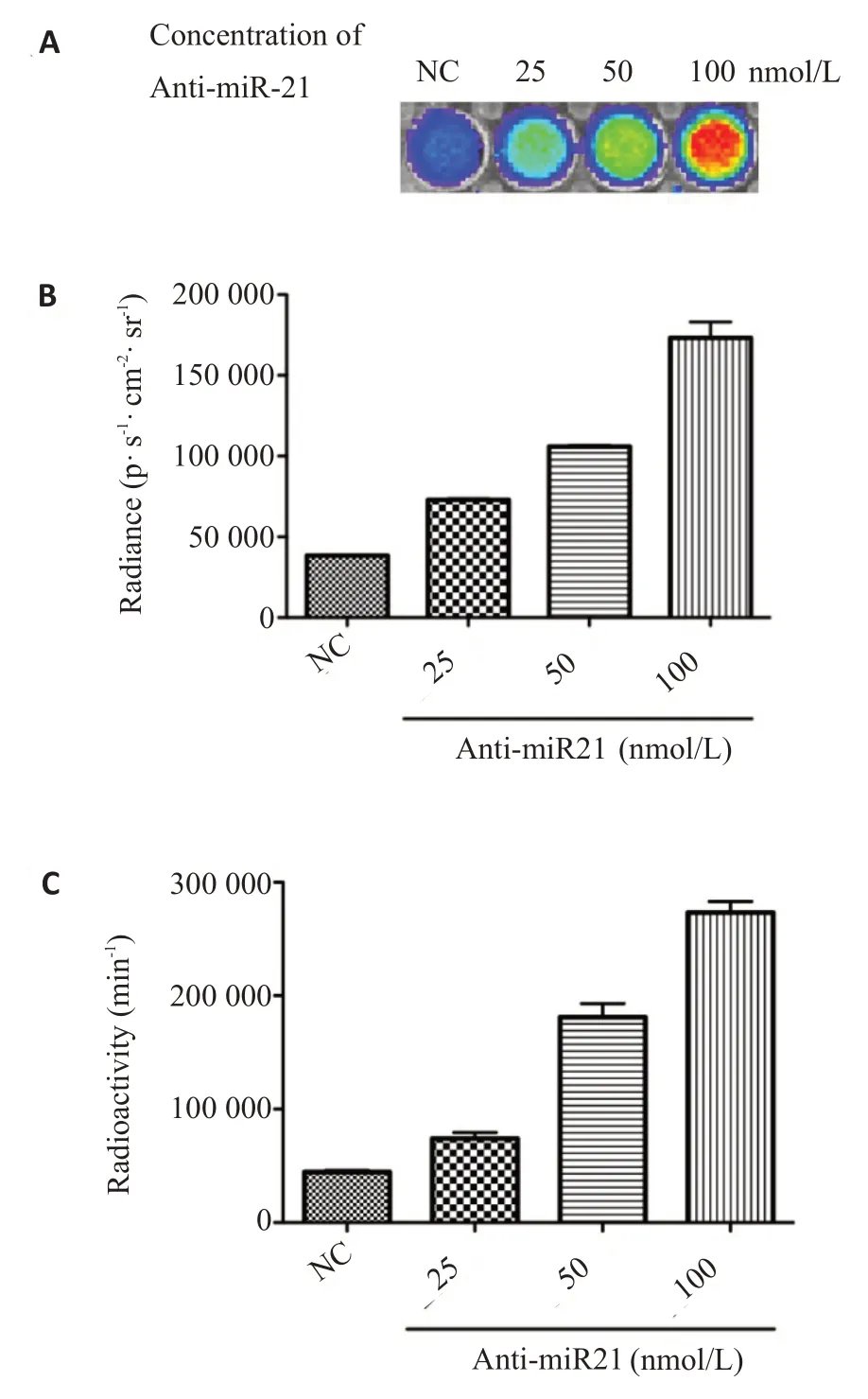
圖3 加入梯度劑量反義寡聚miR-21處理的穩定表達報告基因載體的A549T細胞與[18F]FHBG共孵育120 min后的成像信號Fig.3 The signals transmitted by the A549T cells stably expressing the reporter gene vector after the treatment with antisense oligomeric miR-21 in gratitude concentration and the subsqeuent incubation with[18F]FHBG for 120 min.
在瘤內注射Anti-miR-21(實驗組)或混合RNA(對照組)的A549T皮下瘤模型(n=5)給藥[18F]FHBG后的契倫科夫光學圖像中,實驗組瘤體輪廓清晰可見;而對照組瘤體輪廓難以與背景組織區分;且上述2組之間移植瘤信號的視覺對比非常明顯(圖4),在活體水平有效展示了上述報告基因對內源性miR-21抑制HSV1-tk表達活性的響應,以及Anti-miR-21對miR-21功能的序列特異性抑制作用。
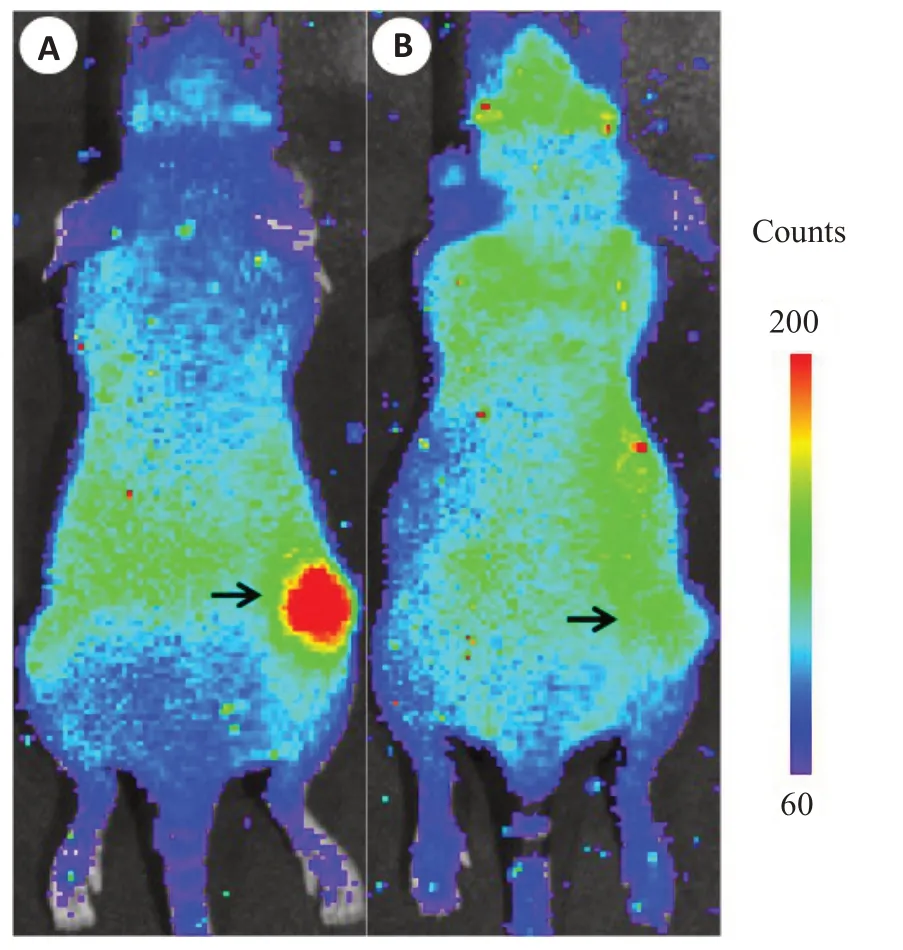
圖4 穩定表達報告基因載體的A549T細胞皮下移植瘤模型小鼠在注射[18F]FHBG 2 h后的典型活體契倫科夫光學圖像.Fig.4 The typical in vivo Cerenkov images of subcutaneous A549T xenograft model stably expressing the reporter gene vector at 2 h after the injection of[18F]FHBG.
3 討論
已知在細胞內>60%的mRNA表達可被microRNA調控。就種類而言,microRNA與mRNA之間的調控關系是一個復雜的交叉網絡。揭示microRNA的細胞內動態表達模式將有助于闡明microRNA調控的機制,具有重要的研究及臨床意義[17]。已知microRNA miR-21在癌癥的起始、進展和轉移中起關鍵作用。一些腫瘤類型依賴miR-21的表達以維持其惡性表型[4]。因此對miR-21在腫瘤組織或細胞中的表達進行成像,不僅有望作為腫瘤診斷標志物,也可用于分析相關信號通路和構建miR-21靶向藥物研究模型[16]
本研究構建報告基因體系的總體設計原理如下:在HSV1-tk基因下游3’-UTR區域構建三聯miR-21靶基因序列(3×miR-21t);3×miR-21t序列可被細胞的內源性miR-21互補結合;當內源性miR-21表達時,miR-21結合3×miR-21t序列,從而抑制HSV1-tk基因表達,即負向調控;外源加入的Anti-miR-21可通過互補配對使miR-21的功能沉默,從而恢復HSV1-tk的表達及其活性,即正向調控;HSV1-tk的磷酸激酶活性可使進入細胞質的[18F]FHBG被磷酸化,無法再轉運出胞外,從而蓄積在胞內,并持續發射γ射線和契倫科夫光學信號。
為了驗證本文所構建的報告基因成像體系的定量可靠性,本研究分析了A549T細胞與[18F]FHBG共孵育后的成像信號強度與細胞數量之間的線性相關性,結果顯示上述報告基因體系的表達及其功能活性是穩定均一的;在不超過5×105細胞的范圍內,契倫科夫光學信號強度可準確反映細胞數量。這說明上述報告基因體系具備較好的定量能力。為驗證上述報告基因系統的特異性,本研究還測定了經梯度劑量Anti-miR-21處理的A549T細胞與[18F]FHBG孵育后的成像信號強度,結果顯示Anti-miR-21確可靶向性地發揮作用,抑制miR-21下調HSV1-tk基因表達的功能。此外,在本研究中還觀察到契倫科夫光學定量信號與射線直接定量信號之間能相互匹配。結合活體成像結果可知,上述報告基因體系在契倫科夫光學模態下能特異性地準確表征靶組織腫瘤細胞內microRNA的表達和分布情況。
目前報道最多的miR-21 活體成像策略是基于miR-21 雜交活化激發信號原理的靶向納米材料探針[18-21]。既往有研究者基于熒光素酶報告基因與miR-21靶序列融合表達載體,利用內源性microRNA發揮小干擾RNA的功能,以下調或關閉報告基因表達,對荷瘤模型鼠進行了生物發光成像,取得了良好效果[22]。而理論上更換其他報告基因類型,應可適用于相應的成像模態。因此在上述經典報告基因成像策略的基礎上,本研究選擇已廣泛用于核素成像的HSV1-tk與[18F]FHBG的組合,盡量利用成熟原理和成像設備,構建了針對miR-21表達的新型報告基因體系,提供了一種對腫瘤細胞內miR-21表達進行便捷、實時、定量可視化的新方法。
據筆者所知,本文是首例基于HSV1-tk/[18F]FHBG激酶報告基因體系,對microRNA的表達進行契倫科夫光學靶向成像的報道。在報告基因成像常用的核素成像、光學成像、磁共振成像這3種模態中,光學模態在空間分辨率、敏感度方面位于中間;雖在組織透射能力、定量準確度方面還不夠理想,但在設備成本、操作便捷性方面則優于其他模態。在光學模態中,熒光成像便于多通道檢測,但依賴外源激發光,活體組織自發熒光背景干擾較強,不利于負向調控報告基因的信號采集;生物發光無需激發光源,特異性較強,背景對比度較高,但需在成像前給藥發光底物(例如熒光素),且敏感度偏低;契倫科夫光學模態最顯著的特征是其基于放射性示蹤劑,靈敏度高,發射光譜范圍寬[23],還可整合光學與核素成像的優勢。同其他光學成像模態一樣,契倫科夫光學信號的組織透射能力也相對有限,其信號強度會受到組織吸收散射的干擾。本研究所用動物模型的皮下移植瘤屬于淺表組織,受到上述影響較小,進行組間的契倫科夫光學信號強度比較尚屬可行。
本研究的局限在于:雖初步構建了miR-21特異性報告基因成像體系,但僅進行了契倫科夫光學成像以及γ放射性計數率的測定,及針對miR-21成像的特異性驗證,未進行射線信號的直接成像。后續研究中,將構建原位荷瘤及轉移瘤動物模型,并進行活體PET/契倫科夫光學成像,評價該報告基因體系用于多模態定量動態成像的性能。
綜上所述,本文構建了一種用于對腫瘤內miR-21進行靶向契倫科夫光學成像的新型報告基因體系。該體系有望進一步推廣至活體多模態成像應用,為實時、定量表征腫瘤細胞的特定microRNA表達水平、分布及其動力學特征提供了新的方法學思路,并為達成腫瘤的精準診療探索了新的技術路徑。