5-氮雜-2-脫氧胞苷對MEG3啟動子超甲基化逆轉及膀胱癌細胞凋亡的作用
姜應傳 陳炳 鄔嘉波 王婕 張小榮
膀胱癌是泌尿系最常見的惡性腫瘤,全世界每年約有54.9萬例新發病例,約20萬例患者死于膀胱癌,且發病率和病死率仍在不斷上升[1]。近年來研究發現,一些長鏈非編碼RNA(long noncoding RNA,lncRNA)作為基因表達的重要調控因子,參與調節膀胱癌細胞增殖、分化和凋亡等過程[2]。母系表達基因3(maternally expressed gene 3,MEG3)是最早被發現具有抑癌作用的lncRNA之一,在多數腫瘤中呈低表達或表達缺失,而啟動子超甲基化可能是導致其低表達的原因之一[3]。本研究使用不同濃度的DNA甲基化特異性抑制劑5-氮雜-2-脫氧胞苷(5-aza-2-deoxycytidine,5-Aza-CdR)作用人膀胱癌T24細胞,檢測MEG3啟動子甲基化程度、MEG3 mRNA表達和細胞凋亡情況,進而探討5-Aza-CdR對MEG3啟動子超甲基化逆轉及膀胱癌細胞凋亡的作用。
1 材料和方法
1.1 材料和試劑 人膀胱癌細胞系T24購自上海生工細胞庫。FBS(批號:11011-8611)購自杭州四季青生物公司,胰蛋白酶(批號:25200114)、DMEM 培養基(批號:11995065)均購自美國 Gibco公司;5-Aza-CdR(批號:A3656)、二甲基亞砜(dimethyl sulfoxide,DMSO;批號:D2650)均購自美國Sigma公司;QIAmp DNA Mini Kit試劑盒(批號:51304)、EpiTect Bisulfite Kit(批號:59104)、EpiTect MSP Kit試劑盒(批號:59496)均購自德國Qiagen公司;熒光定量試劑盒(批號:A6001)、反轉錄試劑盒(批號:A5001)均購自美國 Promega公司;Hoechst33258試劑盒(批號:C1011)購自上海碧云天生物技術研究所;Annexin V PE/7-AAD凋亡試劑盒(批號:559763)購自美國BD生物科學公司,各引物購自上海生工生物工程公司。
1.2 藥物配置 5 mg 5-Aza-CdR溶于DMSO中,配制成濃度為2.2×105μmol/L的母液,置于-20°C冰箱內儲存;用 DMEM 培養基配制濃度為 0、2.5、10 μmol/L 的5-Aza-CdR培養液,同時用DMEM培養基配制濃度為0、2.5、10 μmol/L 的 DMSO 培養液,于 4 °C 保存。
1.3 細胞培養 人膀胱癌T24細胞用10%FBS+DMEM培養基,于37℃、含5%CO2的培養箱中培養。每1~2 d換液1次,當細胞生長至90%以上時,用0.25%胰蛋白酶消化細胞并傳代,取對數生長期的細胞用于實驗。
1.4 MEG3啟動子甲基化程度檢測 采用甲基化特異性PCR法。T24細胞按1.0×105個/孔的密度接種于6孔板中,待細胞貼壁后,實驗組加入濃度為 0、2.5、10 μmol/L的5-Aza-CdR培養液,對照組加入濃度為0、2.5、10 μmol/L的DMSO培養液,分別作用3 d。收集細胞,按照 QIAmp DNA Mini Kit、EpiTect Bisulfite Kit試劑盒說明書進行基因組DNA提取和亞硫酸鹽修飾。MEG3基因甲基化特異性引物序列如下,甲基化引物:正向5'-GTT AGTAATCGGGTTTGTCGGC-3',反向 5'-AATCATAACTCCGAACACCCGCG-3';非甲基化引物:正向5'-GAGGATGGTTAGTTATTGGGG T-3',反向 5'-CCA CCATAACCAACACCCTATAATCACA-3'。按EpiTectMSP Kit試劑盒說明書在PCR擴增儀(MyCycler,美國Bio-Rad公司)上進行甲基化特異性PCR。擴增反應總體系50 μl,其中EpiTect Master Mix 25 μl(1×)、primer A 2 μl(0.4 μmol/L)、primer B 2 μl(0.4 μmol/L)、模板DNA(<200 ng/50 μl)、RNase free dH2O 補足至 50 μl。擴增條件:95 ℃ 10 min;94 ℃ 15 s,50 ℃ 30 s,72 ℃ 30 s,30 個循環;72 ℃ 10 min。PCR產物于2.5%瓊脂糖凝膠電泳后觀察,使用凝膠成像儀(Universal HoodⅡ,美國Bio-Rad公司)攝像。出現甲基化條帶而未出現非甲基化條帶提示超甲基化,而非甲基化條帶越清晰代表甲基化程度越低。
1.5 MEG3 mRNA表達檢測 采用RT-qPCR法。T24細胞按1.0×105個/孔的密度接種于6孔板中,待細胞貼壁后,加入濃度為 0、2.5、10 μmol/L 的 5-Aza-CdR 培養液作用3 d。使用Trizol試劑提取總RNA,將提取的RNA進行反轉錄和PCR擴增。MEG3引物序列:正向5'-CTGCCCATCTACACCTCACG-3',反向 5'-CTCTCCGCCGTCTGCGCTAGGGGCT-3'。每個待測樣品設置3個平行復孔,以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作為內參。PCR體系:10 μl 2×SYBR Premix Ex Taq;1 μl Reverse Primer;5.2 μl RNase Free dH2O;4 μl cDNA;0.2 μl DyeⅡ;1 μl Forward Primer。在RT-qPCR儀(7500 fast Real-Time PCR system,美國ABI公司)上進行反應。反應程序:95℃2 min;95 ℃ 15 s,60 ℃ 60 s,60℃ 60 s,40個循環。記錄 Ct值,采用2-ΔΔCt方法計算MEG3 mRNA相對表達量。
1.6 細胞凋亡檢測 (1)采用Hoechst33528核染色法。在6孔板中配置2 ml密度為2×104個/ml的T24細胞懸液,加入 0、2.5、10 μmol/L 的 5-Aza-CdR 培養液作用3 d。用0.1%多聚甲醛固定30 min,PBS洗5 min;加入Hoechst33258 染色液(1:1 000)避光作用 10 min;置于熒光顯微鏡(LSM800,德國Zeiss公司)下,在波長340 nm處進行觀察。在熒光顯微鏡下,存活細胞呈彌散均勻熒光,凋亡細胞在細胞核或細胞質內可見濃染致密的顆粒塊狀熒光。(2)采用流式細胞術。T24細胞按1.0×105個/孔的密度接種于6孔板中,待細胞貼壁后,加入濃度為0、2.5、10 μmol/L的5-Aza-CdR作用3 d。將細胞濃度調整為1×106個/ml,用預冷的PBS洗滌細胞1次,再用冷的鹽酸緩沖液洗滌1次,1 000 r/min離心5 min;棄上清液,收集細胞,加入500 μl結合緩沖液重懸細胞;再次離心沉淀細胞,小心吸除上清液;用去離子水按 1:3稀釋結合緩沖液(4 ml 4×結合緩沖液+12 ml去離子水);用1×結合緩沖液重懸細胞,調節其濃度為1×106個/ml;取100 μl細胞懸液于5 ml流式管中,加入 5 μl Annexin V PE混勻后于室溫避光孵育5 min;加入10 μl 20 mg/L的 7-AAD、400 μl PBS,立刻使用流式細胞儀(FACSVia,美國BD公司)進行檢測。凋亡率=早期凋亡率(右下象限)+晚期凋亡率(右上象限);實驗重復3次,取平均值。
1.7 統計學處理 采用Graphpad Prism 7.0統計軟件。計量資料以表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 不同藥物作用后T24細胞MEG3啟動子甲基化程度比較 對照組出現清晰的M帶(甲基化條帶)未出現U帶(非甲基化條帶),提示對照組MEG3啟動子發生超甲基化;實驗組隨5-Aza-CdR濃度的增加逐漸出現清晰的U帶,MEG3啟動子甲基化程度隨著5-Aza-CdR濃度增加而下降,見圖1。
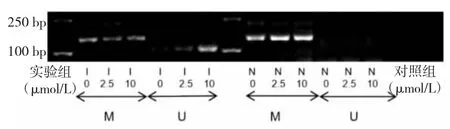
圖1 不同藥物作用后T24細胞母系表達基因3(MEG3)啟動子甲基化程度比較
2.2 不同濃度5-Aza-CdR作用后T24細胞MEG3 mRNA表達比較 0、2.5、10 μmol/L 5-Aza-CdR作用T24細胞后MEG3 mRNA相對表達量分別為1.00±0.00、3.17±0.14、6.73±0.57,差異有統計學意義(F=73.43,P<0.05),且MEG3 mRNA相對表達量隨著5-Aza-CdR濃度增加而增加(均P<0.05)。
2.3 不同濃度5-Aza-CdR作用后T24細胞凋亡情況比較 在熒光顯微鏡下,0 μmol/L組T24細胞形態基本正常,2.5 μmol/L 組、10 μmol/L 組 T24細胞出現不同程度的凋亡,表現為熒光集中,核固縮、分解等形態,見圖2(插頁)。流式細胞術檢測顯示,0、2.5、10 μmol/L 5-Aza-CdR作用T24細胞后細胞凋亡率分別為(0.34±0.05)%、(11.49±0.36)%、(17.53±2.03)%,差異有統計學意義(F=53.28,P<0.05),且 T24細胞凋亡率隨著 5-Aza-CdR濃度增加而升高(均P<0.05),見圖3(插頁)。
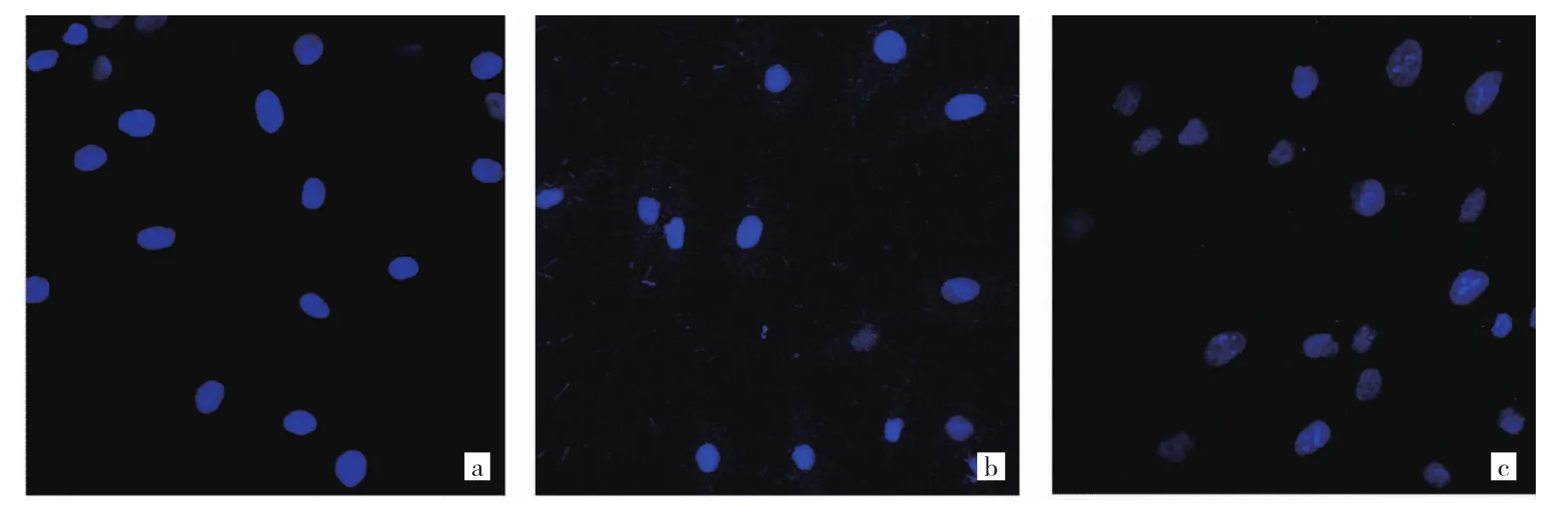
圖2 不同濃度5-氮雜-2-脫氧胞苷(5-Aza-CdR)作用后T24細胞凋亡情況(Hoechst33528核染色,×200)
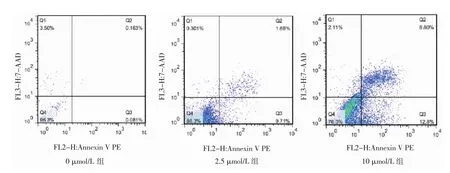
圖3 不同濃度5-氮雜-2-脫氧胞苷(5-Aza-CdR)作用后T24細胞凋亡情況(流式細胞術)
3 討論
膀胱癌的演化和進展與多種癌基因及抑癌基因異常表達有關[4]。DNA甲基化是表觀遺傳學重要的調控過程之一,可以直接改變其表觀遺傳學內容或使基因發生突變,導致抑癌基因“靜默”,從而導致腫瘤惡性轉化[5]。目前已在多種惡性腫瘤中發現MEG3啟動子存在異常甲基化的CpG島(胞嘧啶C和鳥嘌呤G富集的區域),而且這種改變可能與MEG3表達降低有關[3,6]。另有研究發現,MEG3在多種腫瘤中通過調控不同信號通路發揮抑癌作用,比如在非小細胞肺癌、胰腺癌中,MEG3可以通過激活p53引發腫瘤細胞凋亡[7]。而5-Aza-CdR是已知最強的DNA甲基化特異性抑制劑,能抑制DNA甲基化。研究表明,去甲基化可誘導MEG3重新活化和表達[8]。故本研究使用不同濃度5-Aza-CdR作用人膀胱癌T24細胞,以探討其對MEG3啟動子超甲基化逆轉及膀胱癌細胞凋亡的作用。
本研究檢測MEG3啟動子甲基化程度發現,對照組、0 μmol/L 5-Aza-CdR組T24細胞均呈現超甲基化狀態,同時MEG3啟動子甲基化程度隨著5-Aza-CdR濃度增加而下降。這說明在膀胱癌細胞中存在MEG3啟動子甲基化,而5-Aza-CdR能夠逆轉膀胱癌細胞中MEG3啟動子甲基化,其原理可能是5-Aza-CdR通過共價結合DNA甲基化轉移酶的方式來抑制DNA甲基化轉移酶的活性,從而抑制MEG3啟動子甲基化效應,使其呈去甲基化狀態。本研究繼續采用RT-qPCR檢測MEG3 mRNA表達,發現5-Aza-CdR作用后T24細胞恢復MEG3 mRNA表達,且相對表達量隨著5-Aza-CdR濃度增加而增加。這間接表明MEG3基因表達下調歸因于其啟動子超甲基化。相關研究表明,MEG3表達與腫瘤的發生呈負相關,MEG3在許多惡性腫瘤中發揮著抑癌作用[9]。為了明確MEG3恢復表達后對膀胱癌細胞產生何種效果,本研究進一步采用Hoechst33528核染色法和流式細胞術檢測T24細胞凋亡情況,結果發現5-Aza-CdR作用后T24細胞出現不同程度的凋亡,且隨著5-Aza-CdR濃度增加而凋亡程度更明顯。
綜上所述,5-Aza-CdR可能通過逆轉膀胱癌細胞中MEG3啟動子超甲基化狀態來恢復MEG3 mRNA表達,進而誘發膀胱癌細胞發生凋亡,但具體分子機制有待進一步研究證實。

