mTOR磷酸化水平對成骨細胞增殖和分化活性的影響
周哲雯,朱伊敏,王燁菠,王 萍,林函冰,李希寧
(湖州師范學院 醫學院,浙江 湖州 313000)
骨質疏松癥是一種典型的與老年相關的疾病,其核心發病機制是成骨細胞和破骨細胞的數量與活性失衡導致骨重建受損[1].成骨細胞是成骨的功能細胞,其數量增多和功能增強都可以促進骨形成.研究發現,成骨細胞功能障礙是骨質疏松的主要原因[2-3].目前預防和治療骨質疏松癥的藥物主要集中于促進成骨細胞的增殖和分化.
哺乳動物雷帕霉素靶分子(mammalian target of rapamycin, mTOR)是一個高度保守的激酶,屬于PI3K家族的一員,與細胞的生長、增殖、分化等密切相關[4].雷帕霉素對mTOR的抑制作用在體外可損傷小鼠骨髓基質細胞(BMSCs)的增殖和成骨分化,并可導致小梁狀骨的丟失[5].雷帕霉素抑制mTOR明顯阻止了Wnt7b誘導的小鼠ST2細胞分化,相反激活mTOR可以促進BMSCs向成骨細胞方向分化[6],但mTOR作用于成骨細胞的機制仍有待闡明.本研究分別利用mTOR抑制劑和激活劑改變mTOR磷酸化水平,探討mTOR磷酸化對成骨細胞的影響,為骨質疏松的防治策略提供實驗依據.
1 材料與方法
1.1 材料與試劑
α-MEM培養基、胎牛血清、磷酸緩沖鹽溶液(PBS)、胰蛋白酶(美國Thermo Fisher Scientific公司);CCK-8試劑盒、細胞周期與細胞凋亡檢測試劑盒、青鏈霉素雙抗混合液(北京索萊寶科技有限公司);mTOR、p-mTOR、ALP、Runx2、osterix抗體與引物(美國Abcam公司).
1.2 方法
(1) 細胞培養:MC3T3-E1細胞株購于中國科學院細胞庫.將MC3T3-E1細胞培養于α-MEM完全培養液中,置于37 ℃、體積分數為5%CO2的培養箱中培養;每2~3 d更換一次培養液,當細胞密度鋪滿培養皿80%以上時,用胰蛋白酶消化傳代培養至對數期.
(2) 采用細胞增殖(CCK-8)實驗檢測細胞增殖活性:將MC3T3-E1細胞接種于96孔板,培養時間為2 d;雷帕霉素濃度分別為0、20、40、60、80、100、120、140、160、180和200 nM,MHY1485濃度分別為0、0.5、1、1.5、2、4、6、8、10和12 μM,每組設8個復孔;培養結束后,每孔加入100 μL CCK-8溶液,輕微振動混勻,置于37 ℃培養箱內孵育2 h,用酶標儀測定波長為450 nm時的吸光值(A),檢測細胞增殖活性.
(3) 采用細胞周期檢測試劑盒評估細胞周期:將MC3T3-E1細胞接種于6孔板,并將其分為對照組、50 nM雷帕霉素組、150 nM雷帕霉素組、2 μM MHY1485組;培養2 d后,將MC3T3-E1細胞經胰酶消化,收集并用PBS洗滌,隨后加入70%冷乙醇于4 ℃恒溫下固定過夜;用PBS將固定液沖洗掉,加入0.4 mL PI染料和0.1 mL RNase A于37 ℃培養箱內孵育30 min;利用流式細胞儀測定DNA含量,分析細胞周期分布.
(4) 采用蛋白免疫印跡法檢測MC3T3-E1細胞中相關蛋白的表達:將MC3T3-E1細胞接種于6孔板,實驗分組同上;采用RIPA裂解液提取總蛋白,每個泳道加入15 μg蛋白后進行SDS-PAGE電泳;電泳后轉到PVDF膜,用5%脫脂奶粉封閉2 h,加入稀釋后的抗小鼠一抗于4 ℃孵育過夜,將辣根過氧化物酶標記的二抗置于37 ℃培養箱內孵育1 h,增強化學發光法(ECL)顯影,應用Gel Image System-1600凝膠成像系統采集圖像.
(5) 采用Real-time PCR檢測MC3T3-E1細胞中基因的表達:將MC3T3-E1細胞接種于6孔板,實驗分組同上;培養2 d后,采用胰蛋白酶消化收集細胞,按照Trizol試劑盒說明書提取總RNA,并用Nano-Drop分光光度計測定RNA含量;按照High-Capacity cDNAReverseTranscription Kit和Power SYBR R Green PCRMaster Mix說明書合成cDNA和PCR擴增(引物序列見表1);使用StepOnePlus System software導出循環值(Ct值),基因相對表達量采用2-(△Ct)計算.

表1 ALP、osterix和Runx2引物序列
1.3 統計學分析
采用SPSS 20.0軟件進行統計學分析.CCK-8增殖實驗OD值、細胞周期分布的組間比較采用單因素方差分析;mRNA表達量、蛋白表達量采用雙因素方差分析.檢驗水準α值取雙側0.05,P<0.05表示差異有統計學意義.
2 結 果
2.1 成骨細胞的增殖活性
用不同濃度的雷帕霉素處理MC3T3-E1細胞2 d后,發現20~140 nM雷帕霉素能夠明顯促進成骨細胞的增殖,過低或過高濃度的雷帕霉素對成骨細胞的活力無顯著影響(圖1A).根據實驗檢測結果,選擇50 nM雷帕霉素作為有效刺激組,150 nM雷帕霉素作為增殖無效組,檢測經不同濃度MHY1485處理后的成骨細胞增殖活性.結果顯示,濃度高于0.5 μM MHY1485作用于成骨細胞2 d后可明顯抑制成骨細胞的增殖,MHY1485對成骨細胞的作用呈濃度依賴性(圖1B),最終選定2 μM MHY1485作為后續實驗濃度.
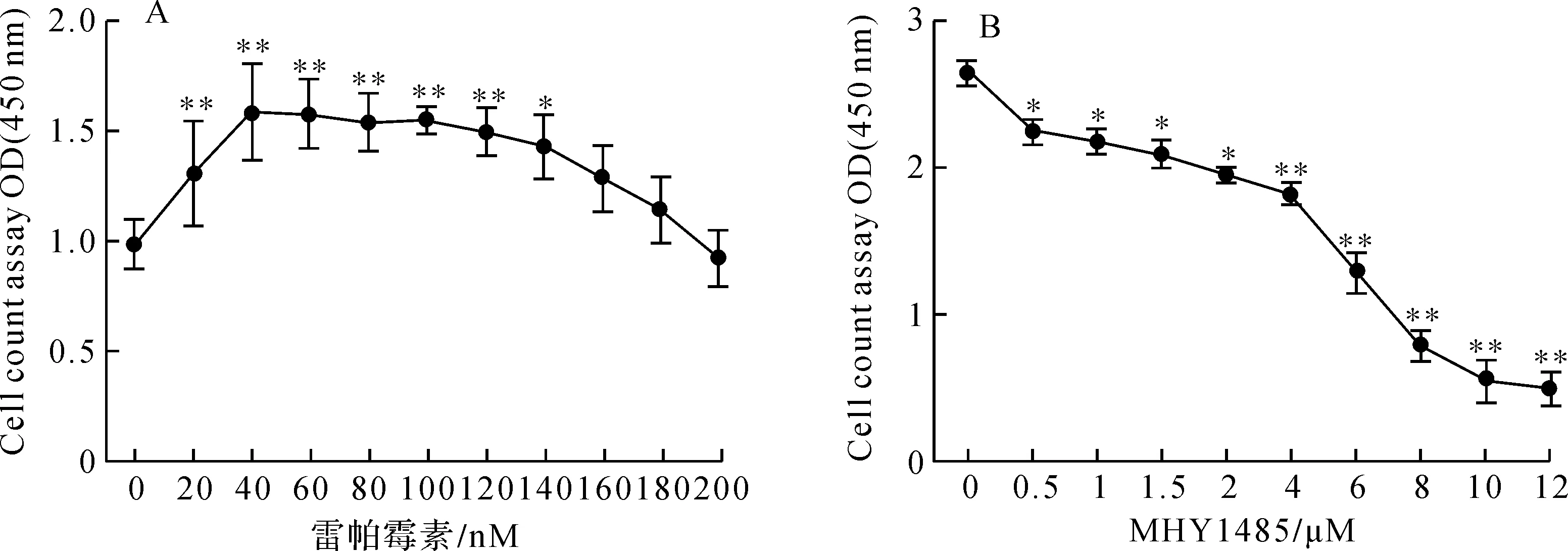
圖1 不同濃度的雷帕霉素和MHY1485對MC3T3-E1細胞增殖活性的影響Fig.1 Effects of rapamycin and MHY1485 at different concentrations on proliferative activity of MC3T3-E1 cells
2.2 mTOR磷酸化水平的變化
用50 nM和150 nM雷帕霉素作用于MC3T3-E1細胞后,發現細胞內總mTOR無變化,但p-mTOR水平明顯下降,且濃度越高對成骨細胞mTOR的磷酸化抑制作用越強,而2 μM MHY1485能明顯促進mTOR的磷酸化水平(圖2).
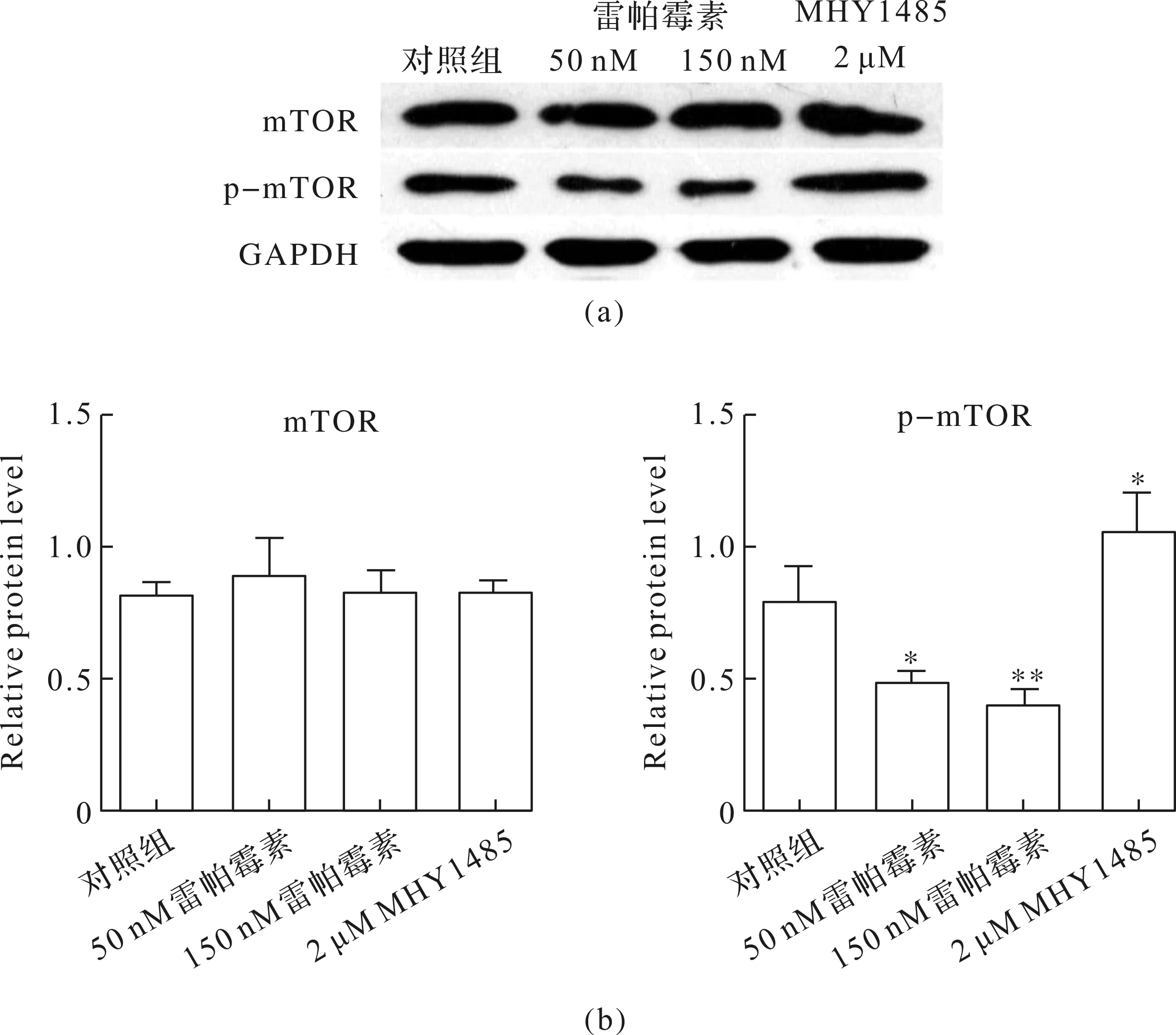
圖2 雷帕霉素和MHY1485對MC3T3-E1細胞mTOR磷酸化水平的影響Fig.2 Effects of rapamycin and MHY1485 on mTOR phosphorylation in MC3T3-E1 cells
2.3 細胞周期的變化
結果顯示,相比對照組MC3T3-E1細胞周期中G1期(76.38%)、S期(6.74%)和G2期(16.88%),經50 nM雷帕霉素誘導后,MC3T3-E1細胞周期中G1期(64.66%)的比例明顯下降,S期(15.96%)的比例明顯上升,G2期(19.38%)的比例有所上升但變化不明顯,說明50 nM雷帕霉素能夠促使細胞從DNA合成前期進入DNA合成期,從而促進成骨細胞的增殖.經150 nM雷帕霉素和2 μM MHY1485作用后,MC3T3-E1細胞周期中G1期(82.35%、81.61%)的比例有所上升,但變化不顯著,S期(12.03%、15.86%)細胞數明顯增加,G2期(5.61%、2.54%)的比例顯著下降(圖3).結果提示,高濃度的雷帕霉素能過度抑制mTOR磷酸化和MHY1485激活mTOR磷酸化,阻止成骨細胞分裂使細胞周期停留在DNA合成期,起到相似的抑制細胞增殖活性的作用.
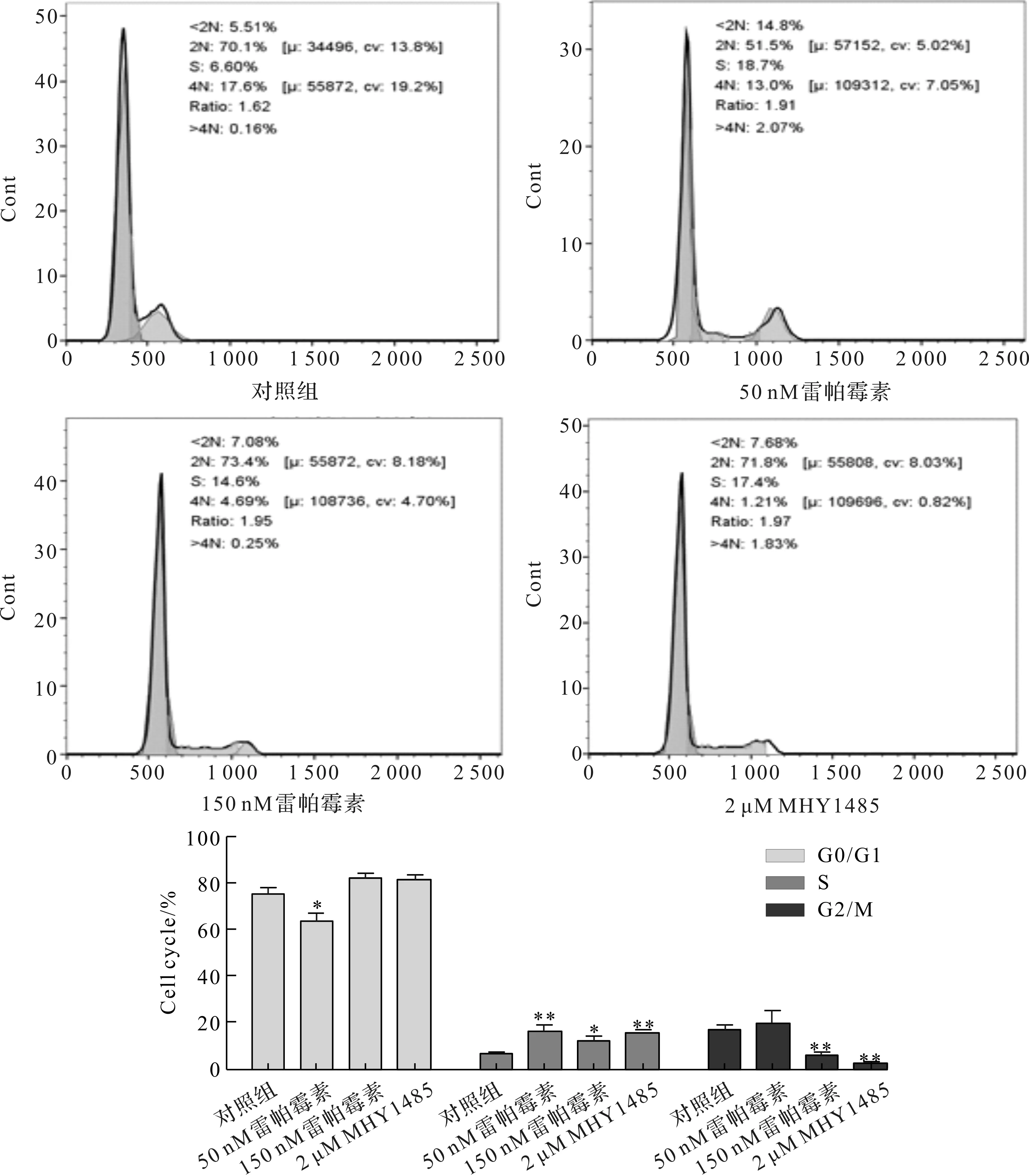
圖3 雷帕霉素和MHY1485對MC3T3-E1細胞周期的影響Fig.3 Effects of rapamycin and MHY1485 on MC3T3-E1 cell cycle
2.4 成骨細胞分化活性的變化
檢測mTOR在成骨細胞分化中的作用,采用western blot和real-time定量PCR檢測與成骨細胞分化相關的轉錄因子ALP、osterix和Runx2的表達.結果顯示,不同濃度的雷帕霉素對成骨細胞的作用不同,50 nM雷帕霉素明顯誘導ALP和Runx2的表達,但osterix的變化不明顯,在150 nM雷帕霉素作用下,ALP和osterix的表達顯著升高,但Runx2的變化不明顯,說明其不同程度地抑制了mTOR的磷酸化水平,可能通過不同方式影響成骨細胞的分化功能.2 μM MHY1485顯著抑制了osterix的基因和蛋白水平,ALP的基因水平明顯降低,蛋白表達變化不顯著,對Runx2的影響不大(圖4和圖5).上述結果表明,降低mTOR的磷酸化水平,可以適當增強成骨細胞的早期分化功能,激活mTOR則可抑制成骨細胞的分化.
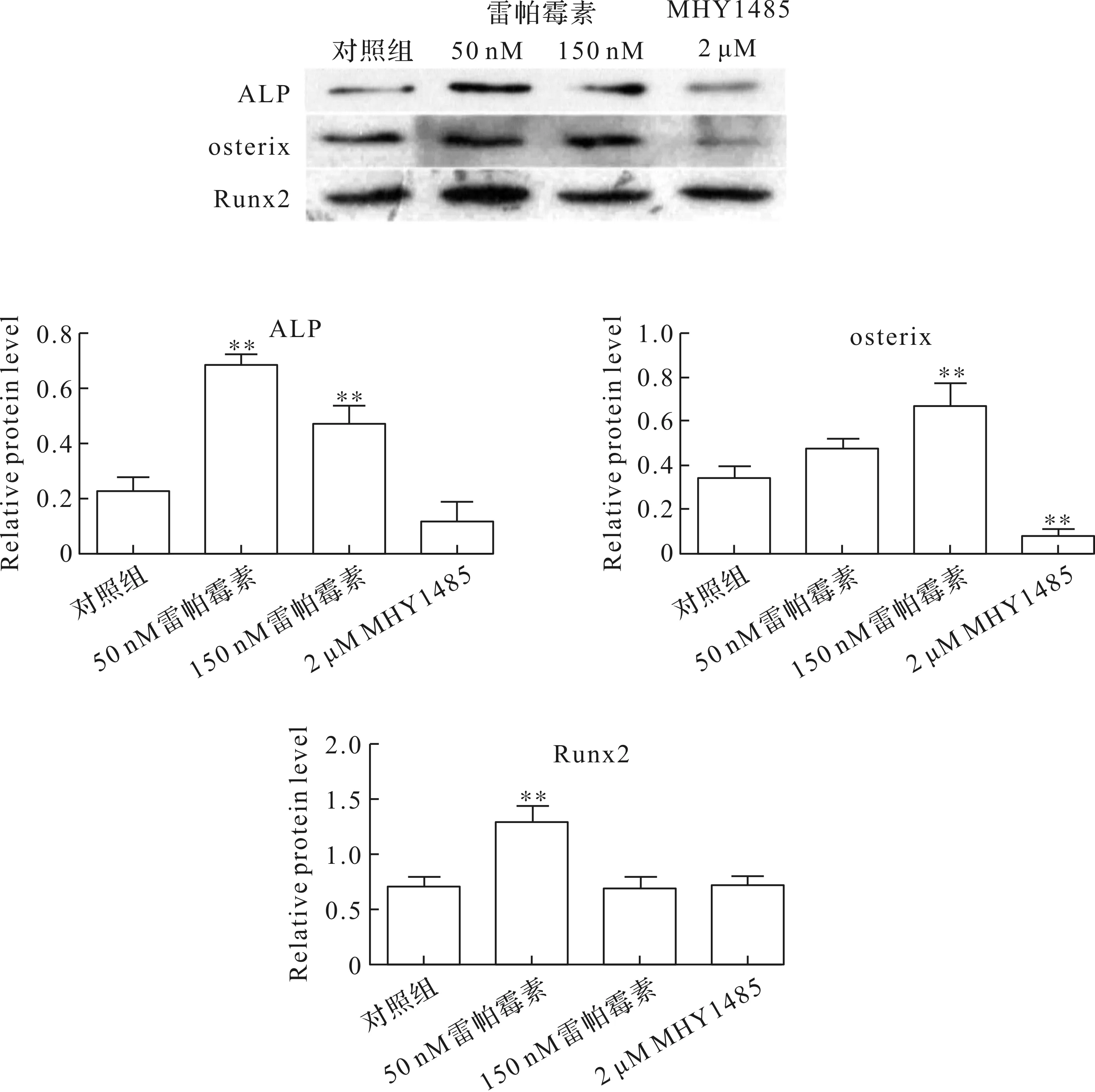
圖4 蛋白水平分析雷帕霉素和MHY1485對MC3T3-E1細胞分化能力的影響Fig.4 Protein level analysis of the effects of rapamycin and MHY1485 on the differentiation ability of MC3T3-E1 cells
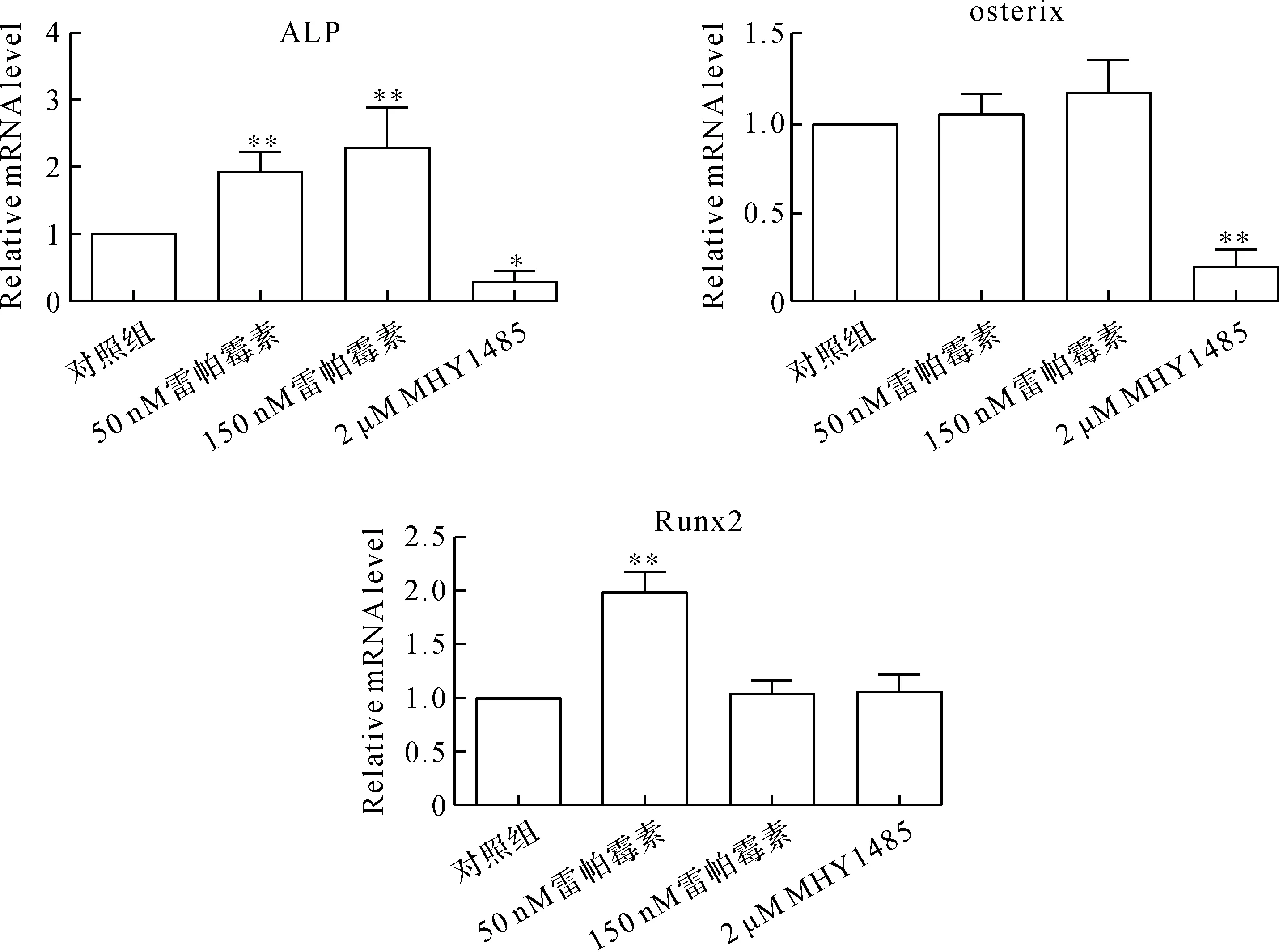
圖5 基因水平分析雷帕霉素和MHY1485對MC3T3-E1細胞分化能力的影響Fig.5 Gene level analysis of the effects of rapamycin and MHY1485 on the differentiation ability of MC3T3-E1 cells
3 討 論
mTOR是細胞對抗氧化應激和細胞存活的重要調節因子之一,可以被MHY1495激活,以維持線粒體功能[7].成骨細胞是骨形成的重要功能細胞,可以產生細胞外基質蛋白和基質礦化調節因子,參與早期骨形成和晚期骨重建.體外研究表明,成骨樣細胞自噬的藥理學誘導可降低其氧化應激,抑制細胞凋亡[8].
本研究結果顯示,適宜濃度的雷帕霉素能夠通過抑制mTOR磷酸化促進成骨細胞的增殖,而高濃度的雷帕霉素對成骨細胞的增殖作用呈下降趨勢.MHY1485雖能促進mTOR磷酸化,但抑制了骨細胞的增殖.進一步分析細胞周期發現,適宜濃度的雷帕霉素能夠促進細胞從DNA合成前期進入DNA合成期,促進成骨細胞的增殖;高濃度的雷帕霉素能夠過度抑制mTOR磷酸化和MHY1485激活mTOR磷酸化,阻止成骨細胞分裂使細胞周期停留在DNA合成期,起到相似的抑制細胞增殖活性的作用.
成骨細胞分化標志物ALP、osterix和Runx2均可作為骨轉化的標記蛋白,與骨吸收、骨形成和骨礦化密切相關[9-10].ALP是骨形成的血清標志物,與成骨細胞和破骨細胞活性的變化有關.Osterix是與成骨細胞分化和骨形成有關的轉錄因子,只在發育的骨組織中特異性表達.Runx2是一種轉錄因子,能誘導不成熟骨細胞向成熟的成骨細胞分化過程中起重要作用的轉錄因子Sp7,Sp7和經典Wnt信號轉導將骨祖細胞直接分化為成骨細胞,從而抑制軟骨細胞分化[11].本研究結果顯示,ALP、osterix和Runx2的變化與mTOR磷酸化水平相反,當適宜濃度的雷帕霉素抑制mTOR磷酸化時,ALP、osterix和Runx2的表達明顯增強,MHY1495能夠促進mTOR磷酸化,從基因和蛋白水平降低ALP和osterix的表達,對Runx2無明顯改變.
mTOR通過對各種骨相關細胞的活性、功能進行調控,從而影響骨代謝過程,其中涉及多種信號分子的調節,在骨組織代謝過程中起到重要作用.然而,研究顯示mTOR磷酸化的抑制并不完全有利于骨量調節,接近極值的水平可能會影響細胞的基礎功能,從而呈現相反的結果,且細胞生長、分化在不同階段的自噬水平也不一致.本研究通過體外實驗數據發現,適宜濃度的雷帕霉素能夠通過抑制mTOR,增強成骨細胞的增殖活性和分化能力,而過度抑制或激活mTOR磷酸化則會誘導成骨細胞凋亡,減弱細胞分化功能.此外,有必要進行進一步的臨床研究,以確認mTOR和骨質疏松癥之間可能存在的關系,進一步研究未來預防和治療骨質疏松癥的治療方法.

