泰國斗魚Dmrt1基因的部分cDNA克隆及表達分析
黃 洋,黎金海,王文基,郭煜文,李廣麗,陳華譜
( 廣東海洋大學 水產學院,廣東省名特優魚類生殖調控與繁育工程技術研究中心,廣東 湛江 524088 )
泰國斗魚(Bettasplendens),屬脊索動物門、硬骨魚綱、鱸形目、攀鱸亞目、絲足鱸科、斗魚亞科、斗魚屬,又稱五彩搏魚。泰國斗魚原產于泰國、馬來西亞、新加坡等,雄性泰國斗魚色彩艷麗、體形多姿、環境適應能力強、容易飼養,這些特點使其成為備受青睞的觀賞魚品種。提高泰國斗魚生產過程中的雄性比例可以有效提高其產業效益,因此開展泰國斗魚性別控制研究,提高雄性率具有十分重要的生產指導意義。
Doublesex和Mab-3相關轉錄因子(DMRT)是一類與性別決定和分化相關的基因家族總稱。已有研究表明,該基因家族廣泛參與多種生物的性別發育過程,其編碼產物與果蠅的doublesex基因和線蟲的mab-3基因編碼的產物具有高度的一致性,都含有一個DM結構域,并且通過鋅指結構與特異的DNA序列結合,調節目的基因轉錄,進而調控性別的決定和分化[1]。Doublesex和Mab-3相關轉錄因子1(Dmrt1)是DMRT家族成員之一,該基因在哺乳類[2]、鳥類[3]、爬行類[4]及兩棲類[5]動物中相繼被發現,研究表明,其在性別分化期的雄性性腺及雄性成體的精巢中特異性表達,在雞的基因中存在著Dmrt1基因的同源基因,而且該基因被定位于Z染色體上,經驗證與雞的性別分化具有較大的關聯[3,6]。多種硬骨魚類的Dmrt1基因相繼被克隆,如尼羅羅非魚(Oreochromisniloticus)[7]、奧利亞羅非魚(O.aureus)[8]、黑鯛(Acanthopagrusschlegelii)[9]、半滑舌鰨(Cynoglossussemilaevis)[10]、斑馬魚(Daniorerio)[11]、大鱗副泥鰍(Paramisgurnusdabryanus)[12]和褐牙鲆(Paralichthysolivaceus)[13]等魚類,同樣證實該基因對于雄性性腺的形成和功能維持具有重要作用。
目前Dmrt1基因在泰國斗魚中的功能研究尚未見報道,筆者利用RACE技術,克隆出Dmrt1基因的cDNA序列,并開展序列分析、組織分布及其在胚胎發育階段的表達分析,為闡明Dmrt1基因在泰國斗魚中的生理功能和泰國斗魚雄性化技術的研發提供參考。
1 材料與方法
1.1 試驗魚及試劑
試驗用泰國斗魚購于廣東省湛江市霞山區花鳥市場,運回實驗室后暫養在循環水系統(上海海圣),日投喂3次,暫養7 d后開始試驗。
總RNA提取試劑使用TRIzol?Reagent(Life, USA),DNase Ⅰ去除基因組,采用The ReverTra Ace-αfirst-strand cDNA Synthesis Kit試劑盒(TOYOBO,Japan)進行反轉錄。Smart-RACE試劑盒(Takara,Japan),2×PCR Mix [天根生化科技(北京)有限公司];其余化學試劑均為國產試劑(分析純)。
1.2 方法
1.2.1 引物設計
從泰國斗魚轉錄組中獲得泰國斗魚Dmrt1基因的部分序列,設計克隆泰國斗魚Dmrt1基因的開放閱讀框(ORF)序列。引物設計利用Primer Explorer軟件。試驗所需引物見表1。
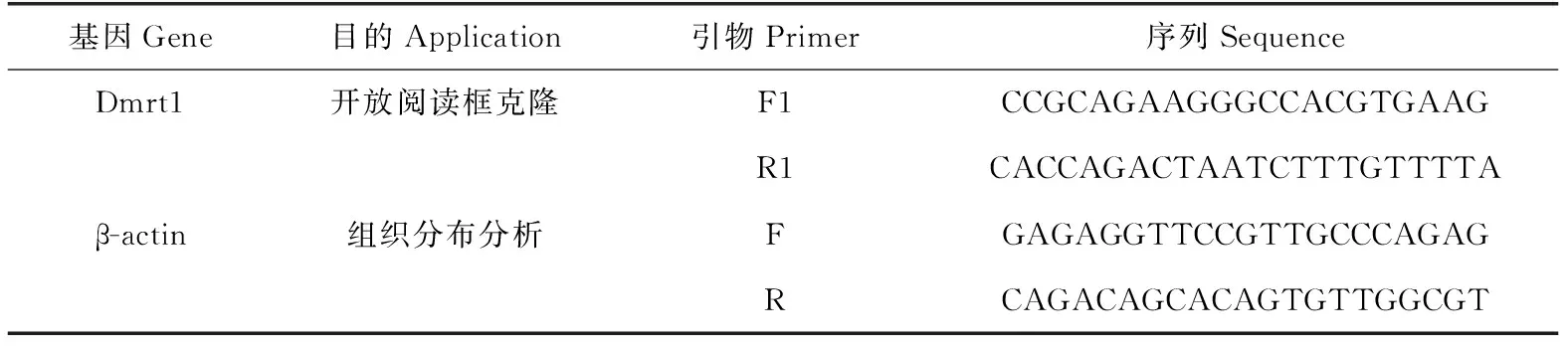
表1 泰國斗魚Dmrt1基因的克隆與定量分析中所用引物
1.2.2 總RNA抽提
首先將泰國斗魚置于冰上,經過深度麻醉后取樣,根據TRIzol?Reagent試劑盒(Life,USA)說明書操作,對泰國斗魚的腦、垂體、性腺、心臟、肝臟、腎臟、脾臟、腸道和肌肉提取總RNA。于-80 ℃冰箱中取出凍存的樣品約50~100 mg,加入1 mL TRIzol?Reagent,利用注射器將各組織充分勻漿,室溫靜置5 min,令細胞裂解。隨后轉入1.5 mL離心管中,加入200 μL氯仿抽提,劇烈振蕩15 s,室溫靜置15 min,使溶液分層。隨后將離心管置于冰凍離心機中,在4 ℃,12 000 r/min條件下,離心15 min。離心后將上清液轉移至另一1.5 mL離心管中,加入500 μL異丙醇,充分振蕩混勻溶液,室溫靜置5~10 min,隨后將該離心管置于離心機中,在4 ℃、12 000 r/min下,離心10 min。離心后去除上清液,加入1 mL 70%乙醇,充分振蕩洗滌沉淀物。再將離心管置于離心機中,4 ℃、12 000 r/min離心5 min,去除上清液。干燥約5 min后,加入適量DEPC溶液溶解RNA。在提取總RNA后利用核酸測定儀和瓊脂糖凝膠電泳進行濃度與完整度的檢測。
1.2.3 分子克隆
以泰國斗魚全腦的總RNA作為模板,根據反轉錄試劑盒(Takara,Japan)的操作步驟,取RNA樣品2 μg于1.5 mL離心管中,補加DEPC溶液至8 μL,加入DNA酶Buffer 1 μL,隨后置于PCR儀上,37 ℃,30 min去除基因組污染,程序結束后加入DEPC 1 μL,在70 ℃下,運行10 min,結束后將離心管立即置于冰上。加入oligo (dT) 2 μL,M-MLV 5× Buffer 5 μL,dNTP 1.25 μL,M-MLV反轉錄酶1 μL,DEPC溶液4.75 μL,隨后置于PCR儀上,在42 ℃下,運行1 h,反轉錄出全腦的cDNA。通過RACE技術,克隆出部分序列并送生工生物工程(上海)股份有限公司廣州分公司進行測序,利用DNAMAN軟件對測序結果進行序列重合拼接,獲得cDNA序列。 然后設計開放閱讀框全長特異引物進行驗證。
1.2.4 組織分布
以反轉錄獲取的cDNA為模板利用泰國斗魚Dmrt1基因的特異引物,進行Dmrt1基因在各組織中的半定量PCR檢測,并以β-actin基因作為半定量PCR檢測的內參。反應體系為25 μL:上下游引物各0.5 μL,2×PCR Mix 12.5 μL,cDNA模板2 μL,ddH2O 9.52 μL。循環反應條件為:94 ℃預變性4 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1 min,35個循環;72 ℃延伸10 min。取8 μL的PCR產物,進行1.5%的瓊脂糖凝膠電泳檢測。
1.2.5 熒光定量PCR
以泰國斗魚各個胚胎發育時期的總RNA反轉錄出的cDNA作為模板,構建β-actin基因標準樣品,將內參β-actin按10倍的濃度梯度逐級稀釋,建立標準樣品的標準曲線。利用Dmrt1上游引物F和下游引物R,反轉錄cDNA作為待測樣品。嚴格按照SYBR Green Realtime PCR Master Mix (TOYOBO,Japan)試劑盒說明書反應體系,用Bio-Rad Light Cycler 480 real time PCR system 進行熒光定量PCR,每個待測樣品重復測定3次。反應體系為25 μL:上下游引物各0.5 μL,2×PCR Mix 12.5 μL,cDNA模板2 μL,ddH2O 9.52 μL。循環程序為:95 ℃預變性1 min;95 ℃變性5 s,55 ℃退火10 s,72 ℃延伸20 s,84 ℃收集熒光10 s,40個循環。根據標準樣品的標準曲線相對應的域值從而獲得cDNA拷貝數。獲得的數據采用SPSS 18.0進行統計分析。
2 結果與分析
2.1 泰國斗魚Dmrt1基因的序列分析
克隆的泰國斗魚Dmrt1基因cDNA序列為1037 bp,共編碼337個氨基酸(圖1)。利用ORF Finder在線工具預測開放閱讀框(ORF)為62~860 bp,共798 bp,編碼265個氨基酸殘基。使用SMART在線預測,該序列中含有1個與DNA結合的DM結構域和1個A20樣的鋅指結構位點,無信號肽。利用Softberry在線預測工具,預測Dmrt1基因的氨基酸序列的其他功能位點,結果顯示,其含有N端糖基化位點、磷酸化蛋白激酶C位點、磷酸化酪蛋白激酶Ⅱ位點和N端酰基化位點等多個功能位點(表2)。

圖1 泰國斗魚Dmrt1 開放閱讀框序列及推導的氨基酸序列Fig.1 ORF sequences and predicted amino acid sequences of Dmrt1 gene in Siamese fighting fish B. splendens
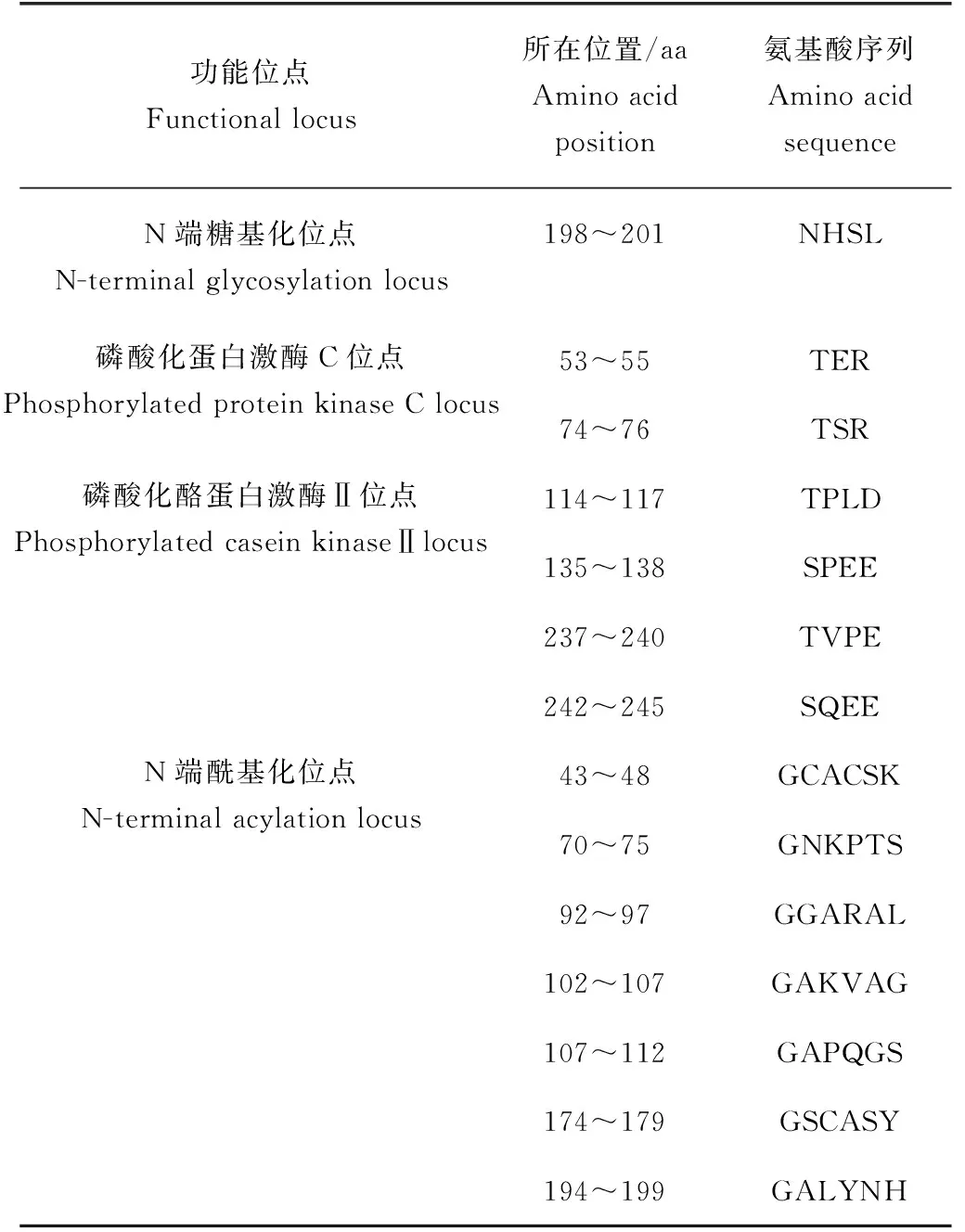
表2 Dmrt1氨基酸序列中的功能位點
2.2 泰國斗魚Dmrt1的系統進化樹分析
對泰國斗魚的Dmrt1基因進行同源性檢測顯示,與龜殼攀鱸(Anabastestudineus)同源性最高。通過美國國立生物技術信息中心數據庫將泰國斗魚的Dmrt1基因序列進行BLAST分析,再使用MEGA 5.0建立鄰接系統進化樹(圖2)。通過分析發現,泰國斗魚與龜殼攀鱸關系最近,大刺鰍(Mastacembelusarmatus)、黃鱔(Monopterusalbus)、白梭吻鱸(Sanderlucioperca)和盲曹魚(Latescalcarifer)同屬另外一支,泰國斗魚和它們關系較近,但與人類(Homosapiens)、小家鼠(Musmusculus)關系較遠。
2.3 泰國斗魚Dmrt1基因組織表達
Dmrt1基因在雌、雄的組織表達中存在明顯的差異(圖3)。在雄性中,該基因只在性腺和脾臟表達,其他組織不表達,并且在性腺中表達量最高;在雌性中Dmrt1基因主要在腦、垂體、心臟、脾臟和肌肉表達,在腎臟和腸道中有微弱的表達,在性腺和肝臟中未檢測到表達。無論在雌性或者雄性個體中,都有明顯的組織表達差異。Dmrt1基因在雄性性腺中表達量在一個較高的水平。
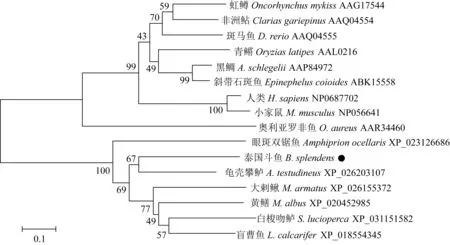
圖2 不同脊椎動物Dmrt1氨基酸系統進化樹Fig.2 Phylogenetic tree of Dmrt1 amino acid sequences in different vertebrates節點上的數字表示重復1000次的自展(Bootstrap)檢驗置信值.The numbers on the node is the exhibition (Bootstrap) test confidence value by repeated 1000 times.
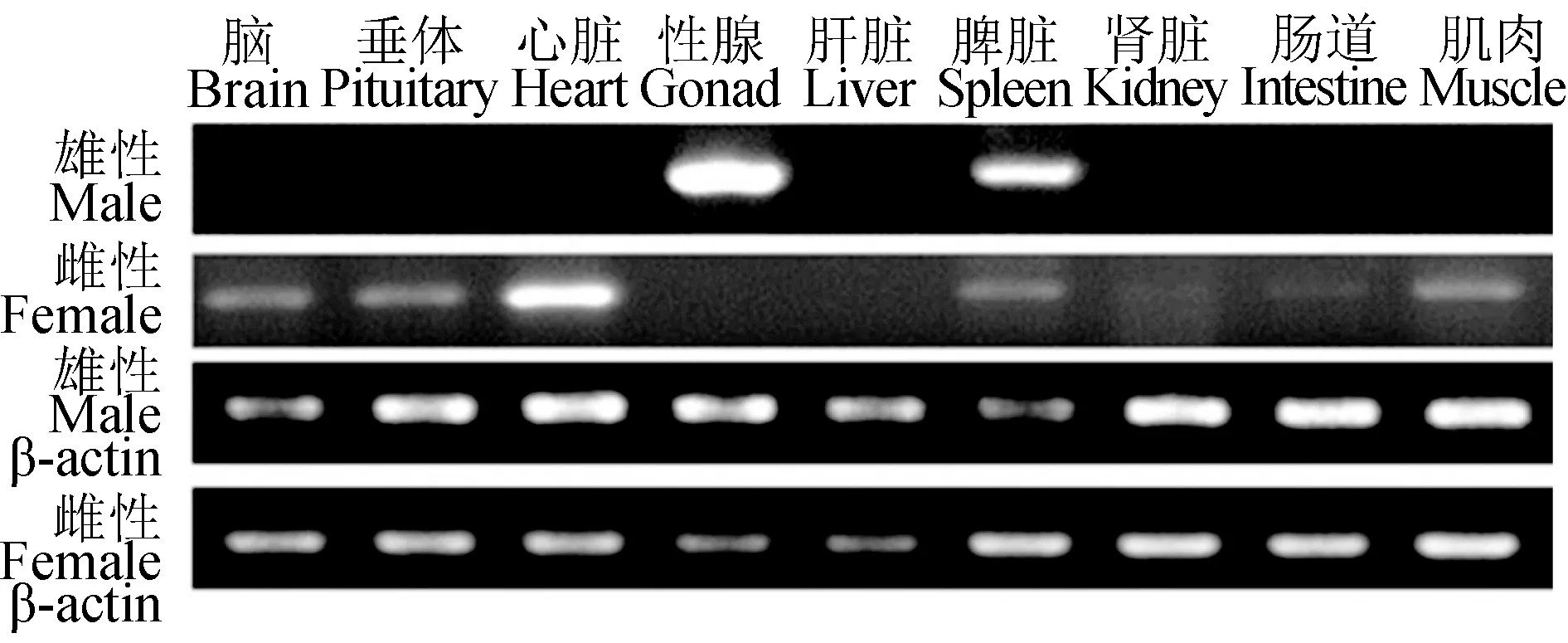
圖3 泰國斗魚Dmrt1在不同組織中的表達Fig.3 Expression profile of the Dmrt1 gene in various tissues of Siamese fighting fish B. splendens
2.4 Dmrt1基因在泰國斗魚胚胎不同發育時期的表達
根據熒光定量結果顯示(圖4),泰國斗魚Dmrt1基因在早期胚胎發育過程中自受精卵起一直到孵化期均有表達,Dmrt1基因在受精卵中的表達量顯著高于其他各發育時期,在卵裂期到桑葚期表達量較低,在囊胚期表達量顯著上升,隨后表達量下降,在原腸胚至心跳期表達量維持在較低的水平,在孵化期Dmrt1基因的表達量再次顯著上升。
3 討 論
3.1 泰國斗魚Dmrt1結構分析
Dmrt1基因參與果蠅、線蟲、脊椎動物以及魚類的性別決定過程,在Dmrt1基因序列中存在保守區域DM結構域,并且均含有與特異DNA結合的鋅指結構,在泰國斗魚的Dmrt1基因中也存在DM結構域和鋅指結構,通過序列比對,泰國斗魚的Dmrt1基因與其他魚類的Dmrt1基因基本結構一致,并具有進化保守性。
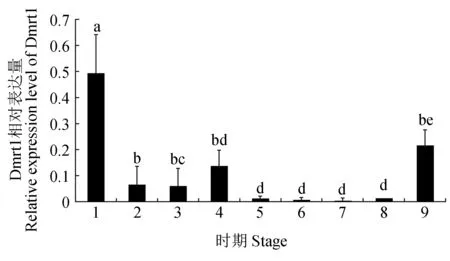
圖4 胚胎發育過程中泰國斗魚Dmrt1的表達Fig.4 Expression of Dmrt1 at different development stages of embryo in Siamese fighting fish B. splendens 1.受精卵; 2. 8細胞期; 3.桑葚期; 4.低囊胚期; 5.原腸胚期; 6.眼囊期; 7.尾芽期; 8.心跳期; 9.孵化期.1.fertilized eggs; 2.eight cell stage; 3.morula stage;4.late blastula stage; 5.gastrula stage; 6.optic capsule stage;7.tail bud stage; 8.heartbeating stage; 9.hatching period.
3.2 Dmrt1基因的表達模式及功能
Kobayashi等[14]在研究Dmrt1基因在青鳉性腺分化中的表達位點和表達形式時發現,Dmrt1能夠調控精原細胞的分化。在半滑舌鰨[15]的成年魚中,Dmrt1基因只在雄性精巢中有特異表達,在其他組織均無表達。Guan等[16]在尼羅羅非魚的精巢中分離出了Dmrt1基因,組織特異性表達檢測Dmrt1基因只在成體精巢中表達,用雄激素處理遺傳上XX型幼魚,使其發生性逆轉,結果發現,性腺中也有Dmrt1基因表達。李法君等[17]研究表明,Dmrt1基因在青鳉、比目魚(Cleisthenesherzensteini)和半滑舌鰨3種魚類的性腺發育過程中均發揮著重要作用。Huang等[18]發現Dmrt1基因在黃鱔組織中表達具有特異性,主要在精巢、精卵巢和卵巢,即生殖細胞中表達。Kobayashi等[19]發現,在雌、雄異體的尼羅羅非魚中,Dmrt1基因主要在輸精管中的支持細胞、上皮細胞中表達。這也說明Dmrt1基因的表達存在組織特異性,可能與性別的發育存在一定的聯系。本試驗中,Dmrt1基因在泰國斗魚的表達與上述的組織表達情況基本相似,說明Dmrt1基因在泰國斗魚中也存在組織表達特異的情況,并且與雄性的發育或精子形成存在某種聯系。
在Dmrt1基因研究中,存在一種劑量假說。雞Dmrt1基因研究顯示,Dmrt1基因在雄性中的高劑量或高表達量開啟性腺的睪丸發育,而在雌性中的低劑量或者低表達量開啟性腺的卵巢發育[20]。暗示Dmrt1基因在雞中的表達量直接影響其性別的分化。小鼠Dmrt1基因功能的研究顯示,Dmrt1基因決定了睪丸支持細胞的分化、生殖細胞的輻射狀遷移、生殖細胞減數分裂和曲精細管的形成[21]。這也意味著Dmrt1基因在小鼠的性別分化上起著重要的作用,可能決定著雄性的發育。
Dmrt1基因在黃河鯉(Cyprinuscarpio)[22]、河川沙塘鱧(Odontobutispotamophilus)[23]和香魚(Plecoglossusaltivelis)[24]不同胚胎時期均有表達,其表達量隨著胚胎發育呈先升后降的趨勢,在原腸胚時期達到峰值。同樣Dmrt1 基因在泰國斗魚各胚胎發育過程均有表達,推測該基因在泰國斗魚胚胎發育過程中扮演著重要角色,在各時期表達結果相類似,同樣先升后降,但其在囊胚期表達量顯著上升,這與斜帶石斑魚(Epinepheluscoioides)[25]的表達結果一致,在硬骨魚中,原始生殖細胞(PGCs)最早發現于原腸胚時期,且原腸期與原始生殖細胞的產生有關[26-27],推測該基因在囊胚期高表達可能為形成生殖細胞做好準備,泰國斗魚Dmrt1基因在孵化期呈現高表達量,推測該基因可能參與器官的形成,在受精卵有很高的表達量可能來自父本精液的殘存。
4 結 論
本試驗克隆的泰國斗魚Dmrt1基因所編碼的蛋白序列有典型的Dmrt1基因結構特征,進化上與龜殼攀鱸Dmrt1基因同源性高。組織分布和胚胎發育過程中的表達模式表明,Dmrt1基因可能在調控泰國斗魚雄性個體的生殖發育和胚胎發育過程中發揮著重要作用,Dmrt1基因與泰國斗魚的性腺分化是否有關,以及具體調控機制有待進一步研究。

