無凝集活力花蕓豆α-淀粉酶抑制劑提取物的制備及其對主食eGI的影響
汪云吉,劉麗婭,佟立濤,李言,錢海峰,周素梅,王立*
1(江南大學 食品學院,江蘇 無錫,214122)2(中國農業科學院農產品加工研究所,北京,100193)
蕓豆,學名菜豆(PhaseolusvulgarisLinn.sp),屬豆科(Leguminosae)菜豆屬(Phaseolus),是一年生草本植物的籽粒[1]。我國蕓豆種植面積在世界范圍內排名第三[2],年總產量約8~9 萬t,主要分布在黑、蒙、冀、晉、甘、新、川、滇、黔等地[3]。蕓豆中蛋白質含量為17.91%~22.03%,脂肪含量為2.56%~8.46%,總糖含量4.50%~5.42%[4],并且含有豐富的維生素與礦物質[5]。
1945年,BOWMAN[6]首次在蕓豆中發現α-淀粉酶抑制劑(α-amylase inhibitor,α-AI),α-AI是一種糖蛋白[7],可與淀粉酶形成復合物,從而有效抑制其活性[8],阻礙碳水化合物水解與消化,進而降低血糖水平[9],可作為降糖控糖食品的原料。蕓豆α-AI純品提取過程復雜、周期長、成本高[10],其水提物提取簡單,對α-淀粉酶也具有較強的抑制效果,但其中存在凝集素[9],會促使紅細胞凝集,引起小腸表面絨毛細胞病變,影響消化吸收,進而對機體免疫功能造成損害[11]。目前常用降低凝集素活力的方法有熱處理[12]、超高壓處理[13]、輻照處理[12]以及調控pH[14]等。其中超高壓與輻照處理成本較高,且無法完全去除;而熱處理及調控pH在去除凝集素活力的同時,也將蕓豆α-AI活力完全去除[15],無法在保留提取物α-淀粉酶抑制活力的同時去除凝集活力。
針對目前存在的問題,本研究計劃通過在控制pH與溫度等條件時,同時添加蛋白酶,在最大程度保留提取物α-淀粉酶抑制活力并去除凝集活力。以花蕓豆為原料,α-淀粉酶抑制率與凝集活力為指標,在篩選出最佳用酶的基礎上,優化提取物的制備工藝。另外,研究了提取物對日常主食估計血糖生成指數(estimated glycemic index,eGI)的影響。
1 材料與方法
1.1 材料與試劑
花蕓豆由國家現代農業產業技術體系食用豆體系提供;面包、米飯、白饅頭及玉米饅頭,當地超市;2%兔血紅細胞,上海源葉生物科技有限公司;3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)、菠蘿蛋白酶、木瓜蛋白酶、酸性蛋白酶,北京索萊寶生物有限公司;中性蛋白酶、堿性蛋白酶,日本天野酶制品株式會社;α-淀粉酶、胃蛋白酶、胰蛋白酶,美國Sigma公司。
1.2 儀器與設備
CT410旋風式樣品磨,福斯賽諾分析儀器(蘇州)有限公司;SP-Max 2300A光吸收型全波長酶標儀,上海閃譜生物科技有限公司;LUX-24數顯恒溫水浴鍋,北京陸希科技有限公司;LXJ-ⅡB低速大容量多管離心機,上海安亭科學儀器廠。
1.3 實驗方法
1.3.1 花蕓豆粗提物的制備與工藝優化
將經旋風磨磨粉,過60目篩后的花蕓豆粉與去離子水以料液比1∶5(g∶mL)的比例混合,室溫下攪拌提取2 h,8 000 r/min離心30 min,收集上清液,隨后分別加入菠蘿蛋白酶、木瓜蛋白酶、酸性蛋白酶、中性蛋白酶和堿性蛋白酶,根據各蛋白酶最適條件反應1 h,以α-淀粉酶抑制活力與凝集活力為指標確定最佳酶。
以凝集活力與α-淀粉酶抑制率為指標,進行時間(30、60、90、120、150 min)、pH(2、2.5、3、3.5、4)、溫度(30、40、50、60、70 ℃)和酶底比(500、1 000、1 500、2 000、2 500 U/g)單因素試驗,因為本實驗主要目的是制得無凝集活力的花蕓豆提取物,因此在單因素試驗的基礎上,以去除凝集活力為主要目的,兼顧α-淀粉酶抑制率進行L9(34)正交試驗。
1.3.2 α-淀粉酶抑制率測定
α-淀粉酶抑制率的測定參考YANG等[16]的方法稍作修改。將0.25 mL豬胰α-淀粉酶溶液(1.5 U/mL)和0.25 mL適當稀釋的蕓豆提取液在37 ℃水浴中孵育10 min,加入10 g/L可溶性淀粉0.25 mL,準確反應5 min后立刻加入1.0 mL DNS溶液終止反應。將混合物置于沸水浴中10 min,隨后在冰浴中冷卻至室溫,用5 mL去離子水稀釋后在540 nm波長處測定吸光度。
1.3.3 凝集活力測定
凝集活力的測定參考HE等[17]的方法稍作修改。在96孔“V”型板的每1孔中加入50 μL 磷酸緩沖鹽溶液(10 mmol/L,pH 7.4),在第1孔加入提取液,混勻后取出50 μL加入第2孔,混勻,以此類推,倍比稀釋,第12孔取出50 μL溶液棄去,最后在各孔中加入2%兔血紅細胞50 μL,4 ℃條件下靜置2 h后觀察血凝結果。凝集活力按公式(1)計算:

(1)
式中:n,96孔“V”型板中顯示血凝的最高孔數,n=0表示無凝集活力;ρ,樣品蛋白質量濃度,mg/mL,V,添加到每孔的樣品體積,mL。
1.3.4 總淀粉含量測定
采用Megazyme assays Kit(K-TSTA)試劑盒法測定。
1.3.5 蛋白濃度的測定
采用LORRY法[18],以牛血清蛋白為標準蛋白。
1.3.6 模擬胃腸道處理對提取物α-淀粉酶抑制率的影響
模擬胃腸處理主要參考讓一峰等[19]的方法稍作修改。將經過處理后的提取物于37 ℃金屬浴中振搖,用1 mol/L HCl溶液調節pH至2并加入胃蛋白酶來模擬胃環境,用1 mol/L NaOH溶液調節pH至8.2并加入胰蛋白酶來模擬腸環境。各反應120 min后回調溫度與pH,測定其對α-淀粉酶的抑制率。
1.3.7 血糖生成指數的測定
按照FERRER-MAIRAL等[20]的方法測定血糖生成指數,并做了適當修改。準確稱取樣品(含淀粉50 mg),添加花蕓豆提取物,添加α-淀粉酶,于37 ℃金屬浴中振搖2 min,調節pH至2,加入胃蛋白酶,37 ℃金屬浴中振搖60 min,中和調節pH,加入α-淀粉酶與胰蛋白酶,在0、10、20、30、60、90、120、180、240 min處取樣,沸水浴5 min滅酶活性后離心,取上清液進行葡萄糖含量測定。參考GOI等[21]的方法建立非線性模型,淀粉水解動力學按公式(2)計算:
C=C∞×(1-(exp-kt))
(2)
式中:C,C∞,k分別表示各時間點的淀粉水解率、最終水解率和動力學常數。水解指數(HI)為樣品的水解曲線的面積與葡萄糖相應面積的百分比。估計血糖生成指數按公式(3)[22]計算:
eGI=0.862×HI+8.198
(3)
1.3.8 數據分析
實驗重復3次,數據為平均值±標準偏差。使用SPSS 21.0軟件進行顯著性分析,使用Origin 2018進行做圖。
2 結果與分析
2.1 不同蛋白酶對蕓豆提取物α-淀粉酶抑制活力和凝集活力的影響
不同蛋白酶處理結果見表1。在α-淀粉酶抑制活力方面,菠蘿蛋白酶、木瓜蛋白酶與中性蛋白酶對提取物抑制活力無顯著影響(P>0.05),且凝集活力保留超過95%;堿性蛋白酶處理后,提取物抑制率保留率為80.30%,凝集活力保留超過90%;酸性蛋白酶處理效果較好,提取物α-淀粉酶抑制率保留率為85.89%,推測活力降低的主要原因是酸性環境與溫度的協同作用[15],凝集活力降低至6.97%,原因可能是酸性蛋白酶在酶解凝集素的同時,pH對溫度誘導的凝集素的失活也具有協同效應[23]。因此,選擇酸性蛋白酶進行后續研究。
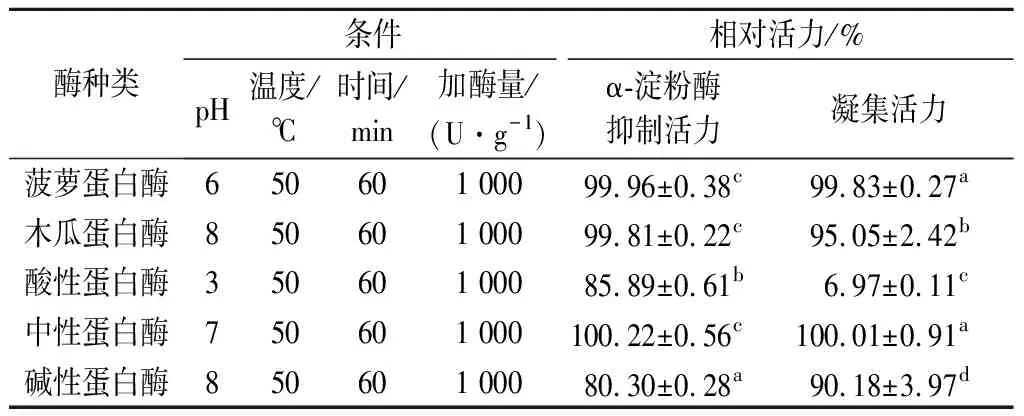
表1 不同蛋白酶對花蕓豆提取物α-淀粉酶抑制活力與凝集活力的影響
2.2 花蕓豆α-淀粉酶抑制提取物制備工藝優化
2.2.1 pH的影響
在溫度50 ℃、時間60 min、加酶量1 000 U/g條件下,研究了pH對花蕓豆粗提液α-淀粉酶抑制活力與凝集活力的影響,結果以相對活力表示。如圖1所示,在α-淀粉酶抑制活力方面,隨著pH在2~4范圍內升高,提取物α-淀粉酶抑制活力呈現出先下降后升高的趨勢,在pH 3.5時抑制活力保留率最低為87.53%,此時凝集活力保留11.65%。在pH 3條件下,凝集活力保留率最低僅為5.76%,這可能是因為酸與熱的協同作用會使粗提物中凝集素活力顯著降低[23],同時pH變化過程中酸性蛋白酶活力也發生改變[24]。綜合考慮,選擇處理pH值為3。

圖1 pH對花蕓豆提取物α-淀粉酶抑制活力與凝集活力的影響
2.2.2 溫度的影響
由圖2可知,在加酶量1 000 U/g、時間60 min、pH 3條件下,隨著溫度的升高,花蕓豆提取物對α-淀粉酶的抑制活力與凝集活力均呈現降低趨勢。當溫度為30 ℃,提取物抑制活力與凝集活力保留率約為90%。溫度升高至40 ℃,抑制活力變化不顯著,凝集活力保留率降低至86.06%。溫度>50 ℃時,抑制活力隨著溫度的升高顯著降低(P<0.05),這是因為蕓豆α-AI熱穩定性較低,隨著溫度的升高,活力降低[7]。當溫度達到70 ℃時,抑制活力保留81.87%。此時凝集活力保留率僅為0.16%。綜合考慮,選擇溫度為70 ℃。

圖2 溫度對花蕓豆提取物α-淀粉酶抑制活力與凝集活力的影響
2.2.3 時間的影響
在加酶量1 000 U/g、溫度50 ℃、pH 3條件下,處理時間對花蕓豆提取液α-淀粉酶抑制活力與凝集活力的影響如圖3所示。在60 min內,隨著處理時間的增加,提取液對α-淀粉酶的抑制活力呈現降低的趨勢,當時間>60 min時,抑制活力不再變化,保留率約為87.22%,此時凝集活力也趨于穩定,不再隨著時間的增加而變化,保留率約為5.51%。綜合考慮,處理時間選擇60 min。

圖3 時間對花蕓豆提取物α-淀粉酶抑制活力與凝集活力的影響
2.2.4 加酶量的影響
在溫度50 ℃、時間60 min、pH 3條件下,加酶量對花蕓豆提取液α-淀粉酶抑制活力與凝集活力的影響如圖4所示。隨著加酶量由500 U/g增加到1 000 U/g,花蕓豆提取物相對抑制活力與相對凝集活力均顯著降低,分別從95.62%和42.18%降低至87.22%和5.31%,隨著加酶量的進一步增加,相對抑制活力與相對凝集活力均不再變化,這是因為當底物分子與酶分子百分之百結合的時候,再增加酶的用量也不會對反應造成顯著影響[25]。綜合考慮,選擇加酶量為1 000 U/g。

圖4 加酶量對花蕓豆提取物α-淀粉酶抑制活力與凝集活力的影響
2.3 正交試驗結果
綜合單因素試驗結果,以相對凝集活力為指標,進行正交試驗,結果如表2所示。可以得出去除凝集活力的最佳條件為A1B3C3D2,即pH 2.5、溫度70 ℃、時間90 min、加酶量1 000 U/g。

表2 正交試驗設計及結果
進行驗證試驗,發現此時血凝板中未出現血凝現象(n=0),即相對凝集活力為0%,表明正交試驗結果可靠。各影響因素主次順序為溫度>加酶量>時間>pH。凝集素對人體有害,將其去除是花蕓豆提取物應用于食品工業的前提,所以選擇A1B3C3D2方法,此時相對抑制率為75.38%,相對凝集活力為0%。方差分析結果表明(表3),各因素對粗提物凝集活力影響顯著。
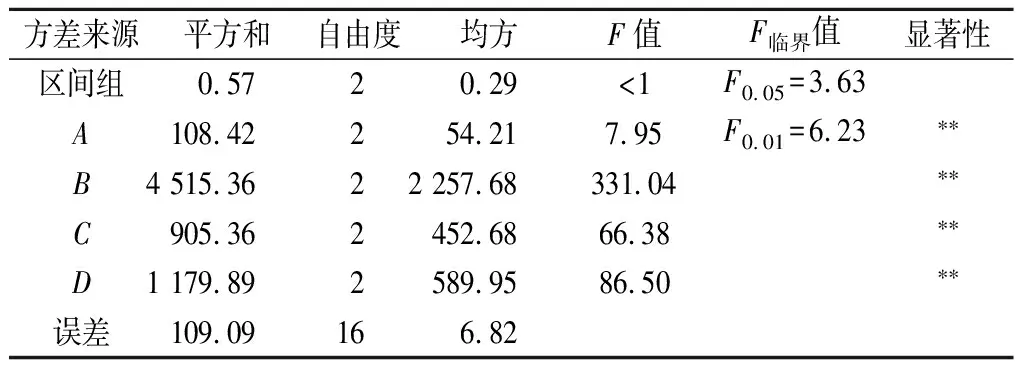
表3 方差分析結果
2.4 模擬胃腸道對提取物α-淀粉酶抑制率的影響
無凝集活力花蕓豆提取物分別經體外胃、腸環境模擬后,α-淀粉酶抑制率的變化如圖5所示,在模擬胃液處理后,抑制率顯著降低,從63.15%降低至55.18%,這說明提取物對胃蛋白酶的水解具有一定的抵抗力,仍能保持一定的α-淀粉酶抑制率[26]。模擬腸液處理后,提取物對α-淀粉酶的抑制率變化不顯著,與讓一峰等[19]的研究結果相符。提取物先后經體外胃環境模擬和體外腸環境模擬后,仍具有53.53%抑制率。總而言之,花蕓豆提取物在體外模擬胃、腸環境后仍對α-淀粉酶具有抑制效果,較為穩定。

A-未經過模擬腸胃處理;B-模擬胃液處理;C-模擬腸液處理;D-模擬胃腸處理
2.5 花蕓豆提取物添加量對日常主食eGI的影響
日常主食淀粉水解度如圖6所示,淀粉水解度隨著水解時間的增加而增加,然后趨于平衡。面包淀粉水解平衡的時間為120 min,米飯、白饅頭和玉米饅頭則為180 min。添加了1%~3%的花蕓豆提取物后,米飯、白饅頭和玉米饅頭淀粉水解平衡的時間降低至120 min,同時隨著花蕓豆提取物添加量的增加,淀粉水解度顯著降低,在添加3%提取物后,面包、米飯、白饅頭與玉米饅頭的水解度分別從77.79%、84.58%、84.91%和77.90%降低至30.48%、40.98%、19.08%和15.12%。說明花蕓豆提取物能夠有效抑制不同淀粉的水解。

a-面包;b-米飯;c-白饅頭;d-玉米饅頭
不同提取物添加量對主食eGI的影響如表4所示,面包、米飯、白饅頭與玉米饅頭的eGI值分別為65.00、71.65、68.17和63.41,其中米飯屬于高GI食品,面包、白饅頭與玉米饅頭屬于中GI食品,隨著花蕓豆提取物的添加,4種主食eGI值都得到顯著降低,且隨著添加量的增加,eGI值進一步降低,當添加量為3%時,面包、米飯、白饅頭與玉米饅頭的eGI值分別降低至30.69、39.51、22.30和19.69,屬于低GI食品。說明花蕓豆提取物可應用于低GI食品中生產中,添加提取物的食品會降低餐后葡萄糖的升高,有益于糖尿病,肥胖癥等疾病患者[27]。

表4 不同提取物添加量主食的估計血糖生成指數
3 結論
花蕓豆粗提物具有較強的α-淀粉酶抑制活力與凝集活力,比較了菠蘿蛋白酶、木瓜蛋白酶、酸性蛋白酶、中性蛋白酶與堿性蛋白酶處理對粗提物α-淀粉酶抑制活力與凝集活力的影響,最終選擇酸性蛋白酶制備無凝集活力花蕓豆提取物。正交試驗結果表明,溫度70 ℃,pH 2.5,處理時間90 min,加酶量1 000 U/g條件下,花蕓豆粗提物的凝集活力被完全去除的同時α-淀粉酶的抑制活力保留75.38%。對花蕓豆粗提物凝集活力影響最大的因素是溫度。體外模擬胃環境后,花蕓豆提取物α-淀粉酶抑制活力顯著降低,體外模擬腸環境則無顯著影響。花蕓豆提取物的添加會顯著降低面包、米飯、白饅頭與玉米饅頭的eGI值,且隨著添加量的增加進一步降低。

