雷氏普羅威登斯菌耐藥性及耐藥基因的單中心研究
石 嬌, 王光西,丁曼琳, 周英順
(1. 西南醫科大學基礎醫學院病原生物學教研室,四川 瀘州 646000; 2. 成都醫學院第一附屬醫院檢驗科,四川 成都 610500)
普羅威登斯菌屬廣泛分布于環境,屬于條件致病菌,常引起腹瀉和腸道外感染,如尿路感染、腦膜炎和敗血癥等[1]。雷氏普羅威登斯菌屬于普羅威登斯菌屬,常在食品加工運輸中大量繁殖從而引起食物中毒等[2]。近年來,雷氏普羅威登斯菌導致的感染不斷發生,多重耐藥菌的檢出率不斷升高,耐碳青霉烯雷氏普羅威登斯菌引起的感染不斷出現[3],已成為引起醫院感染的病原菌之一,給臨床疾病診治帶來嚴峻挑戰。研究顯示,金屬β-內酰胺酶相關耐藥基因(如blaNDM、blaIMP、blaVIM)是耐碳青霉烯類藥物革蘭陰性菌攜帶的主要耐藥基因[4]。本研究擬通過分析某院雷氏普羅威登斯菌的耐藥性,測定耐碳青霉烯類菌株全基因組,闡明其遺傳特征,為臨床抗菌藥物治療選擇及醫院感染防控提供依據。
1 對象與方法
1.1 研究對象 本研究嚴格按照病原微生物標本采集規范,收集2017年1月—2019年12月臨床送檢標本,排除同一患者相同部位重復送檢標本。
1.2 細菌鑒定和藥敏試驗 待檢標本經細菌培養分純后采用法國梅里埃全自動微生物鑒定儀進行菌株鑒定,質控菌株為銅綠假單胞菌ATCC 27853、大腸埃希菌ATCC 25922、肺炎克雷伯菌ATCC 70603,均購自國家衛生健康委臨床檢驗中心。同時采用配套的藥敏分析儀進行抗菌藥物敏感性檢測,藥敏結果參照美國臨床實驗室標準化協會標準[5]。
1.3 細菌全基因組測序 選取碳青霉烯類耐藥菌,使用細菌基因組提取試劑盒提取其所選取菌株全基因組DNA,提取的DNA送諾禾致源進行illumina PE150建庫和全基因組測定,獲得序列進行質控、組裝、注釋,并使用生物信息學軟件進行分析。
1.4 數據分析 應用WHONER 5.6軟件對數據進行處理和分析,計數資料采用構成比和率表示,采用生物信息軟件對測序結果進行分析。
2 結果
2.1 菌株來源 某院2017年1月—2019年12月臨床分離鑒定雷氏普羅威登斯菌25株,分布在12個臨床科室,其中神經外科檢出最多(7株,占28.00%),其次為重癥醫學科(5株,占20.00%),感染科、泌尿外科和燒傷整形科各2株(占8.00%),肝膽外科、骨外科一區、康復醫學科、老年醫學院科、神經內科、神經外科重癥和消化內科各1株(占4.00%)。
25株雷氏普羅威登斯菌標本來源包括6類,其中檢出最多的標本為尿(13株,52.00%),其次為傷口分泌物和腦脊液,分別為4株(16.00%)、3株(12.00%),全血和痰各2株(8.00%),胸腔積液1株(4.00%)。
2.2 耐藥情況 25株菌對β-內酰胺類(氨芐西林、阿莫西林)均耐藥,耐藥率為100.0%;對碳青霉烯類(亞胺培南、厄他培南、美洛培南)耐藥率分別為36.00%、40.00%、28.00%。見表1。
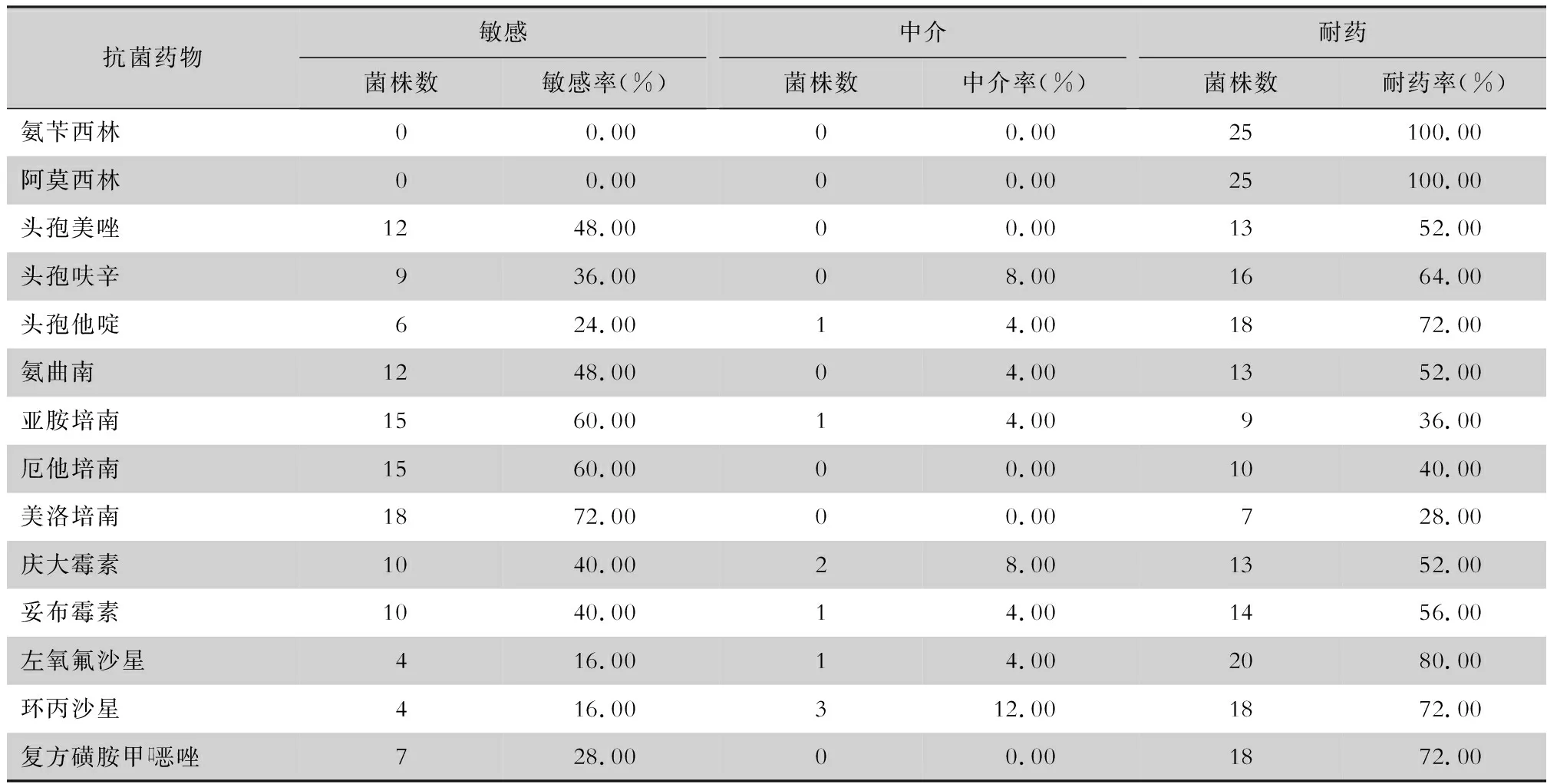
表1 25株雷氏普羅威登斯菌對常見抗菌藥物的藥敏結果
2.3 耐碳青霉烯雷氏普羅威登斯菌基因組基本特性 對3株耐碳青霉烯類雷氏普羅威登斯菌進行全基因組測序,結果顯示A1菌株基因組最大,為4 725 540 bp;A1菌株開放閱讀框數最多,為4 601個;A3菌株G+C含量最多,為40.86%;A3菌攜帶的RNAs數和耐藥基因個數最多,分別為83個和26個。見表2。
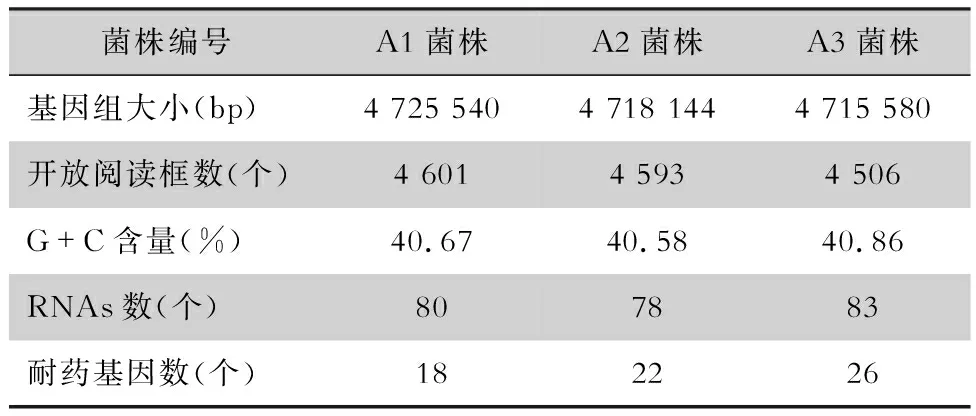
表2 耐碳青霉烯類雷氏普羅威登斯菌基因組基本特性
2.4 耐藥基因攜帶情況 3株耐碳青霉烯類雷氏普羅威登斯菌全基因組測序,結果顯示,均攜帶β-內酰胺類(blaNDM-1、blaOXA-10和blaTEM-1B)、大環內酯類[mph(A)、mph(E)、msr(E)]、甲氧芐啶(dfrA1)、氨基糖苷類[aadA1、aadA5、aph(3″)-Ib、aph(4)-Ia、acc(6′)-Ib3、aadB]、磺胺類(sul1)和氯霉素類(catB8)6類耐藥基因型,碳青霉烯類耐藥基因型均攜帶blaNDM-1、blaOXA-10。此外A3菌株還攜帶氟喹諾酮類基因型,見表3。
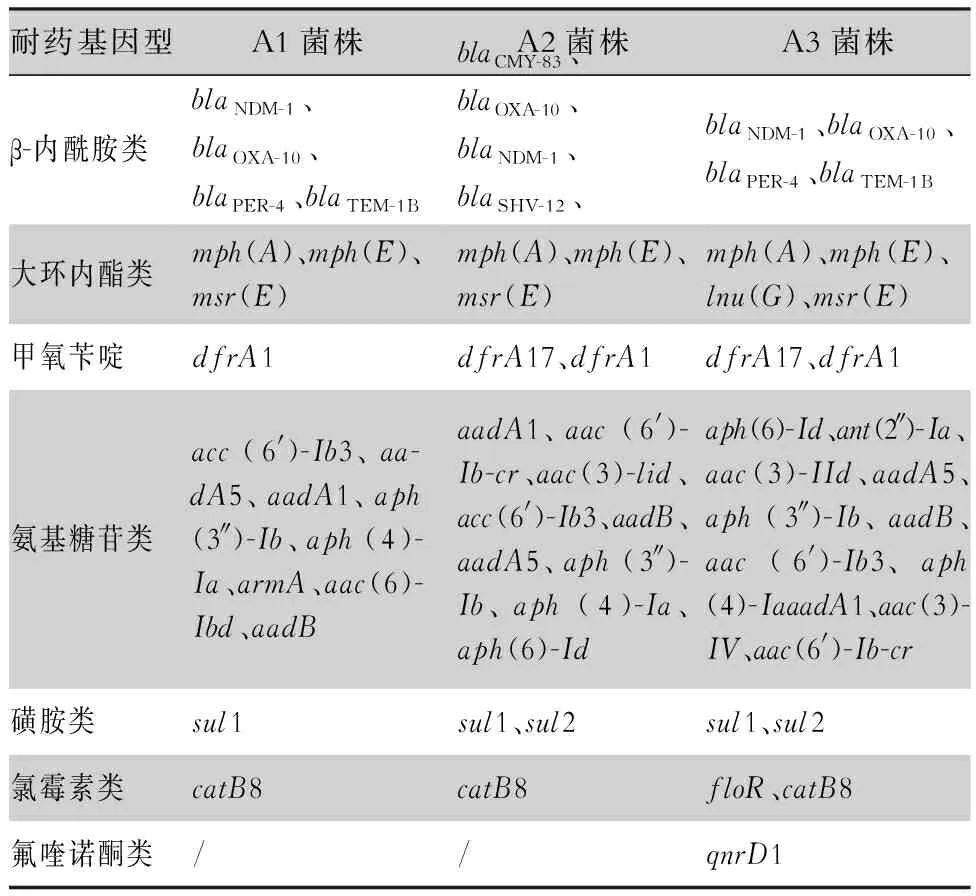
表3 耐碳青霉烯類雷氏普羅威登斯菌耐藥基因篩選結果
2.5 碳青霉烯類耐藥基因環境分析
2.5.1blaNDM-1基因環境分析 3株菌攜帶blaNDM-1耐藥基因型,遺傳結構為IS30-blaNDM-1-bleMBL-trpF-dsbC-orf-groES-groEL-IS91。與參考序列肺炎克雷伯菌質粒pC2343-2(序列號:CPO39824)、大腸埃希菌質粒pJ53(序列號:MN604268)相比較,與pC2343-2相似,在blaNDM-1的上游有插入序列IS30,下游有插入序列IS91。但不同于pJ53,上游為插入序列ISAba125。見圖1。
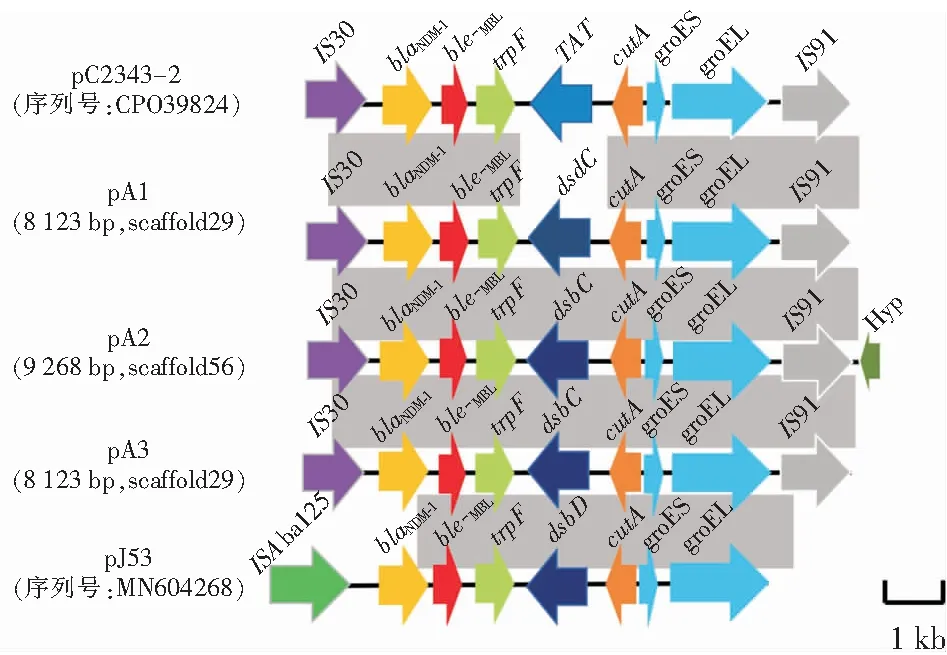
圖1 耐碳青霉烯類雷氏普羅威登斯菌blaNDM-1基因環境
2.5.2blaOXA-10基因環境分析 3株菌均攜帶blaOXA-10,遺傳結構均為:aac(6’)-Ib3-dfrA1-aadA1-blaOXA10-catB8-aadB。與參考序列海氏普羅威登菌質粒p99101(序列號:CPO28385)相比較基因結構高度相似;與普通變形桿菌質粒pVsc3(序列號:CPO34667)相比較,下游基因不同,pVsc3攜帶的是磺胺類耐藥基因型sul1,而3株菌攜帶的是甲氧芐啶耐藥基因型dfrA1和氨基糖苷類耐藥基因型aadA1、aac(6’)-Ib3。見圖2。
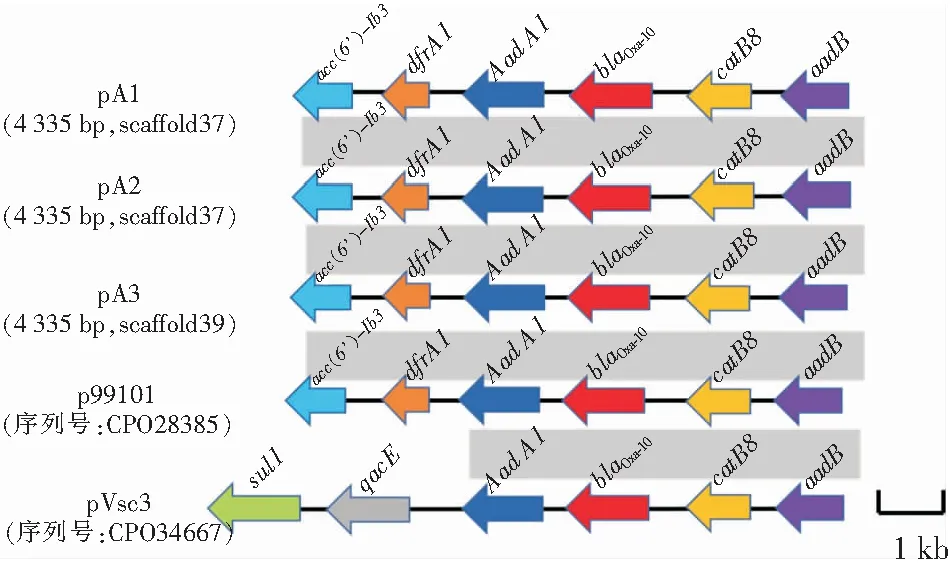
圖2 耐碳青霉烯類雷氏普羅威登斯菌blaOXA-10基因環境
3 討論
首株普羅威登斯菌1904年由Relttger分離, Kauffmam在1951年首次提議命名,1971年第一株耐藥菌株被報道,而第一株完整的基因測序則是在2017年被報道,來源于一株產耐藥基因blaNDM-1的臨床菌株[6-8]。
普羅威登斯菌與變形桿菌和摩根菌種極為類似,不同于其他腸桿菌,雖然臨床少見但普遍存于在環境中,有潛在致病性,是一類罕見的醫院獲得性和社區獲得性感染病原體[1-2]。雷氏普羅威登斯菌可引起尿路感染和菌血癥,也可引起心內膜炎、腹腔感染、腦膜炎等[1,9]。近年來,不同地區相繼報道雷氏普羅威登斯菌感染,從患者尿標本中分離出該菌[10-12]。該菌易存活于尿液中,本研究中雷氏普羅威登斯菌的主要標本來源也為尿。此外雷氏普羅威登斯菌感染還可引起腦膜炎,因Tanmoy Kamar Maiti[1]對雷氏普羅威登斯菌引起腦膜炎感染的案例進行報告,因此神經外科送檢率高。本研究中該菌對氨芐西林和阿莫西林均耐藥,耐藥率為100.00%;對碳青霉烯類藥物亞胺培南、厄他培南、美洛培南耐藥分別為36.00%、40.00%、28.00%。目前,國內外文獻對單株雷氏普羅威登斯菌的耐藥性進行分析較多,而未大量的、系統的分析雷氏普羅威登斯菌耐藥性,因此缺乏可比性。
全基因組測序的優點在于,不僅可以檢測出細菌的耐藥基因型,還可以發現可移動元件,從而分析出耐藥基因型所處的基因環境[13]。引起細菌產生耐藥的基因種類眾多,本研究在3株耐碳青霉烯類雷氏普羅威登斯菌菌中發現7類抗菌藥物耐藥基因,包括β-內酰胺類、大環內酯類、甲氧芐啶、氨基糖苷類、磺胺類、氯霉素類和氟喹諾酮類。其中3株菌均同時攜帶β-內酰胺類耐藥基因blaNDM-1、blaOXA-10和blaTEM-1B。與俞鳳等[14]僅發現同時攜帶blaNDM-1和blaPER-4耐藥基因型的菌株,賈琴妹等[15]僅發現攜帶blaKPC-2的菌株結果不一致,可能原因是菌株存在地區差異性,不同醫院臨床醫生用藥習慣不同。
細菌耐藥性是通過存在于染色體或質粒中的耐藥基因發生水平轉移或自身突變而獲得[16-17]。耐藥基因在各個菌株間水平轉移需借助可移動元件(插入序列、轉座子和整合子等)的轉化、轉導、接合等形式完成復制[18]。本研究中3株菌均攜帶blaNDM-1和blaOXA-10耐藥基因型,遺傳結構分別為IS30-blaNDM-1-bleMBL-trpF-dsbC-orf-groES-groEL-IS91、aac(6’)-Ib3-dfrA1-aadA1-blaOXA10-catB8-aadB。耐藥基因型blaNDM-1遺傳結構分析表明,其與已報道的肺炎克雷伯菌質粒pC2343-2(序列號:CPO39824)的遺傳結果高度一致,位于耐藥基因型blaNDM-1兩側的片段,下游通常為trpF、groES、groEL基因和insE基因的一部分,在上游發現插入序列IS30。插入序列IS30可介導耐藥基因的水平轉移。耐藥基因型blaOXA10的遺傳結構與已報道的海氏普羅威登菌質粒p99101(序列號:CPO28385)高度相似,在耐藥基因型blaOXA10的兩側均為其他類抗菌藥物耐藥基因型,但其上下游是否存在插入序列或轉座子參與耐藥基因的構成值得進一步研究。
綜上所述,既往對普羅威登斯菌耐藥情況缺乏系統性研究,對菌株分布,常見抗菌藥物耐藥率,尤其碳青霉烯耐藥基因型和遺傳特征均未見報道。本研究首次系統性地對普羅威登斯菌的耐藥性及碳青霉烯類耐藥菌株進行全基因組測序分析,具有一定的創新性。但仍存在測序菌株數量較少,耐藥基因型和耐藥基因環境分析不夠完善,有待進一步擴大對多種抗菌藥物的耐藥基因及基因環境的檢測,為臨床抗菌藥物規范化用藥提供指導。
通過對某院雷氏普羅威登斯菌耐藥性及碳青霉烯類耐藥菌株的全基因組測序分析,耐藥性結果顯示出多重耐藥現象,耐藥基因篩選結果顯示共有3株菌均攜帶β-內酰胺類、大環內酯類、甲氧芐啶、氨基糖苷類、磺胺類和氯霉素類耐藥基因型,碳青霉烯類均攜帶blaNDM-1和blaOXA-10耐藥基因型。為防止多重耐藥菌株的出現,阻斷耐藥基因在病原菌和患者之間的傳播,在臨床治療過程中應及早進行藥敏試驗和耐藥基因分析,合理選擇抗菌藥物及聯合用藥。

