根腫病菌侵染時期與濃度對寄主生長特性及抗性的影響
周金華,肖亞楠,來航線2,李云駒*
根腫病菌侵染時期與濃度對寄主生長特性及抗性的影響
周金華1,肖亞楠1,來航線2,李云駒1*
(1. 云南磷化集團有限公司/國家磷資源開發利用工程技術研究中心,云南 昆明 650600;2. 西北農林科技大學 資源環境學院,陜西 楊凌 712100)
【目的】為探討根腫病菌接種濃度與時期對寄主發病的交互作用及根腫病菌侵染后寄主的抗性響應。【方法】通過苗期盆栽試驗,系統地研究了接種根腫病菌濃度(105、106、107、108cfu/mL)及時期(0、10、20 d)對白菜發病率及防御酶活性的影響。【結果】發病率及病情指數與接種根腫病菌濃度呈正相關,108cfu/mL為最佳侵染濃度,白菜幼苗出現第一片真葉后10 d接種侵染效果最佳。根腫病侵染后,根腫病發病程度與呼吸速率和氣孔導度呈正相關,根系活力隨病情指數先升高后降低,植株受根腫病侵染后光合作用降低,呼吸作用增強,植物生長受抑制;防御酶POD、PAL、PPO與發病率呈負相關,丙二醛含量與發病率呈正相關,植株抵抗病害能力降低。【結論】研究為根腫病的侵染和防控提供參考。
侵染濃度;侵染時期;發病率;光合作用;抗性響應
【研究意義】根腫病是由鞭毛菌亞門蕓薹根腫菌(Woron)侵染引起的一種土傳真菌病害,專門侵染十字花科植物的根部[1-4],使根部膨大,形成腫瘤,阻礙根部對水分和營養的吸收,導致植株萎蔫矮化,生長緩慢,產量銳減,造成巨大的經濟損失。
【前人研究進展】不同時期種植白菜對根腫病的發病率和病情指數有重要影響?胡瓊等[5]通過對直播和移栽兩種模式下根腫病的受侵染情況進行研究,結果顯示移栽較直播發病輕,秧苗移栽時處于6葉期,避開根腫休眠孢子囊的最適侵染時期。同時,土壤根腫病原含量也是影響根腫病侵染的重要條件,黃蓉等[6]研究發現,病原菌接種濃度存在極限值,處于極限值范圍內,接種濃度越高,發病效果越好。根腫病侵染植株以后,植株的生理生化特性、生長特性都將會受到影響。盧曉霞等[7]研究表明感病油菜植株的光合速率顯著降低;姚建中[8]發現油菜感染根腫病后,死苗率升高,成株率降低,且植株的株高、角果數、千粒質量和產量都較未感病植株顯著降低。
根腫病侵染也會對其寄主的抗性響應產生影響,誘導抗性響應并產生一些主動防衛反應[9],其中包括植物細胞內活性氧的積累與清除?抗病信號的產生與轉導?防衛反應的表達與調控以及細胞過敏性壞死?植保素?酚類?醌類物質等次生產物的合成、寄主細胞壁的加強和修飾(如木質素的積累)等[10]?在這一復雜的過程中,超氧化物歧化酶[11](SOD)、過氧化氫酶[12](CAT)、過氧化物酶[13](POD)、苯丙氨酸解氨酶[14](PAL)、多酚氧化酶[15](PPO)等防御酶系起重要的調控作用?此外,土壤中病原菌含量及接種時期對根腫病發生的相互關系研究較多[6,16],但主要對病原菌含量或接種時期單一因素進行研究,鮮有對病原含量與接種時期交互作用的研究,對交互作用下植物抗性響應的研究也較少。
【本研究的切入點及擬解決的關鍵問題】本研究以白菜為實驗材料,通過盆栽試驗研究根腫病的接種濃度和侵染時期對白菜光合作用、呼吸作用、發病情況及抗病相關酶活性的影響,旨在探討多因素交互作用下根腫病的發病規律及白菜的抗病性響應,為根腫病的研究和防控提供理論基礎。
1 材料與方法
1.1 試驗材料
1.1.1 供試病原 供試根腫病菌分離于陜西省太白縣塘口村感病大白菜的新鮮膨大根腫,將病根洗凈,晾干水分置于塑封袋中密封,在-20 ℃冰箱保存。接種時將根腫腫塊加入10倍無菌水打成勻漿,六層紗布過濾后稀釋至不同濃度,5 mL移液槍等量接種病原10 mL。
1.1.2 感病寄主 白菜品種為金泰(白菜)生產于北京頂好嘉種子有限公司。
1.2 試驗設計
試驗于2017年7月10日進行,血球計數定量根腫孢子懸浮液的濃度,配制成1×105、1×106、1×107、1×108cfu/mL接種病原菌懸液。采用一次性魚盆作為盆栽盆,土壤∶基質土∶復合肥=10∶1∶0.06,加適量水混勻后翻土混勻,裝盆,每盆6穴,每穴2粒種子,每盆定植4株。從苗子出第一片真葉開始,第0、10、20天接種4種不同稀釋度的病原菌懸液4 mL/株。試驗設置12個處理,0 d接種1×105(A5)、1×106(A6)、1×107(A7)、1×108cfu/mL(A8)菌懸液,10 d接種1×105(B5)、1×106(B6)、1×107(B7)、1×108cfu/mL(B8)菌懸液,20 d接種1×105(C5)、1×106(C6)、1×107(C7)、1×108cfu/mL(C8)菌懸液。接種自來水作為空白對照,50 d測定光合作用指標,包括葉綠素含量、呼吸速率、蒸騰速率、胞間CO2、氣孔導度。60 d采樣并測定根系活力,測定PPO、POD、MDA、PAL等抗逆酶系活力,采集根區土進行微生物區系分離分析,收獲調查發病情況,探究不同時期接種及不同濃度接種對根腫病病情及相關指標的關系。
1.3 測定項目與方法
1.3.1 葉綠素含量測定 采用SPAD502葉綠素儀測定。
1.3.2 光合作用測定 采用LI-6800光合儀測定呼吸速率、蒸騰速率、胞間CO2含量、氣孔導度。
1.3.3 根系活力測定 稱取根尖樣品0.5 g,放入10 mL燒杯中,加入0.4% TTC溶液和磷酸緩沖液的等量混合液10 mL,把根充分浸沒在溶液內,在37 ℃下暗保溫1~3 h,此后加入1 mol/L硫酸2 mL終止反應,研磨后乙酸乙酯萃取485 nm波長分光光度計下比色,查標準曲線,即可求出四氮唑還原量(TTF)[17]。
1.3.4 植物抗逆功能相關的生理生化指標的測定 粗酶液提取:取白菜葉片0.5 g,將所取葉片重疊后用打孔器打出葉餅放于預冷的研缽內,再加入2 mL的0.05 mol/L緩沖液和少許石英砂后研磨成勻漿,并轉移至離心管離心(10 000 r/min,20 min,4 ℃),上清液即為酶液,貯于冰箱備用。SOD、POD、PPO、CAT、MDA等抗逆酶系測定方法參照高俊鳳等[17]《植物生理學實驗指導》。
1.4 微生物區系分析
參照孫敬祖等[18]的方法采集植株根區土壤樣品,稱取土樣10.0 g,加入到裝有90 mL無菌水,160 r/min常溫下震蕩20 min,制得根區土壤懸液。用稀釋平皿涂抹法對樣品中的細菌、放線菌、真菌進行分離,其培養基為BPA培養基、GA1培養基、PDA培養基。通過形態特征初步鑒定并計數分離所獲得菌株,計算各種類微生物占總微生物數量的比例。
1.5 數據分析
采用Excel、SPSS 19.0軟件進行數據統計分析,采用LSD多重比較法進行差異性檢驗。
2 結果與分析
2.1 不同接種時期及濃度對根腫病發病的影響
通過對發病率和病情指數的計算發現,隨接種濃度的升高,發病率和病情指數不斷升高,而隨接種時期的推后,低濃度(105cfu/mL和106cfu/mL)時根腫病發病率不斷升高,而高濃度(107cfu/mL和108cfu/mL)20 d接種發病率和病情指數開始下降。如圖1所示,0 d接種,106cfu/mL濃度接種無發病,其余濃度組間差異不顯著;出現真葉10 d和20 d接種,發病率及病情指數隨接種濃度不斷遞增。相同接種濃度下,接種時間對發病率及病情指數的影響因接種濃度變化而異。20 d接種較10 d發病率及病情指數先升高后降低,發病率分別先增加10.0%、23.0%,后降低11.0%、2.0%,病情指數增率分別增加2.5%,8.5%,-3.6%,-14.7%。
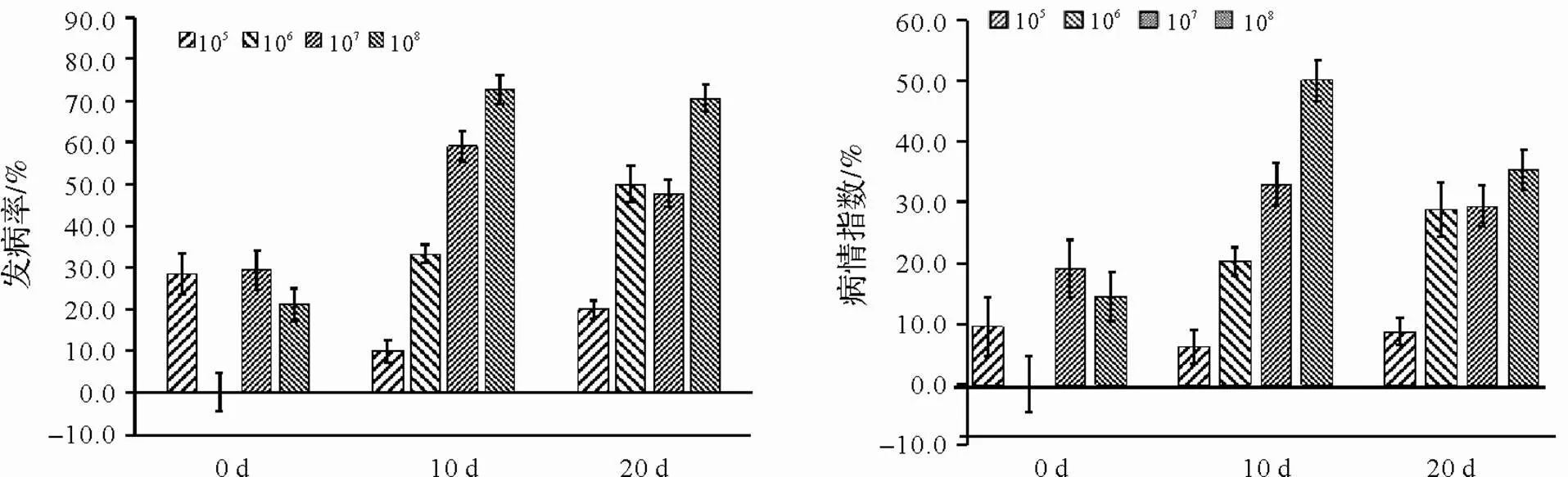
圖1 病原接種時期與濃度對白菜根腫病發病率的影響
由圖2A可知,0 d接種,其發病無規律,且發病數量較少,發病程度不均。而出現真葉10 d接種,發病主要集中于3級,其中B7、B8發病最為嚴重,分別占該處理發病總株數的69.2%、50.0%,出現真葉20 d接種,發病主要集中于4級,其中C6、C8最為嚴重,分別占該處理總發病株數的50.0%、50.0%。由圖2B三維散點圖所示,發病率隨接種時期及接種濃度的增加,發病率增加。接種時期、接種濃度與發病率存在一定的相關性,出現第一片真葉開始,20 d內接種根腫病的發病隨接種時期的推后其發病的比例上升,隨接種濃度的增加而上升。
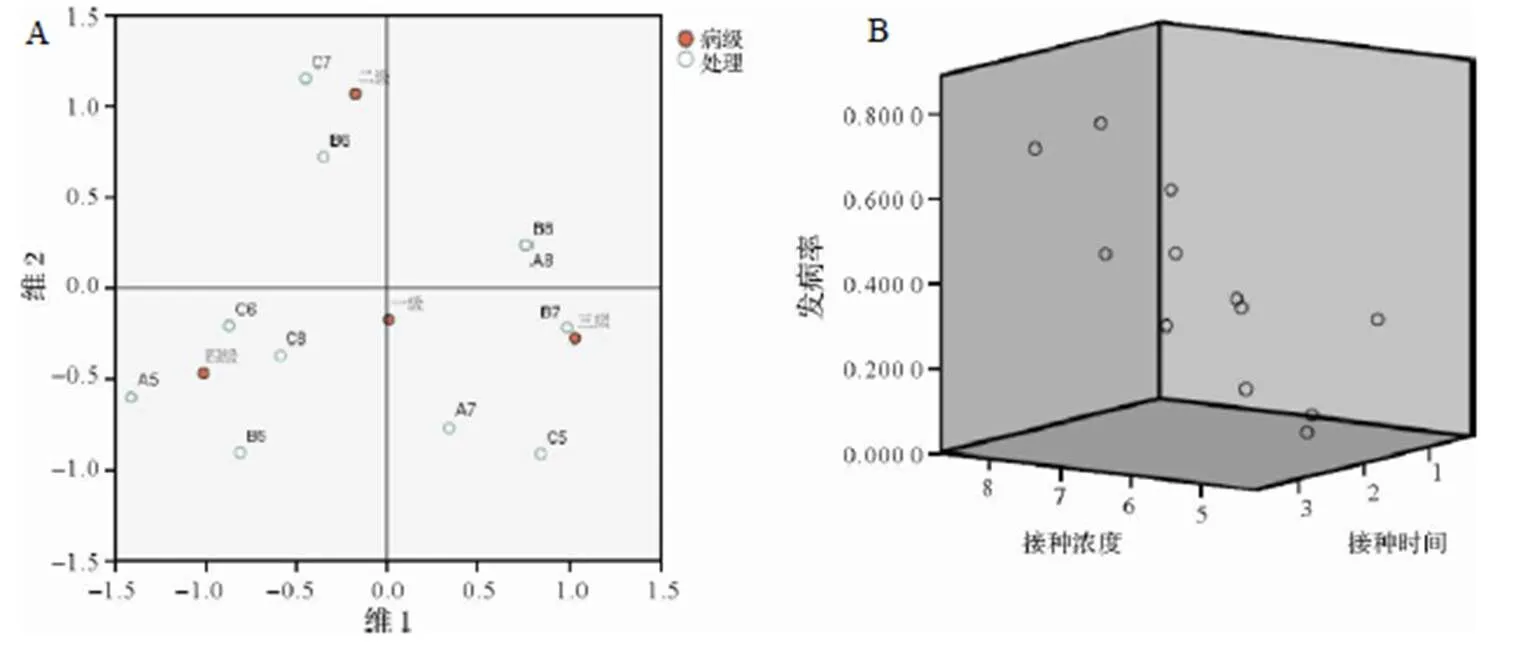
圖2 不同接種處理對根腫病發病病級的影響
2.2 不同接種時期及濃度對生理學指標的影響
不同處理下,葉綠素含量與根系活力隨接種時期和濃度的變化相似,根系活力和葉綠素含量逐漸降低。如圖3A所示,0 d、20 d接種根系活力隨濃度增加先升高后降低,A6、C6為組內最大,較對照分別增加3.6%、14.6%,10 d接種B6為組內最低,較對照降低13.6%,其余組內差異不顯著。如圖3B所示,相同接種時間下,0 d、10 d接種葉綠素含量隨濃度增加先升高后降低,106cfu/mL接種為組內最大,較對照差異不顯著,B5較對照降低7.2%(0.05),20 d接種C5較其他組內處理顯著提高,較對照增加4.2%(<0.05),C6較對照降低3.6%。
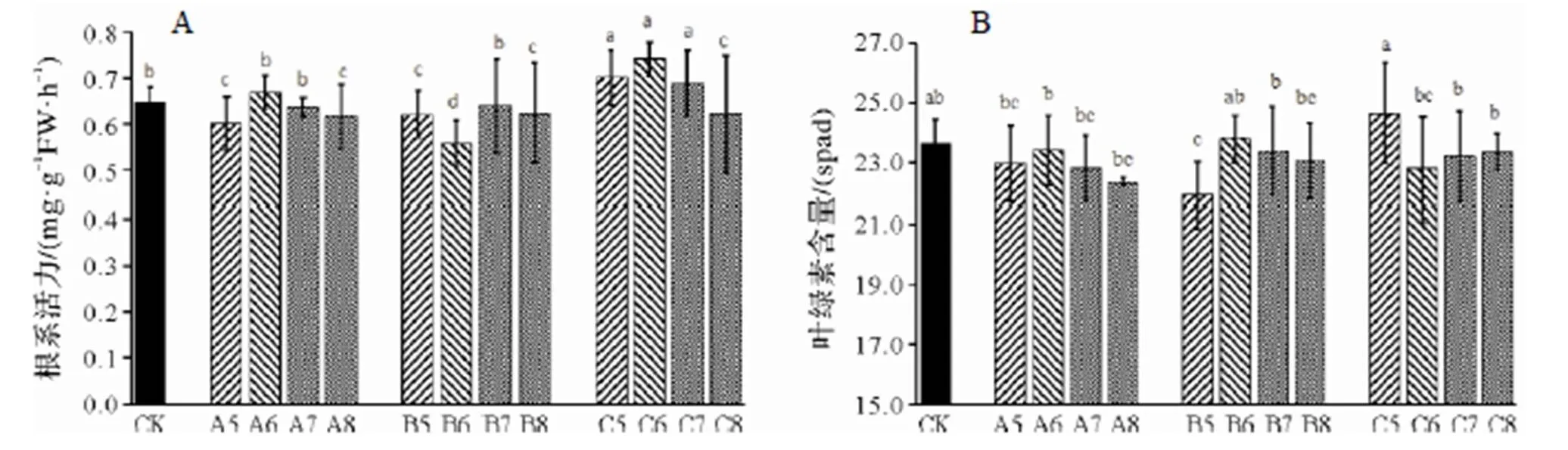
圖3 不同接種時期及接種濃度對根系活力及葉綠素含量的影響
2.3 不同接種時期及濃度對光合作用及呼吸作用的影響
光合作用是作物生長的基礎,是植物賴以生長和生物量遞增說必須的重要生理過程,它的強弱對于植物生長、產量及其抗逆性都具有十分重要的影響,因而可以作為判斷植物生長和抗逆性大小的指標。植物感染病菌后,呼吸作用急增,一方面病原微生物強烈的呼吸作用引起呼吸作用的增強,另一方面是寄主植物受損傷,致使呼吸速率加快。感病引起呼吸代謝途徑發生變化,糖酵解和三羧酸途徑減弱,而磷酸戊糖途徑加強,引起寄主植物呼吸的酶系統發生變化。
不同接種時期及接種濃度的呼吸速率,接種根腫病原菌處理后其呼吸速率均大于對照,如圖4所示,0 d接種處理與10 d接種處理,其呼吸速率隨接種濃度的增大而增大,20 d接種隨接種濃度增加呈下降趨勢。A6、A7、A8及B7較對照蒸騰速率增加,差異達到顯著水平(<0.05)。0 d接種處理較對照增加,增率分別為-1.4%、29.2%、32.9%、26.8%(<0.05),10 d接種處理,蒸騰速率先增加后減小,增率分別為3.1%、12.2%、29.0%、13.9%(<0.05),20 d接種處理,蒸騰速率隨接種濃度增大而逐漸降低,增率分別為9.2%、-9.1%、-0.1%、-11.9%。胞間CO2含量,A6、B5、B8較對照無明顯變化,差異不顯著,20 d接種較對照降低,且4個接種濃度呈下降趨勢,均達到顯著水平(<0.05),其增率分別為-42.9%、-55.3%、-46.5%、-67.8%。而氣孔導度,A6、A7、A8、B7較對照提高,且差異達到顯著性水平(<0.05),分別提高5.30%、6.22%、5.20%、5.54%,0 d接種、10 d接種,氣孔導度隨接種濃度先升高后降低,107cfu/mL濃度接種達到該接種時期峰值。20 d接種隨接種濃度升高,氣孔導度呈下降趨勢,較105cfu/mL,0 d接種,A6、A7、A8分別增加5.30%、6.22%、5.20%(<0.05),10 d接種B6、B7、B8分別增強2.35%、5.54%、2.80%(<0.05)。白菜侵染根腫病后,植株光合作用能力降低,呼吸速率、蒸騰速率、氣孔導度升高,胞間CO2含量降低。
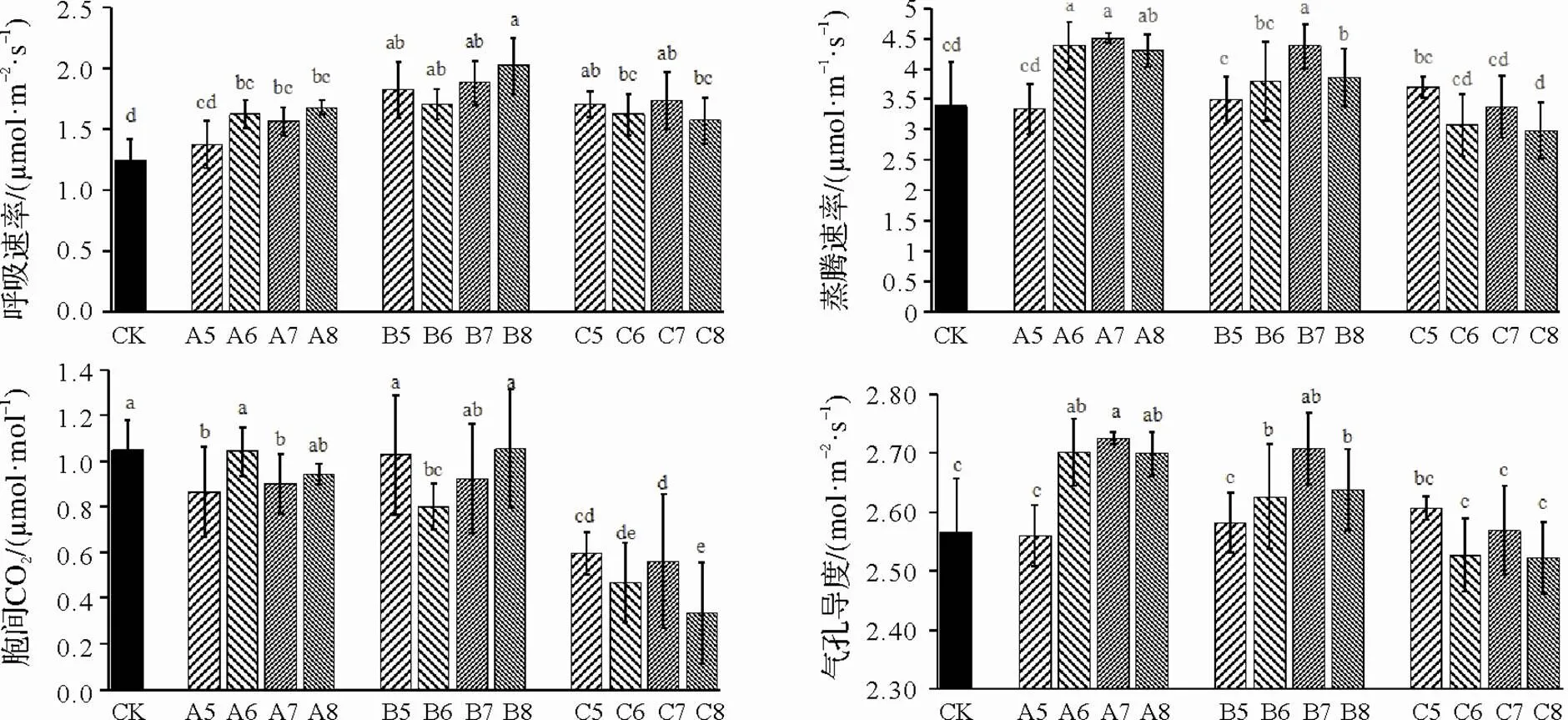
圖4 不同接種時期及接種濃度對呼吸速率、蒸騰速率、胞間CO2及氣孔導度的影響
2.4 不同接種時期及濃度對酶學指標的影響
生物或非生物脅迫促使植物體內的抗氧化酶系統和MDA清除程序啟動,不同時期接種不同濃度根腫菌處理在感染根腫病菌后產生相應的變化,葉片中的POD、PAL及PPO的活性受到不同程度的影響,根腫病菌侵染將顯著降低PAL及PPO活性,POD活性隨發病程度先升高后降低。根腫病侵染導致抗氧化酶系統受抑制和MDA清除程序受破壞,丙二醛含量增高。
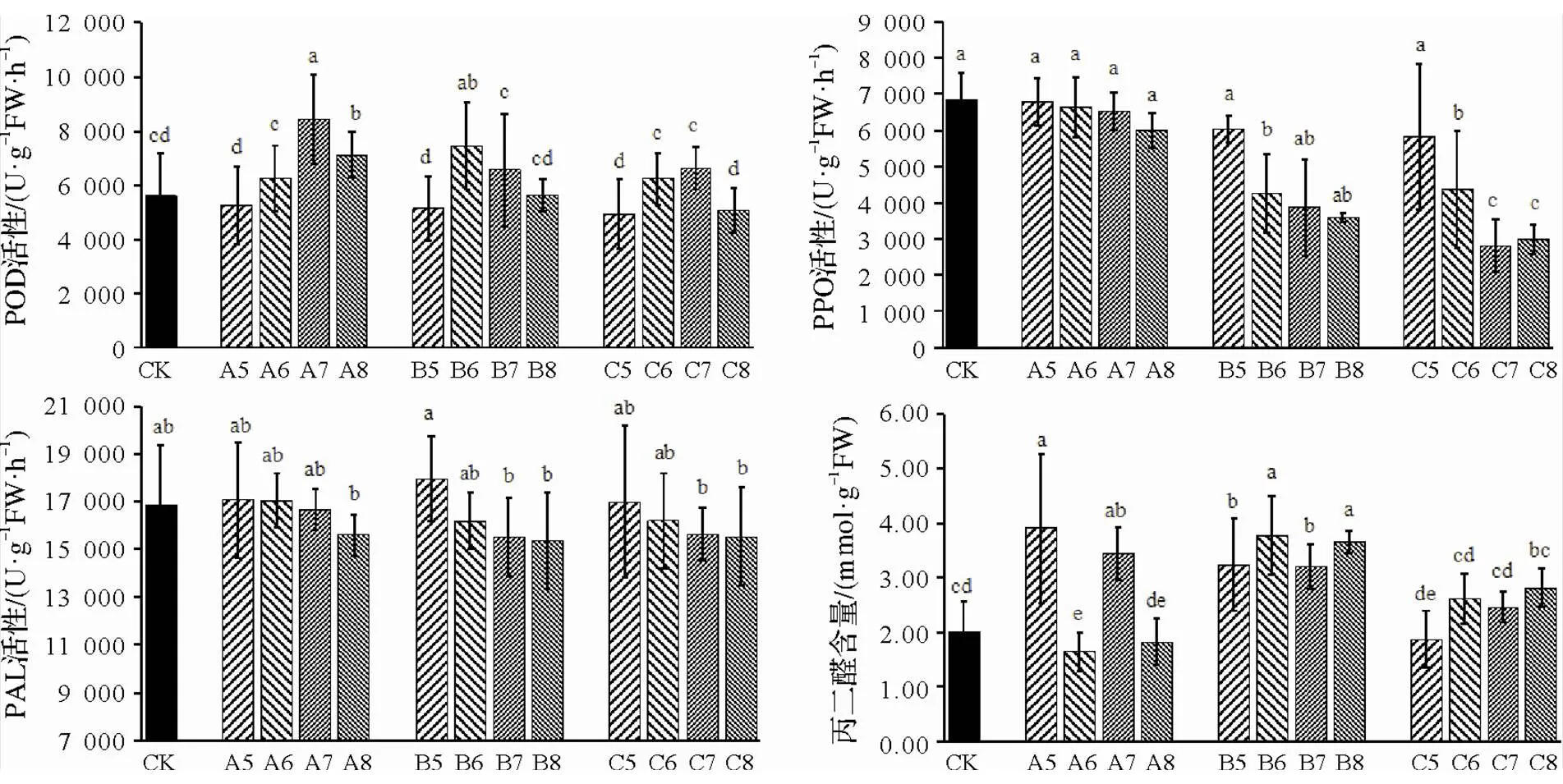
圖5 不同接種時期及接種濃度對POD、PPO、PAL及MDA的影響
不同接種時期及接種濃度處理下,POD活性A7、B6較對照升高,且達到顯著性水平,如圖5A所示,增率為50.4%、32.9%。105cfu/mL濃度接種,POD活性與對照均低于對照,A5、B5、C5降幅分別為6.5%、8.4%、12.1%。不同時期接種,POD活性隨接種濃度增大,先增強后降低,0、10、20 d接種,分別在A7、B6、C7達到峰值,增率分別為50.4%、32.9%、18.0%。
PPO活性隨接種濃度的增加不斷降低,如圖5B所示,在出現第一片真葉后0 d接種,不同接種濃度與對照無顯著性差異。10、20 d接種,105cfu/mL濃度接種PPO活性最大,分別為6 035 U/(gFW·h)、5 831 U/(gFW·h),較對照降低12.0%、15.0%。且10、20 d接種處理,隨根腫病原菌接種濃度增大,PPO活性逐漸降低,B6、B7、B8較B5降幅分別為29.3%、35.7%、40.6%,C6、C7、C8較C5降幅分別為37.8%、43.5%、47.7%,較對照差異均達到顯著性水平。
不同接種時期及接種濃度處理的PAL活性,不同時期105濃度接種較對照增強,在相同的接種時期,其PAL活性隨接種濃度的升高逐漸減低。如圖5C所示,0 d時期接種,106、107、108cfu/mL較105cfu/mL降低0.2%、2.4%、8.6%,10 d時期接種降低-9.9%、13.7%、14.5%,20 d時期接種降低-4.7%、8.1%、8.5%。
不同接種時期及接種濃度處理的丙二醛含量,A6、A8、C5低于對照,降幅分別為17.9%、9.1%、6.5%,A6達到顯著性差異。如圖5D所示,0 d、10 d時期接種,A5、A7、B5、B6、B7、B8較對照增大,增率分別為94.8%、71.5%、61.6%、88.5%、60.0%、82.2%,且達到顯著性差異。20 d時期接種,隨接種濃度逐漸升高,較對照差異不顯著,增率為-6.5%、30.7%、22.9%、40.5%。
2.5 根腫病發病與各指標相關性分析
由圖1可知,根腫病侵染后的發病程度與接種濃度及接種時間存在極為顯著的相關關系,隨根腫菌濃度增大,發病程度及發病數量逐漸增強,隨接種時期的推后,根腫菌侵染由低感染→高感染(升高)→高感染(穩定),六葉期以后根腫病感染幾率降低[5]。根腫病侵染以后,白菜的抗性響應也將會隨根腫病感染而發生變化,不同的生理生化指標及酶學指標對根腫病侵染后的響應強度存在著一定的差異性,不同指標與根腫病發生相互聯系、相互影響,不同的指標之間也存在著相關關系。
圖6 不同接種時期及接種濃度下不同指標的標準化殘差的正態P-P圖
為進一步探究根腫病發病與各生理生化指標間的關系,對各生理生化指標與發病率進行協方差偏相關分析。由圖6所示,標準化后的殘差呈正態分布,且實測累積概率與預測累積概率線性相關,所選取生理生化指標中存在部分指標與發病率具有偏相關關系。分別對每個指標跟發病率進行偏回歸相關關系線性分析,得到每個指標對白菜發病率的貢獻程度,其相關關系如圖7-9所示。
葉綠素含量(SPAD)與發病率無相關性,相關性系數2(SPAD)=0.001(2<0.09),根系活力與發病率間的相關性系數為2(根系活力)=0.879(2>0.64),根系活力與發病率間具有強相關性,且根系活力與發病率呈正相關。
呼吸速率、胞間CO2、蒸騰速率與發病率相關性系數2(呼吸速率)=0.131、2(胞間CO2)=0.151、2(蒸騰速率)=0.579,相關性系數2均小于0.64,與發病率呈弱正相關,氣孔導度與發病率間相關系數2(氣孔導度)= -0.551,與發病率負相關關系。光合作用與根腫病發病有一定相關性,但其關系較弱,一定程度上可以作為發病情況的表征指標。
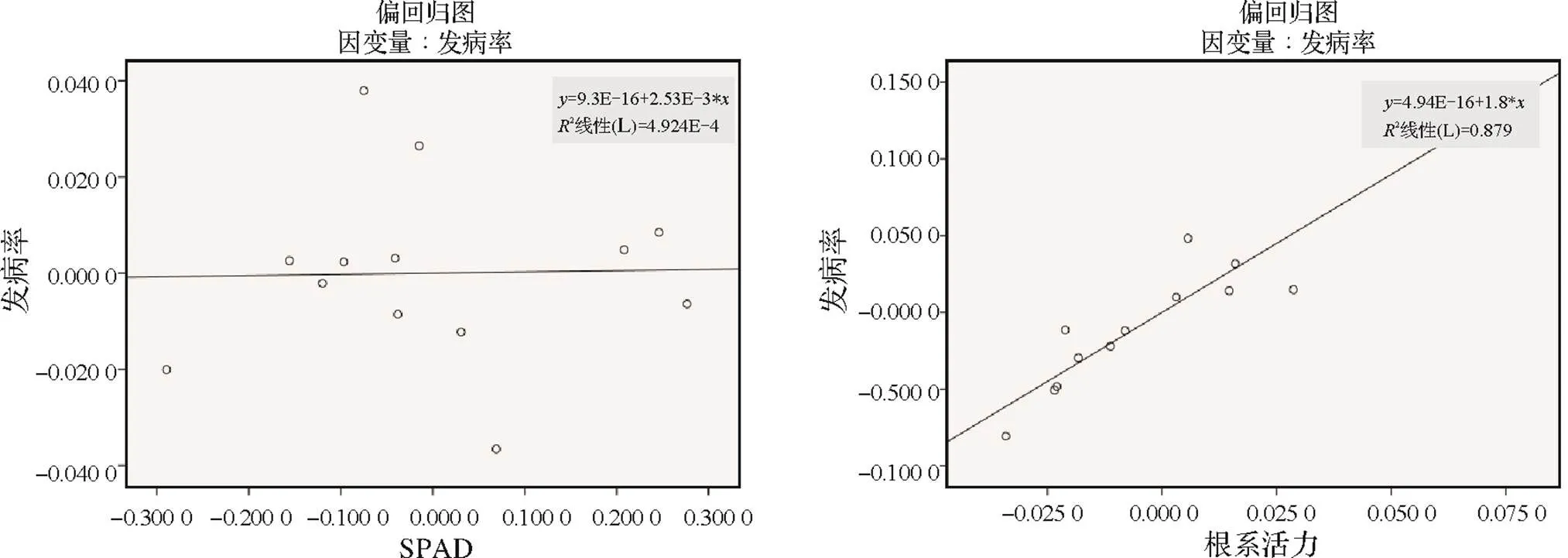
圖7 不同接種時期及接種濃度下發病率與葉綠素、根系活力偏相關關系
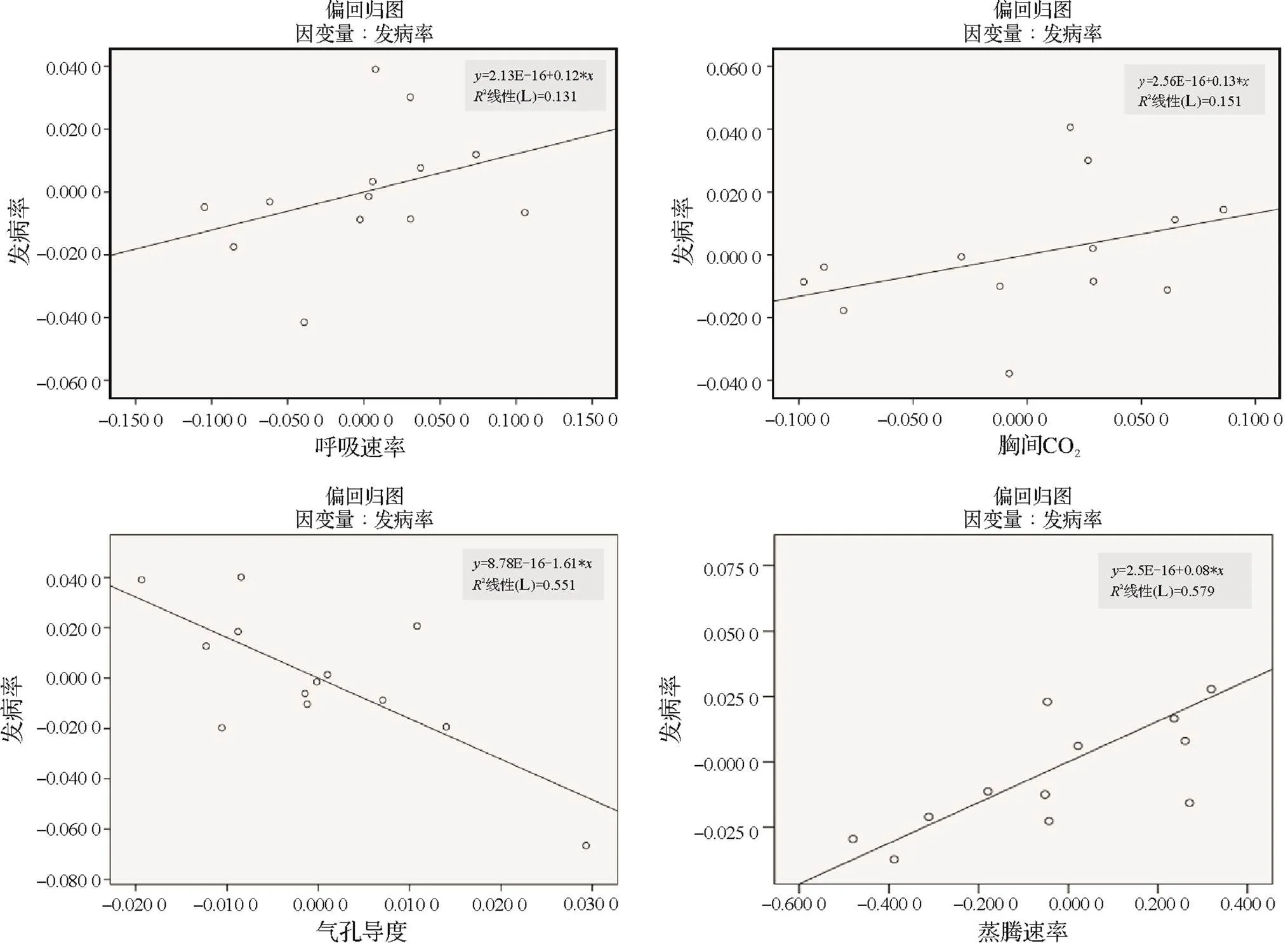
圖8 不同接種時期及接種濃度下發病率與呼吸速率、胞間CO2、氣孔導度、蒸騰速率偏相關關系
防御酶系主要包括POD、PPO、PAL及MDA,POD、PPO及PAL為正向抗逆酶系,當植物受到病原侵染等條件脅迫時,其植物體內含量上升,MDA為植物在逆境條件下,細胞產生的次級代謝產物,當植物細胞受到如病害等疾病脅迫時,丙二醛含量代謝速度減慢,含量增加。POD、PAL、PPO與發病率間的相關性系數2(POD)= -0.852、2(PAL)= -0.944、2(PPO)= -0.367,與發病率呈負相關。而MDA與發病率間的相關性系數為2=0.875,呈正相關。
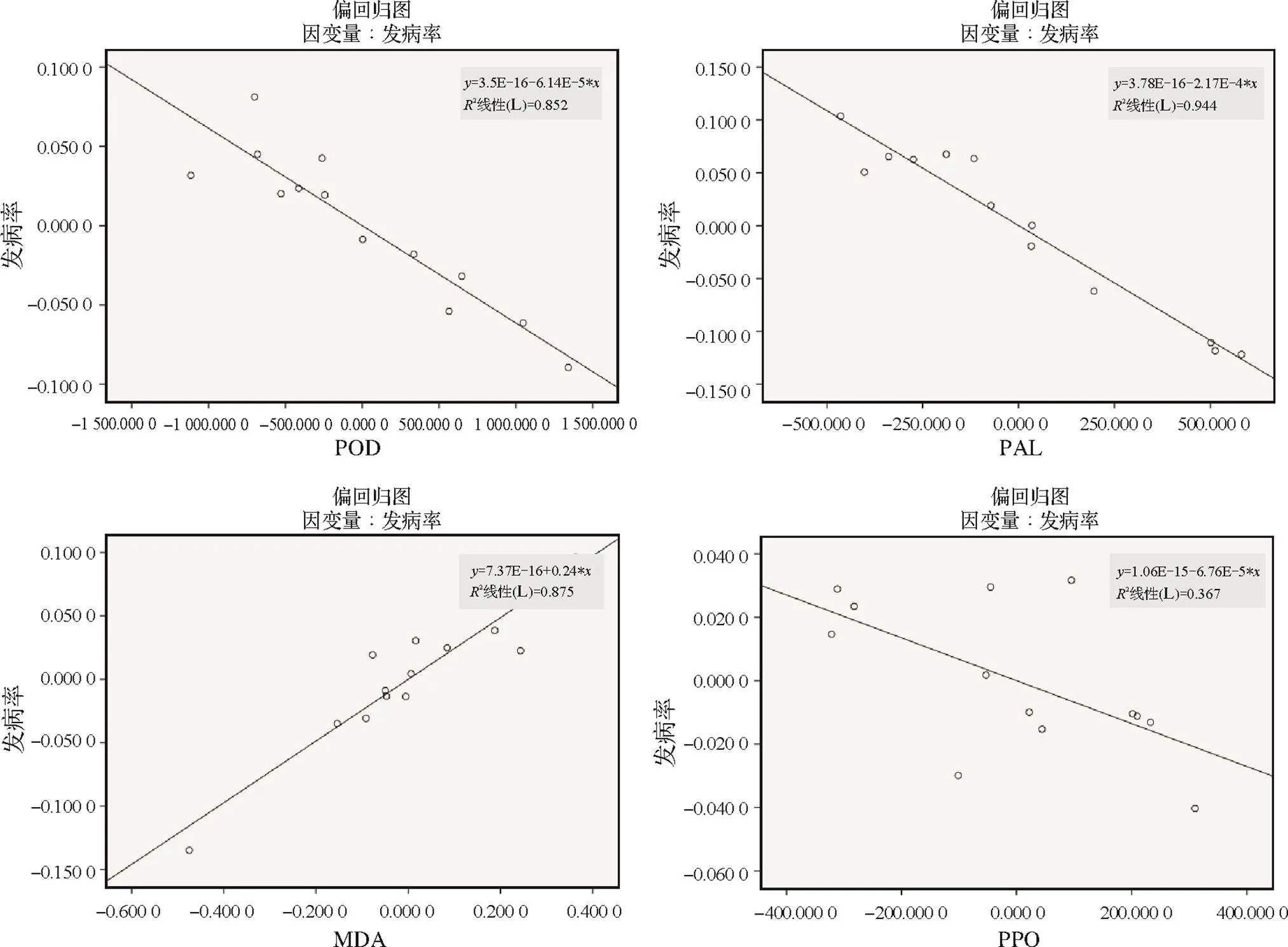
圖9 不同接種時期及接種濃度下發病率與呼吸速率POD、PAL、MDA、PPO偏相關關系
2.6 不同接種時期及濃度對微生物區系的影響
微生物區系分離結果如圖所示,微生物區系隨根腫病菌接種時期、接種濃度變化。如圖10所示,可培養微生物中細菌數量隨接種濃度升高不斷升高,0、10、20 d不同接種時期,相同接種濃度下細菌數量逐漸增多。放線菌數量隨接種濃度升高不斷減少,0、10、20 d不同接種時期,相同接種濃度下放線菌數量逐漸增多。真菌數量隨接種濃度升高不斷升高,0、10、20 d不同接種時期,相同接種濃度下真菌數量逐漸增多。0 d接種,細菌數量較對照增率為8.7%、19.3%、20.5%、32.4%;10 d接種,增率較對照15.0%、21.8%、32.7%、42.3%;20 d接種,增率較對照為23.0%、32.6%、34.0%、45.7%。0 d接種,放線菌數量較對照增率為-10.1%、-4.9%、-6.8%、-9.1%;10 d接種,增率較對照為7.4%、-0.6%、1.3%、1.3%;20 d接種,增率較對照為10.2%、3.1%、0.0%、-3.8%。
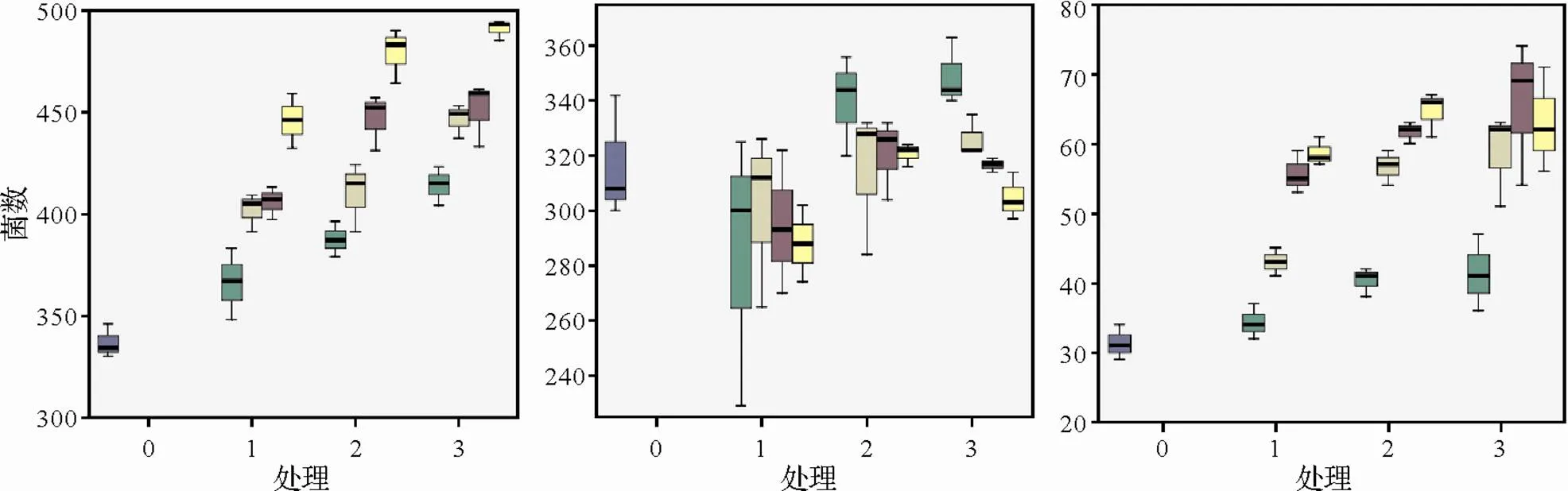
圖10 不同接種時期及濃度對根際微生物區系(細菌、真菌、放線菌)的影響
3 討 論
本研究對白菜根腫病菌在不同生長時期,以不同濃度稀釋菌懸液進行接種,測定植株的葉綠素含量、及根系活力、光合作用強度、呼吸作用強度,以及抗逆酶系,包括PPO、POD、PAL、MDA等,微生物區系組成的變化,并且調查統計根腫病情況。不同時期接種及不同濃度接種,其根腫病發病存在顯著差異,且存在較強的規律性,發病率隨接種時期推后先升高后趨于穩定,隨接種濃度增大而升高。根腫病的發病率與根系活力呈正相關關系,發病率越大其根系活力越高,與光合作用存在負相關關系,隨根腫病發病率升高,其蒸騰速率越高,氣孔導度越低。PPO、POD、PAL與發病呈負相關關系,隨根腫病發病率的升高逐漸降低,MDA與發病率成正相關關系,隨根腫病發病率的升高,植物體內MDA清除程序受到破壞,丙二醛在植株體內富集,對植株產生毒害作用[19]。
對于發病率,發病率與接種濃度和接種時期在20 d及108cfu/mL濃度內正向相關,隨著接種濃度的增加,發病率逐漸加重,隨著接種時期的推后,發病率先升高后趨于平緩。通過發病數量、病級、PCoA主成分分析,10 d接種,發病程度集中于3級,20 d接種發病程度集中于4級,對處理與病級進行對應分析,3級發病所占不同處理發病植株的數量最多,其次是4級、2級、1級,發病率與接種時期及接種濃度線性相關,最佳感病時期介于出現第一片真葉10 d接種至20 d接種,接種濃度108cfu/mL接種發病率最高。
為進一步探究不同處理所得的不同發病率下的白菜植株的生理學指標的關系,本研究測定了葉綠素含量、根系活力、呼吸速率、氣孔導度、蒸騰速率等,發病率隨接種濃度升高而降低,隨接種時期先降低后升高,根系活力與發病率具有強相關性,根系活力隨根腫發病情況活力增強,根腫病發病,使養分由主要供給葉片生長轉為供給根系生長,根系活力增強,葉片光合作用能力減弱,植株同化養分能力減弱[20]。在10 d前接種,白菜幼苗抵抗外界逆境脅迫的能力較弱,受到外界脅迫時受影響程度較大,20 d接種及20 d以后接種,白菜幼苗抵抗外界逆境脅迫的能力增強,受外界脅迫影響程度減弱。接種根腫病原菌后白菜呼吸速率較對照升高,0、10 d接種,呼吸速率隨接種濃度升高,20 d接種較10 d接種下降且隨接種濃度呈下降趨勢。蒸騰速率、胞間CO2、氣孔導度與呼吸速率的變化規律相似,0、10 d接種,呼吸速率隨接種濃度升高;20 d接種,隨接種濃度呈下降趨勢。發病率與根系活力、氣孔導度及蒸騰速率具有較強的相關性。
植物防御酶系是當受到病原侵染等環境脅迫的重要指示指標[21],PPO、POD、PAL與發病呈負相關關系,隨根腫病發病率的升高逐漸降低,MDA與發病率成正相關關系。PPO、POD及PAL均為植物防御酶系,當其活性較高時能提高植物抵御病原侵染等逆境脅迫,當植物逆境脅迫超出植株的承受能力,其活性逐漸降低,對逆境的抵抗能力下降,易感病和受其他逆境脅迫,影響植株的正常生長[22]。0 d接種105cfu/mL濃度與107cfu/mL濃度發病率最高,其丙二醛相應高于其他接種濃度,10 d接種、20 d接種,丙二醛含量隨接種濃度升高而升高,與發病率具有相同的變化趨勢。丙二醛是膜脂過氧化最重要的產物之一[23],它的產生會加劇膜的損傷,因此在植物衰老生理和抗性生理研究中MDA含量是一個常用指標。丙二醛的積累加速植物細胞膜的損傷和減弱其對病原侵染等的抵抗能力。植物防御酶系中POD和PAL與發病率呈強正相關關系,MDA與發病率呈強負相關關系,是良好的病原對植株的脅迫程度指示指標。
微生物區系中,根腫菌的侵染處理能顯著增加土壤中細菌和真菌的比例,降低放線菌的比例。土傳病害主要以真菌及細菌為主[24],真菌及細菌數量上升,受真菌性病害及細菌性病害侵染幾率上升。放線菌數量隨接種時期推后呈上升趨勢,隨接種濃度升高呈降低趨勢。根腫菌的接入對放線菌群落數量有一定的降低作用,早期接種病原懸液,放線菌群落結構不穩定,對其影響較大,隨接種時期推后接種,放線菌數量總體呈上升趨勢,但A/B、A/F下降顯著,根腫病發病嚴重。根腫病菌的引入改變微生物區系,增加真菌與細菌的數量,降低放線菌數量,降低了植物對病害的抵抗能力,增加了白菜受根腫病及其他病害侵染的風險。
4 結 論
根腫病菌對白菜幼苗的侵染,跟接種濃度存在一定的關系,隨接種濃度的升高,根腫病發病率增高。接種時期與根腫病發病率呈S形增長,子葉期白菜根系雖幼嫩,卻未進行根毛分化,根腫病病菌侵染位點少,隨著出現真葉開始,根毛分化增強,根腫病侵染位點增多,侵染幾率上升,但隨根系的不斷發育,根腫并侵染進入一個相對的穩定時期,六葉期以后根腫病發病不再隨接種時期推后而升高。六葉期之前高濃度發病率趨于穩定,而低濃度的有所提高。通過對不同接種時期及不同接種濃度處理的進一步研究,根腫病的發病與根系活力、氣孔導度、蒸騰速率等生理學指標相關,根腫病發病越高,其根系活力、蒸騰速率越大,而氣孔導度越低。防御酶系POD、PAL、PPO與發病率成反比,接種濃度越高發病率越高,相應的防御酶系統遭到破壞,其活性隨之降低,而丙二醛含量則與發病率成正比,接種濃度高,其細胞膜受脅迫越強,丙二醛累積,加速植物細胞膜的損傷和降低對病原侵染等的抵抗能力,易受其他病害的侵染。在低濃度侵染時,對根腫病的抗性系統響應提高,而隨著根腫病菌接種濃度的升高,抗性系統遭受損害,抗性降低。此研究所得結論對根腫病的研究和防治具有重要的指導意義。
[1] Dixon G R.The occurrence and economic impact ofand clab root disease[J]. Journal of plant growth regulation, 2009, 28(3): 194-202.
[2] Donald C, Poter I.Integrated control of clubroot[J]. Journal of plant growth regulation, 2009, 28(3): 289-303.
[3] Wallenhammar A C.Prevalence ofin a spring oilseed rape growing area in central Sweden and factors influencing soil infestation levels[J]. Plant pathology, 1996, 45: 710-719.
[4] Wallenhammar A C. Almquist C, Soderstrom M, et al. Infield distribution of Plasmodiophora brassicae measured using quantitative real-time PCR[J]. Plant pathology, 2012, 61(1): 16-28.
[5] 胡瓊, 鄭東穎, 檀根甲, 等. 影響油菜根腫病發生流行的因子分析[J].植物保護, 2014, 40(3): 157-160.
[6] 黃蓉, 黃瑞榮, 華菊玲, 等. 小白菜根腫病的接種方法及條件研究[J]. 中國農學通報, 2012, 28(31): 252-255.
[7] 盧曉霞, 康曉慧, 付菊梅, 等.油菜根腫病對油菜光合作用及酶活性的影響[J]. 廣東農業科學, 2013(24): 71-81.
[8] 姚建中.油菜根腫病對油菜產量的影響及其防治措施[J]. 安徽農學通報, 2009, 15(15): 93-94.
[9] 朱紅芳, 李曉鋒, 朱玉英, 等.根腫病對不結球白菜的生長及生理生化物質和活性氧代謝的影響[J]. 西北植物學報, 2015, 35(12): 2469-2476.
[10] 何晨陽, 王金生. 植物過敏反應中的生理生化變化[J]. 植物生理學通訊, 1996, 32(2): 150-154.
[11] 朱友林, 劉紀麟. 受玉米大斑病菌侵染后玉米抗感近等基因系SOD動態變化的研究[J]. 植物病理學報, 1996, 26(2): 133-137.
[12] Matsuyama N. Time-course alteration of lipid peroxidation and the activities of superoxide dismutase, catalase and peroxidase in blast-infected rice leaves[J]. Ann phytopathol soc jpn, 1983, 49: 270.
[13] 魏穎穎, 王鳳龍, 錢玉梅, 等. 煙草與黃瓜花葉病互作中過氧化氫酶活性的動態變化[J]. 植物病理學報, 2005, 35(4): 359-361.
[14] 陳佳華, 李霞, 鄭劍英, 等. 低溫下不同處理對甘薯生理指標和酚類代謝的影響[J].食品科技, 2018, 43(10): 45-49.
[15] 代麗, 宮長榮, 史霖, 等.植物多酚氧化酶研究綜述[J].植物生理科學, 2007, 23(6): 312-316.
[16] 胡瓊, 鄭東穎, 汪春, 等.油菜根腫病發病條件初探[J]. 江西農業大學學報, 2014, 36(4): 766-771.
[17] 高俊鳳. 植物生理學實驗指導[M]. 北京:高等教育出版社, 2006.
[18] 孫敬祖, 薛泉宏, 唐明, 等. 放線菌制劑對連作草莓根區微生物區系的影響及其防病促生作用[J]. 西北農林科技大學學報(自然科學版), 2009, 37(12): 153-158.
[19] 孫葉爍. 大白菜種質資源抗菌核病鑒定及其抗病機理研究[D]. 楊凌: 西北農林科技大學, 2019.
[20] 畢凱. 多組學研究揭示根腫菌生長發育與致病的分子機理[D]. 武漢: 華中農業大學, 2017.
[21] 王婷. 霜霉病作用下烏頭生理生化及內生和根際放線菌菌群變化特征研究[D]. 成都: 成都中醫藥大學, 2019.
[22] 李芳樂, 管玲玲, 胡鳳榮. 東方百合接種百合灰霉菌后生理生化指標分析[J]. 分子植物育種, 2020, 18(12): 4067-4074.
[23] 張秋芳, 呂春平, 貝昭賢, 等. 野外模擬增溫對亞熱帶杉木葉片膜脂過氧化及保護酶活性的影響[J].植物生態學報, 2016, 40(12): 1230-1237.
[24] 楊珍, 戴傳超, 王興祥, 等. 作物土傳真菌病害發生的根際微生物機制研究進展[J]. 土壤學報, 2019, 56(1): 12-22.
Effects ofInfection Time and Concentration on Growth Characteristics and Resistance of the Host
ZHOU Jinhua1, XIAO Yanan1, LAI Hangxian2, LI Yunju1*
(1. Yunnan Phosphate Chemical Group Co. Ltd/National Engineering Research Center of Phosphorus Resources Development and Utilization, Kunming 650600, China; 2. College of Natural Resources and Environment, Northwest A&F University, Yangling, Shaanxi 712100, China)
To inquire into thespores inoculation concentration and period for the host, interaction and the root of the disease resistance ofinfection after the host response.This study based on the seedling pot experiment, systematically studied the concentration of bacteria inoculated spores (105, 106, 107, 108cfu/mL) and period (0 d, 10 d, 20 d) impact on incidence of cabbage and defense enzyme activity.The results showed that there was a positive correlation between the incidence and the disease index and the concentration of inoculated disease spores 108cfu/mL was the best infection concentration, and the infection effect of inoculated Chinese cabbage seedlings was the best 10 days after the first true leaf appeared.After disease spores infection, the incidence of clubrotic disease was positively correlated with respiratory rate and stomatal conductance. Root activity increased and decreased with the disease index first. After disease spores infection, photosynthesis decreased, respiration increased and plant growth was inhibited. Defense enzymes POD, PAL and PPO were negatively correlated with the disease incidence, while malondialdehyde content was positively correlated with the disease incidence, and plant resistance to disease was reduced.This study provided references for Infection and prevention of clubroot disease.
infection concentration; infectious period; disease incidence; photosynthesis; resistance response
S436.341
A
2095-3704(2021)02-0136-10
2021-05-10
2021-05-30
基于根系和共生微生物特征探討高磷環境中農林復合系統途徑的生態修復(3181101535)-Fergus Sinclair 世界農用林業中心(ICRAF)
周金華,碩士,主要從事礦山生態修復與固廢資源化利用研究,1043495203@qq.com;*通信作者:李云駒,研究員,博士,332751784@qq.com。
周金華, 肖亞楠, 來航線, 等. 根腫病菌侵染時期與濃度對寄主生長特性及抗性的影響[J]. 生物災害科學, 2021, 44(2): 136-145.

