基于網絡藥理學結合分子對接探討中藥枸骨葉抗腫瘤的作用機制
龍書可 方玲子 林菲娟 鄧燕桃 姜倩倩


〔摘要〕 目的 從網絡視角出發,探討枸骨葉抗腫瘤的的可能作用機制,為其臨床使用提供依據。方法 通過中藥系統藥理學數據庫與分析平臺(TCMSP)、中醫百科全書數據庫(ETCM)及查閱相關文獻,獲取枸骨葉的有效成分及潛在靶點。利用人類基因組注釋數據庫(GeneCards)結果對比,獲得枸骨葉與腫瘤重合的潛在靶點基因,并通過Cytoscape 3.6.0軟件構建枸骨葉的“候選成分-作用靶點”網絡。利用String數據庫和Cytoscape 3.6.0軟件構建藥物抗腫瘤的蛋白質相互作用(PPI)網絡;并通過分子對接驗證和篩選潛在的核心化合物,利用DAVID生物信息資源數據庫對核心靶點進行基因本體論(GO)功能和京都基因與基因組百科全書(KEGG)通路富集分析。結果 共篩選出枸骨葉抗腫瘤的作用的靶點137個,對應13種有效成分。關鍵靶點涉及TP53、MAPK1、STAT3等。主要通過調控腫瘤壞死因子(TNF)信號通路、缺氧誘導因子-1(HIF-1)信號通路、磷脂酰肌醇3-激酶(PI3K/AKT)信號通路、腫瘤抑制因子P53信號通路、T細胞受體信號通路等發揮抗癌作用。涉及的癌種包括前列腺癌、胰腺癌、非小細胞肺癌等。分子對接結果顯示,長梗冬青苷與MAPK1能穩定地結合并通過蛋白氨基酸Gly32、Glu33、Gly34、Tyr36等發生相互作用。結論 枸骨葉抗腫瘤作用的主要機制涉及槲皮素、熊果酸、長梗冬青苷、芒柄花黃素為代表的多成分,以TP53、MAPK1及STAT3為代表的多靶點,以及細胞增殖、細胞凋亡、信號傳導為代表的多通路。
〔關鍵詞〕 枸骨葉;抗腫瘤;網絡藥理學;分子對接
〔中圖分類號〕R273? ? ? ?〔文獻標志碼〕A? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.03.021
〔Abstract〕 Objective To explore the anti-cancer potential of Gouguye (Ilicis Cornutae Folium) from a network perspective, so as to provide a theoretical basis for its clinical use. Methods The effective components and potential targets of Gouguye (Ilicis Cornutae Folium) were obtained through the traditional Chinese medicine (TCM) systems pharmacology database (TCMSP), the encyclopedia of TCM (ETCM) and refer to relevant literatures. By comparing the results of human genome database (GeneCards), the overlapping genes of Gouguye (Ilicis Cornutae Folium) and cancer were collected. The "candidate active components-targets" network of Gouguye (Ilicis Cornutae Folium) was built with Cytoscape 3.6.0 software. The anti-tumor protein interaction (PPI) network was constructed using the STRING database and Cytoscape 3.6.0 software. Through molecular docking verification and screening of potential core compounds. The gene ontology (GO) classification enrichment analysis and the kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis for the targets were carried out in DAVID database. Results Total 137 anti-tumor targets of Gouguye (Ilicis Cornutae Folium) were screened out, corresponding to 13 active components. Key targets involved TP53, MAPK1, STAT3, etc. It mainly plays an anti-cancer role by regulating tumor necrosis factor (TNF) signaling pathway, hypoxia induced-factor-1 (HIF-1) signaling pathway, phosphatidylinositol 3-kinase (PI3K/AKT) signaling pathway, tumor suppressor factor P53 signaling pathway, T cell receptor signaling pathway, etc. The cancers involved prostate cancer, pancreatic cancer, non-small cell lung cancer, etc. Molecular docking results showed that pedunculoside and MAPK1 could bind stably and interact with each other through protein amino acids such as Gly32, Glu33, Gly34 and Tyr36. Conclusion The main mechanism of Gouguye (Ilicis Cornutae Folium) in treating cancer is involved to multiple compounds represented by quercetin, ursolic acid, pedunculoside and formononetin, and multiple targets represented by TP53, MAPK1 and STAT3, and multiple signaling pathways represented by cell proliferation, apoptosis and signal transduction.
〔Keywords〕 Gouguye (Ilicis Cornutae Folium); anti-cancer; network pharmacology; molecular docking
近年來,腫瘤患者的新發病例越來越多,嚴重威脅人類的身體健康,我國癌癥統計數據顯示,全國癌癥新發病例數為380.4萬例,死亡病例229.6萬例[1]。隨著化療、靶向治療及免疫治療的應用,越來越多腫瘤患者從中獲益,而中醫藥治療作為我國腫瘤治療的重要組成部分,采取辨病與辨證相結合的辦法,可以配合腫瘤放化療等治療手段,有效減輕毒副作用,抑制瘤體的增大,減少不良反應的發生,利于改善患者對腫瘤治療的耐受能力[2]。
枸骨葉為冬青科植物枸骨Ilex cornuta Lindl.ex Paxt.的干燥葉,具有清熱養陰、平肝益腎作用,用于肺癆咯血、骨蒸潮熱、頭暈目眩等癥狀[3]。現代研究[4-8]表明,枸骨葉具有降脂、抗炎、抗氧化和抗腫瘤等作用,其中主要化學成分長梗冬青苷、熊果酸、槲皮素等對多種惡性腫瘤均有較好的治療作用。臨床運用中,含枸骨葉的方劑“扶肺煎”治療肺癌的藥理作用已有相關報道[9],但枸骨葉基礎研究較少,其抗腫瘤的藥用有效成分、靶點、通路和相關分子作用機制未見報道。網絡藥理學是結合系統生物學、計算機技術及生物信息學的新興學科,能整體系統地分析“藥物-靶點-通路-疾病”之間的相互關系,為中醫藥的現代化研究提供了新的研究思路。本研究利用網絡藥理學方法探索枸骨葉的主要化學成分、核心靶點以及與腫瘤之間的相互關系,為進一步闡明枸骨葉抗腫瘤的作用機制提供思路和理論基礎[10-11]。
1 材料與方法
1.1? 數據庫、分析平臺及軟件來源
中藥系統藥理學分析平臺(TCMSP, https://tcmspw.com/tcmsp.php);中醫百科全書數據庫(ETCM,
http://www.tcmip.cn/ETCM/);有機小分子生物活性數據庫(PubChem, https://pubchem.ncbi.nlm.nih.gov/);Swiss TargetPrediction(http://www.swisstargetprediction.ch/);人類基因數據庫(GeneCards, https://www.
genecards.org/);DisGeNET數據庫(https://www.disgenet.org/);DAVID數據庫(https://david.ncifcrf.gov/);RCSB蛋白數據庫(https://www.rcsb.org/);STRING數據庫(https://string-db.org/);Metascape數據庫(https://metascape.org/gp/);在線云平臺OmicShare網站(https://www.omicshare.com/);網絡拓撲屬性分析軟件Cytoscape 3.6.0;分子對接軟件Autodock vina 1.1.2;PyMOL 2.3.2(https://pymol.org/2/);LigPlot 2.2(https://www.ebi.ac.uk/thornton-srv/software/LigPlus/)。
1.2? 研究方法
1.2.1? 枸骨葉活性成分檢索與靶點預測? 借助TCMSP數據庫,以“枸骨葉”為關鍵詞搜索活性成分,根據藥物ADME(吸收、分布、代謝及排泄)特性,選取生物利用度(OB)≥30%、類藥性(DL)≥0.18為篩選條件,并根據文獻檢索增加枸骨葉中有明確藥理活性的主要成分,將檢索所得各個主要成分于TCMSP數據庫、ETCM數據庫中檢索相關靶點,對于未找到靶點的化合物從PubChem數據庫中查找并下載2D結構,導入Swiss Target Prediction在線數據庫中進行靶點預測,Swiss Target Prediction在線數據庫廣泛應用于中藥作用機理和潛在治療靶點的研究[12]。剔除預測概率為“0”的靶點。將靶點名稱輸入到STRING數據庫中統一為規范基因名。
1.2.2? 疾病及相關基因信息數據庫建立? 從GeneCard數據庫中以“cancer”為關鍵詞搜集腫瘤的疾病作用靶點,在DisGeNET數據庫中以“Malignant Neoplasms”為關鍵詞搜索,得到的靶點合并去重后,將其導入EXCEL表格中進行標準化處理以便后續的統計分析。
1.2.3? 蛋白互作PPI網絡模塊分析與關鍵靶點篩選? 將枸骨葉化合物預測得到的靶點與腫瘤疾病靶點求交集,將共有靶點導入STRING數據庫獲取蛋白質相互作用(protein-protein interaction, PPI)網絡,導入Cytoscape 3.6.0軟件進行可視化分析,確認了PPI網絡中的關鍵靶基因并進行分析。
1.2.4? 分子對接? 選擇PPI網絡中度值靠前的靶點蛋白,從RCSB蛋白數據庫下載蛋白三維結構,從PubChem數據庫下載化合物結構,將準備好的蛋白文件、配體文件、化合物文件以及腳本放入相應文件夾,利用Autodock vina 1.1.2進行半柔性對接。選取對接結合能量最低的構象用于對接結合模式分析,并使用PyMOL2.3.2和LigPlot 2.2進行作圖。
1.2.5? GO功能富集和KEGG通路富集? 將枸骨葉與腫瘤疾病的共有靶點映射到STRING數據庫,進行GO功能富集和KEGG通路富集,從生物過程及信號通路角度分析枸骨葉治療腫瘤可能的作用機制。
2 結果
2.1? 枸骨葉活性成分與候選靶點
通過TCMSP數據庫檢索的枸骨葉化學成分56個,以OB≥30%,DL≥0.18的原則,篩選出枸骨葉活性化合物10個,結合文獻查閱結果[13-15],增加4個雖然OB、DL值較低,但含量較高并且有藥理活性的成分:齊墩果酸、羽扇豆醇、金絲桃苷、熊果酸納入研究。最終得到14個活性成分。見表1。
2.2? 枸骨葉抗腫瘤作用靶點及主要成分預測
通過TCMSP數據平臺、PubChem數據庫查找相關的化合物并進行靶點預測,對相同靶點去重篩除,最終得到枸骨葉潛在的靶點信息259個。
2.3? 腫瘤相關靶點基因的獲取
從GeneCard數據庫中以“cancer”為關鍵詞搜集腫瘤的疾病作用靶點,以score≥20作為疾病靶點篩選的標準,得到780個靶點,在DisGeNET數據庫中以“malignant neoplasms”為關鍵詞搜索,以EI≥1,score≥0.1作為篩選標準得到955個靶點,將搜集到的靶點合并去重后,共獲得腫瘤靶點基因1 529個。將枸骨葉的靶基因與腫瘤相關基因進行映射,得到共同靶基因137個。
2.4? 成分-靶點網絡構建
在Cytoscape 3.6.0軟件中導入共同靶基因,剔除非作用于腫瘤疾病相關靶點的化合物構建成分-靶點網絡。此網絡共包括節點150個,其中13個節點為活性成分(并非所有活性成分均可作用于腫瘤相關靶點,剔除1個未作用于任何靶點的活性成分),共有137個節點為作用靶點,270條作用連線。可見枸骨葉抗腫瘤具有多成分、多靶點的特點。見圖1。
2.5? 核心靶點PPI網絡的構建
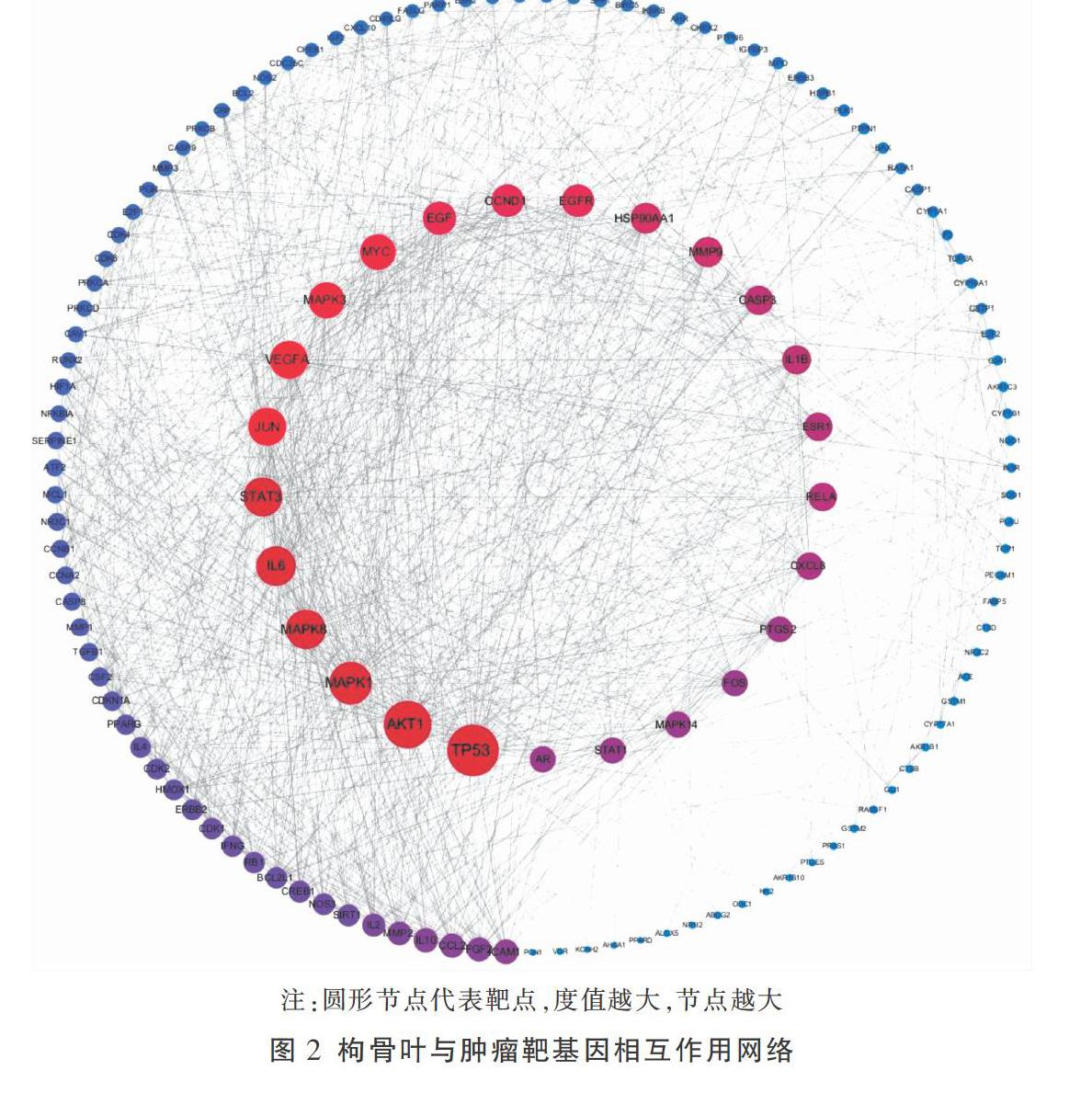
將枸骨葉與腫瘤的靶基因導入STRING數據庫,選擇物種為“Homo sapiens”進行操作,最低相互作用閥值設為高等“high confidence=0.7”,構建PPI網絡,并利用Cytoscape 3.6.0軟件對PPI網絡進行拓撲結構分析,最終116個基因參與了關聯網絡的構建,包含了993個作用連線。見圖2。借助軟件中Network analyzer插件,分析網絡圖的拓撲學參數,圓形節點的大小由其度值大小決定,度值越大,節點越大。網絡拓撲學結構分析顯示,全網平均度值為17.12,篩選度值≥30的核心靶點包括:TP53、MAPK1、STAT3、IL6、MAPK8、VEGFA、MYC、MAPK3、CCND1、EGF、EGFR、P90AA1、ESR1、CASP3、CXCL8、STAT1、RELA、FOS、PTGS2,提示枸骨葉抗腫瘤作用可能與這些靶點顯著相關。將這19個核心靶點導入Metascape數據庫,獲得靶點對應的蛋白功能。見表2。表明枸骨葉抗腫瘤作用中有轉錄因子、酶和信號通路等相關蛋白物質和信號通路的參與。
2.6? 分子對接結果及分析
利用AutoDock vina 1.1.2軟件,對PPI網絡中度值較大的3個靶蛋白(TP53、MAPK1、STAT3)與枸骨葉中預測靶點較多的5個成分進行分子對接。對接結果顯示(表3),分子與標靶蛋白的最低結合能均小于0,說明配體與受體均可以自發結合,其中長梗冬青苷與P53、STAT3、MAPK1蛋白的對接結合能均小于-5 kcal·mol-1,結合能分別為-6.8、-6.7、-8.6 kcal·mol-1。將長梗冬青苷與MAPK1的對接結果利用Pymol軟件繪圖,由圖可見,化合物的活性口袋中呈現出緊湊的結合模式。化合物和蛋白氨基酸Gly32、Glu33、Gly34、Tyr36、Gly37、Lys54、Val39、Ser153、
Leu156形成強烈的疏水性相互作用;與氨基酸Tyr113形成鍵長為3.12?的氫鍵作用;與氨基酸Asp111形成鍵長為3.28?的氫鍵作用;與氨基酸Asp167形成鍵長為2.99?和2.89?的氫鍵作用,這些相互作用使得蛋白與化合物形成穩定的復合物。見圖3。
2.7? 潛在靶點生物學功能分析
為了闡明枸骨葉抗腫瘤作用的分子機制,利用DAVID數據庫對其活性成分對應的潛在靶點進行了GO和KEGG分析,GO功能注釋是通過生物過程、分子功能和細胞組分對基因進行注釋和分類。設定統計標準P<0.05,共富集到638條生物過程,對P值作檢驗校正,選取生物過程、分子功能及細胞組分排名前15的基因分別做條形圖,由圖4可知,生物過程排名靠前的有DNA轉錄調控、RNA聚合酶Ⅱ啟動子轉錄的正調控、凋亡過程的負調控等;分子功能主要富集在酶結合區、蛋白結合、蛋白激酶結合、轉錄因子結合,主要涉及蛋白和轉錄因子活性;細胞組分分析中靠前的是胞液、胞外間隙、核質、細胞核等,主要集中在胞液和細胞核上,反映了腫瘤發病涉及體內多個生物過程的異常,同時表明枸骨葉可能是通過調節這些生物過程發揮其抗腫瘤作用。
KEGG通路分析得到枸骨葉抗腫瘤相關通路,分析排名前30條信號通路并作氣泡圖,得知枸骨葉主要富集在TNF信號通路、HIF-1信號通路、PI3K/AKT信號通路、p53信號通路、T細胞受體信號通路等。這些生物過程與腫瘤的發生發展密切相關。見圖5。
3 討論
3.1? 腫瘤發生、發展的分子機制研究
遺傳和表觀遺傳的改變使得細胞逃避控制其存活和遷移的機制不斷增殖,導致癌癥的產生[16]。Hanahan等[17]根據現代腫瘤發生發展機制,提出了腫瘤(hallmarks)學說,包括維持增殖信號、逃避生長抑制、避免免疫破壞、增強無限復制、癌性促炎反應、激活侵襲轉移、誘導血管生成、基因組不穩定與突變、細胞死亡抵抗、細胞能量代謝失衡等。其中MAPK、PI3K/Akt、mTOR、EGFR等促進細胞周期,推動細胞增殖,TP53、NF2、LKB1上皮極性蛋白可以逃逸抑癌蛋白RB的生長抑制,此外,癌細胞還通過突變、促炎反應、誘導血管生成等制造免疫抑制腫瘤微環境進行增殖、向周邊浸潤、轉移逃避免疫破壞。
3.2? 枸骨葉抗腫瘤的主要活性成分與關鍵靶點探討
本研究得到的枸骨葉治療腫瘤的的成分靶點網絡圖顯示槲皮素、山奈酚、異鼠李素、芒柄花黃素、長梗冬青苷等14種化合物的連接度與介度較高,可作用于多個腫瘤靶點,提示這些成分可能是枸骨葉治療腫瘤的重要成分。王梓萱等[18]研究槲皮素能通過誘導P53非依賴性的G2/M細胞周期阻滯和細胞凋亡,從而實現對腫瘤細胞增殖的抑制作用。現代研究[19]表明,槲皮素可以調節與癌癥相關的多種miRNAs,包括let-7、miR-21、miR-146a和miR-155,從而抑制癌癥的發生和發展。張磊等[20]發現山奈酚能誘導三陰性乳腺癌(triple negative breast cancer,TNBC)MDA-MB-231細胞中乳腺癌耐藥蛋白的表達并下調抗腫瘤藥物對MDA-MB-231細胞的殺傷作用,還有研究[21-22]表明山奈酚可誘導G1期以下細胞聚集,并通過抑制內質網受體、Survivin凋亡抑制基因和ERα從而導致細胞凋亡。朱琳等[23]體外實驗研究發現異鼠李素處理A549細胞后,流式細胞術及免疫細胞化學檢測表明異鼠李素通過下調bcl-2基因和PCNA蛋白表達,上調抑癌基因P53、bax及Caspase-3基因等來抑制腫瘤細胞的生長、增殖及誘導細胞凋亡。在體動物實驗也觀察到,異鼠李素在體內也具有明顯的抗腫瘤作用,可顯著降低癌細胞增殖指數,誘導凋亡。李自全等[24]研究發現芒柄花黃素可抑制NSCLC細胞增殖,加速細胞凋亡發生,可能通過下調Cyclin E1表達而影響細胞周期,并通過調控Bcl-2和Bax表達促使細胞凋亡發生。陳曦等[25]發現長梗冬青苷可以抑制炎癥相關癌癥(colitis associated cancer, CAC)小鼠結腸miR-29a表達,上調miR-29a下游靶蛋白TET3的表達,同時抑制STAT3蛋白表達,可能是其干預CAC小鼠模型中結腸炎——癌病理發展的部分機制。還有研究[26]表明長梗冬青苷可通過逆轉由miR-31-5p和miR-223-3p過表達而引起的Lats2和Apc的下調,顯著減輕DSS/AOM對小鼠腸道的損傷,從而預防CAC。
PPI網絡分析結果發現,TP53、MAPK1、STAT3、IL6、MAPK8、VEGFA、MYC、MAPK3、CCND1、EGF、EGFR等19個靶點是PPI網絡的關鍵靶蛋白。主要涉及TNF信號通路、HIF-1信號通路、PI3K/AKT信號通路、p53信號通路、T細胞受體信號通路等,結合KEGG通路分析結果得出,主要富集的癌種為前列腺癌、胰腺癌、非小細胞肺癌、慢性骨髓白血病、神經膠質瘤等。TP53是位于染色體17的短臂上的腫瘤抑制基因,通常調節細胞周期機制的活性。已觀察到P53基因的突變在多種類型的人類癌癥中具有高流行性,并且經常伴隨點突變發生[27]。Zawlik等[28]研究表明膠質母細胞瘤經常顯示TP53通路的基因改變,在膠質母細胞瘤中,MDM2 SNP309 G等位基因和TP53密碼子72 Pro/Pro之間存在顯著相關性。MAPK1、MAPK8、MAPK3是MAP激酶家族的成員,又稱為細胞外信號調節激酶,是多種生物化學信號的整合點,參與細胞增殖、分化、轉錄調控和發育等多種過程[29]。Chen等[30]研究證明MAPK1是miR-378的直接靶點,MAPK1的異位表達挽救了miR-378被抑制細胞的遷移和侵襲,從而顯著降低了前列腺癌細胞生長。
本研究的分子對接結果提示,枸骨葉中的活性成分與TP53、MAPK1、STAT3有較好的親和力,其化合物抗腫瘤的作用需要進一步的生物實驗驗證。
綜上所述,基于對枸骨葉有效成分進行的靶點預測,并對潛在靶點進行了PPI研究,以及GO和KEGG富集分析,發現枸骨葉中對應核心靶點較多的成分有槲皮素、芒柄花黃素、長梗冬青苷、熊果酸等,這些成分可能是枸骨葉發揮抗腫瘤的潛在活性成分。我們推測,枸骨葉抗腫瘤作用是多化合物、多靶點、多途徑的直接或間接協同作用的結果。本研究為將來的實驗設計及進一步探索提供了依據,后續將通過藥理學實驗驗證枸骨葉的抗腫瘤藥理活性作用,并進行枸骨葉中多種化合物的協同作用等方面的相關研究。
參考文獻
[1] 曹毛毛,陳萬青.中國惡性腫瘤流行情況及防控現狀[J].中國腫瘤臨床,2019,46(3):145-149.
[2] 余? 婷,楊? 柱,龍奉璽,等.基于網絡藥理學探討黃精-百合藥對抗癌作用的機制[J].中國實驗方劑學雜志,2020,26(5):168-177.
[3] 國家藥典委員會.中華人民共和國藥典:一部[S].北京:中國醫藥科技出版社,2015:250
[4] 左文健,梅文莉,曾艷波,等.枸骨的化學成分和藥理活性研究進展[J].安徽農業科學,2011,39(27):16560-16562.
[5] 周思祥,姚志容,李? 軍,等.枸骨葉的化學成分研究[J].中草藥,2012,43(3):444-447.
[6] 黎? 敏,楊武斌,米本中,等.槲皮素抗癌作用機制相關研究報道[J].中藥藥理與臨床,2018,34(2):129-132,24.
[7] 陳姝瑾,王? 淳,劉春英.熊果酸對肺癌細胞A549自噬相關蛋白的影響[J].中華中醫藥學刊,2020,38(6):86-90,268.
[8] 陳? 曦,程? 博,宋? 寧,等.長梗冬青苷對CAC模型小鼠結腸miR-29a/TET3及STAT3的作用[J].中藥藥理與臨床,2019,35(5):39-42.
[9] 許繼平,裘維焰,應栩華,等.扶肺煎對原發性肺癌抗轉移的臨床研究[J].中國中醫藥信息雜志,2000,7(8):40-41.
[10] 黃鉦凱,梁明坤,吳發勝,等.基于網絡藥理學的左金丸治療胃癌作用機制研究[J].湖南中醫藥大學學報,2020,40(6):709-716.
[11] 李亞梅,彭? 壯,徐? 佳,等.夏枯草抗乳腺癌成分-靶點-通路的網絡藥理學研究[J].湖南中醫藥大學學報,2019,39(8):1021-1027.
[12] GFELLER D, GROSDIDIER A, WIRTH M, et al. SwissTargetPrediction: a web server for target prediction of bioactive small molecules[J]. Nucleic Acids Research, 2014, 42(Web Server issue): W32-W38.
[13] 何? 丹,杜冰曌,楊鑫瑤,等.冬青屬常用藥用植物的藥理作用及臨床應用研究進展[J].中國實驗方劑學雜志,2020,26(16):218-227.
[14] 蔡? 偉.HPLC法測定枸骨葉中金絲桃苷的含量[J].北方藥學,2016,
13(1):3.
[15] 施之琪,王洛臨,曾文雪,等.HPLC同時測定枸骨葉中熊果酸和齊墩果酸的含量[J].江西中醫學院學報,2013,25(1):58-60.
[16] 洪梓德,莫志賢.中藥抗腫瘤機制中的11種信號通路[J].中國實驗方劑學雜志,2018,24(21):205-218.
[17] HANAHAN D, WEINBERG R A. Hallmarks of cancer: The next
generation[J]. Cell, 2011,144(5): 646-674.
[18] 王梓萱,周? 靜,唐? 玥,等.槲皮素誘導腫瘤細胞P53非依賴的G_2/M周期阻滯和凋亡[J].中國藥理學與毒理學雜志,2018,32(10):790-796.
[19] KIM D H, KHAN H, ULLAH H, et al. MicroRNA targeting by quercetin in cancer treatment and chemoprotection[J]. Pharmacological Research, 2019, 147: 104346.
[20] 張? 磊,林曉萌,曹哲麗,等.山奈酚誘導三陰性乳腺癌細胞MDA-MB-231中乳腺癌耐藥蛋白的表達并下調抗腫瘤藥物對MDA-MB-231細胞的殺傷作用[J].科學技術與工程,2019,19(20):91-96.
[21] 張? 敬,史曉宇,孟? 瑋,等.山萘酚通過下調ERRα抑制非小細胞肺癌A549細胞的侵襲和遷移[J].中國腫瘤生物治療雜志,2018,25(12):1230-1236.
[22] CHUWA A H, SONE K, ODA K, et al. Kaempferol, a natural
dietary flavonoid, suppresses 17β-estradiol-induced survivin expression and causes apoptotic cell death in endometrial cancer[J]. Oncology Letters, 2018, 16(5): 6195-6201.
[23] 朱? 玲,王正榮,周黎明,等.異鼠李素對肺癌的作用及其抗腫瘤機制的初步探討[J].航天醫學與醫學工程,2005,18(5):381-383.
[24] 李自全,孟祥嬌.芒柄花素對人非小細胞肺癌細胞增殖、凋亡的影響及相關機制探討[J].中國實驗方劑學雜志,2016,22(20):138-142.
[25] 陳? 曦,程? 博,宋? 寧,等.長梗冬青苷對CAC模型小鼠結腸
miR-29a/TET3及STAT3的作用[J].中藥藥理與臨床,2019,35(5):39-42.
[26] CHEN G, FENG Y, LI X Z, et al. Post-transcriptional gene regulation in colitis associated cancer[J]. Frontiers in Genetics, 2019, 10: 585.
[27] 鄒柯涵,徐? 敏,羅書笛,等.CK、Ki67、Gly-3及P53在肝細胞癌組織中的表達[J].湖南中醫藥大學學報,2017,37(3):326-328.
[28] ZAWLIK I, KITA D, VACCARELLA S, et al. Common polymorphisms in the MDM2 and TP53 genes and the relationship between TP53 mutations and patient outcomes in glioblastomas[J]. Brain Pathology (Zurich, Switzerland), 2009, 19(2): 188-194.
[29] 柴冬亞,袁佳琪,周軼平.MAPK信號通路影響腫瘤多藥耐藥的研究進展[J].中國新藥雜志,2019,28(8):948-953.
[30] CHEN Q G, ZHOU W, HAN T, et al. MiR-378 suppresses prostate cancer cell growth through downregulation of MAPK1 in vitro and in vivo[J]. Tumor Biology, 2016, 37(2): 2095-2103.

