糖尿病合并骨折患者圍術期血漿IGF-1、NPY與BAP的變化
李琪,李琳,孟珊珊,張林忠
(1.山西醫科大學麻醉學院,山西 太原 030001;2.山西醫科大學第二醫院麻醉科,山西 太原 030001)
糖尿病是一種代謝性疾病,隨著病程進展會對患者機體多個器官、組織產生影響。目前,糖尿病對骨骼健康的影響越來越受到重視,如糖尿病患者常伴有骨代謝和礦物質代謝異常[1],增加骨折風險,影響骨折愈合。糖尿病患者平均骨折愈合時間延長87%,且延遲愈合、不愈合、再脫位或假關節形成的并發癥發生率增加3.4倍[2]。胰島素樣生長因子-1(insulin like growth factor-1,IGF-1)、神經肽Y(neuropeptide Y,NPY)及骨堿性磷酸酶(bone alkaline phosphatase,BAP)對骨代謝調節發揮重要作用[3-5],臨床上它們在糖尿病患者骨折愈合方面鮮有報道。本研究為回顧性研究,旨在通過觀察糖尿病合并骨折的患者圍術期血漿IGF-1、NPY及BAP的表達變化,探討其對糖尿病患者骨折愈合的影響。
1 資料與方法
1.1 一般資料 選取2018年9月至2019年3月在蛛網膜下隙麻醉下行下肢骨折手術患者70例,年齡30~70歲,美國麻醉醫師協會(American society of anesthesiologists,ASA)分級Ⅰ~Ⅱ級。根據患者是否有2型糖尿病分為糖尿病組和對照組,兩組各35例。兩組患者一般資料比較,差異均無統計學意義(P>0.05,見表1)。糖尿病組患者需滿足世界衛生組織2型糖尿病的診斷標準,術前空腹血糖維持在8.3 mmol/L(150 mg/dL)左右,最高不超過11.1 mmol/L(200 mg/dL),尿糖檢查為陰性或弱陽性,尿酮體陰性。患者術中及術后均無輸血治療。排除標準:患者有嚴重心、肝、腦、肺、腎等器官功能障礙;全身性嚴重感染;出凝血功能障礙;中樞神經系統疾病及脊柱外傷或有嚴重腰背痛病史等。經由山西醫科大學第二醫院倫理委員會批準(批件號2019YX162號),入選患者均簽署知情同意書。

表1 患者一般資料比較
1.2 手術方法 患者進入手術室后,開放上肢靜脈通路,常規監測血壓、心電圖、脈搏以及血氧飽和度。所有患者均采用蛛網膜下隙麻醉,側臥位,在L3~4棘突間隙穿刺,穿刺點用1%羅哌卡因(生產批號:H20140763,AstraZeneca公司)做皮內、皮下和棘間韌帶逐層浸潤。使用穿刺針將蛛網膜穿破,腦脊液流出后注入0.67%羅哌卡因2.0~3.0 mL,使無痛平面控制在T10水平。所有患者均行單側股骨近端防旋髓內釘固定術(proximal femoral nail antirotation,PFNA),術中行對癥治療,維持血流動力學平穩。
1.3 檢測指標 分別于術前、術后24 h抽取肘靜脈血2 mL,注入含乙二胺四乙酸的離心管中混勻,以3 000 r/min速度離心15 min,分離血漿儲存于-70 ℃冰箱中保存待測,采用酶聯免疫吸附法(enzymelinked immunosorbent assay,ELISA)測定血漿中IGF-1、NPY及BAP的含量(試劑盒由上海江萊生物科技有限公司提供)。
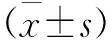
2 結 果
2.1 兩組患者圍術期血漿指標含量變化
2.1.1 血漿IGF-1含量變化 兩組患者骨折術后24 h血漿IGF-1含量均較術前顯著升高(P<0.05);但與對照組相比,糖尿病組患者術前、術后24 h血漿IGF-1含量均較低,差異有統計學意義(P<0.05,見表2)。

表2 兩組術前、術后24h IGF-1含量比較
2.1.2 血漿NPY含量變化 兩組患者術后24 h血漿NPY含量均明顯高于術前(P<0.05);與對照組比較,糖尿病組患者術前血漿NPY含量明顯較高(P<0.05),術后24 h血漿NPY含量差異無統計學意義(P>0.05),而血漿NPY的升高幅度(差值)以對照組更為明顯(P<0.05,見表3)。

表3 兩組術前、術后24h NPY含量比較
2.1.3 血漿BAP含量變化 與術前相比,兩組患者術后24 h血漿BAP含量均升高(P<0.05);糖尿病組術前血漿BAP的含量較對照組高(P<0.05),術后24 h血漿BAP與對照組比較差異無統計學意義(P>0.05,見表4)。

表4 兩組術前、術后24h BAP含量比較
3 討 論
骨折愈合過程分以下四個階段:血腫形成、纖維性骨痂形成、骨性骨痂形成及骨痂改建或重塑。在血腫形成階段,大量生長因子形成,信號通路被激活,促進炎癥反應,從而調節骨愈合。
IGF-1在細胞生長、分化、存活和細胞周期進展中起著核心作用,對骨的形成有明顯的促進作用,適當IGF-1水平對于獲得峰值骨量是必要的。血清IGF-1水平與骨折后功能恢復能力顯著相關[6],其可促進骨髓間充質干細胞、軟骨細胞和成骨細胞的增殖分化,促進骨基質的形成,有利于骨愈合[7]。NPY是骨內平衡的主要調節因子之一,通過促進間充質干細胞成骨從而促進骨折后骨愈合,也可直接作用于骨祖細胞促進骨修復[8]。BAP是堿性磷酸酶的骨特異性亞型,是成骨細胞的一種特異性產物,可以作為評價骨周轉率的一種典型的骨形成標志物,在骨基質鈣化過程中起著重要作用。腰椎骨折患者骨折后8周內,BAP水平均高于基線值,可能是骨折創傷使成骨細胞活性增加釋放BAP所致[9]。本研究觀察了糖尿病與非糖尿病對照的患者血漿IGF-1、NPY及BAP三種因子在圍術期含量的變化,發現術后24h血漿三種因子的含量較術前均顯著升高,表明它們在骨折愈合早期可能就開始發揮作用。
糖尿病患者發生骨折風險較高,胰島素分泌不足、高血糖和氧化應激是影響糖尿病患者骨折愈合的因素,它們可以降低成骨細胞分化,增加破骨細胞活性,促進軟骨細胞和成骨細胞的凋亡,從而影響糖尿病患者骨折愈合[2]。糖尿病患者骨折延遲愈合的部分原因可能是生長因子和細胞因子水平的變化。本研究發現,盡管糖尿病患者血漿IGF-1、NPY及BAP的水平在術后均較術前明顯升高,但術后糖尿病患者血漿IGF-1的含量較對照組明顯降低,術后BAP和NPY水平和對照組比變化不明顯,但NPY術后的升高幅度明顯低于非糖尿病患者。這提示我們IGF-1、NPY及BAP在糖尿病患者骨折圍術期發揮作用的時間或效能可能存在差異,需要進一步深入研究。
糖尿病患者IGF-1水平降低[3,10],IGF-1對成骨細胞的刺激作用受到高糖環境的抑制。高糖環境顯著破壞成骨細胞對IGF-1的反應性,降低了成骨細胞的增殖和功能反應,而持續暴露于高糖水平導致的細胞功能缺陷可能會使骨形成受損[2]。糖尿病患者在術前和術后血漿IGF-1水平均較對照組低,可能不利于骨折的愈合。NPY作為一種多功能神經肽,骨折、手術等應激時明顯升高。胰島素對NPY神經元有抑制作用,胰島素信號缺乏可顯著上調NPY表達[11]。2型糖尿病患者下丘腦弓狀核與室旁核等區域過度分泌NPY,脂肪組織和脂肪細胞也表達和釋放NPY[4]。由于2型糖尿病患者脂肪組織增加及其特征性分布,使脂肪組織成為NPY的潛在來源,且長期高血糖使感覺神經受損,脊髓背根神經節表達NPY增加[12]。因此,糖尿病患者基礎NPY水平高于正常人,然而,糖尿病組術后NPY升高幅度低于對照組,提示糖尿病患者骨折應激能力較非糖尿病患者低,不利于骨折后骨修復。對于2型糖尿病患者,其血清BAP水平明顯高于健康體檢者[5],在未控制血糖的糖尿病患者中BAP值較血糖控制良好的患者略有升高[13]。Muljacic等[14]報道,BAP的含量與愈合組織大小成正比。在骨折固定欠佳、愈合延遲、骨痂明顯時,堿性磷酸酶(alkaline phosphatase,ALP)和BAP呈現明顯增高,而骨折固定良好、快愈合時則增加幅度較小無明顯變化。可見,糖尿病患者BAP的持續升高與骨折延遲愈合密切相關。
綜上所述,IGF-1、NPY及BAP作為骨代謝的調控因子,均參與骨愈合修復過程。糖尿病患者骨折術后早期IGF-1降低、NPY升高幅度較低、BAP持續升高可能與骨折延遲愈合相關。這為糖尿病患者骨折延遲愈合、不愈合提供早期診斷可能,并可能為骨代謝性疾病治療靶點拓展新的思路,但高血糖狀態對IGF-1、NPY及BAP影響機制還需要進一步研究。

