麥秸對湖羊瘤胃發酵代謝及腸道組織形態的影響
陳 希 姜婉茹 葉平生 王換換 閆書平 謝娜娜 聶信天 張源淑
(南京農業大學 農業農村部動物生理生化重點開放實驗室, 南京 210095)
粗飼料是指天然水分含量在60%以下,干物質中粗纖維含量在18%以上,并以風干形式飼喂的一種飼料[1],如牧草、農作物秸稈、酒糟等。粗飼料是瘤胃微生物和宿主動物重要的營養來源,并對維持反芻動物腸道穩態,提高生產力有重要作用[2]。
湖羊是太湖平原的重要家畜之一,具有生長發育快、泌乳性能好、多胎和產肉性能理想等優良性狀。湖羊等反芻動物作為復胃動物,其中瘤胃是最大的胃,飼喂不同的粗飼料,如苜蓿干草或玉米秸稈會改變瘤胃中營養物質的含量,從而使瘤胃發酵的類型發生變化[3]。纖維是反芻動物粗飼料中的主要成分,也是造成反芻動物與單胃動物營養差異的主要原因[4-5]。董春曉等[6]研究表明,日糧添加粗飼料不僅有利于反芻動物生產性能的提高,還能減少瘤胃食糜粘附,維持瘤胃健康。日糧的非纖維性碳水化合物/中性洗滌纖維(NFC/NDF)比值會影響反芻動物瘤胃的pH,隨著NFC/NDF的增大,瘤胃pH降低,乙酸含量顯著降低,但丙酸和丁酸含量則呈升高趨勢[7]。用不同全混合日糧(TMR)的飼料組合飼喂泌乳奶牛,通過體外瘤胃發酵試驗發現,不同組中泌乳奶牛瘤胃中乙酸、丙酸和丁酸生成動力學參數存在顯著差異[8]。目前,國內外不同類型的飲食對反芻動物,尤其是湖羊瘤胃pH、揮發性脂肪酸(Volatile fatty acid, VFA)濃度、瘤胃纖維素酶含量影響的報道較少。而準確掌握不同類型的飼料條件下湖羊瘤胃pH、VFA含量、瘤胃纖維素酶含量的變化對監測湖羊身體狀況、調整營養水平、提高機體免疫力、降低應激、減少代謝紊亂的發生具有重要的理論與現實意義。
苜蓿干草是一種優質的粗飼料源,具有高含量的粗蛋白質,低含量纖維,易于消化吸收等營養特性[9],素有“牧草之王”的美譽[10]。但由于我國目前人均耕地面積的減少,地理環境、氣候等因素造成草原退化等導致我國優質苜蓿產量低下,不足以滿足養殖業的需求。作為糧食生產大國,我國農作物秸稈資源豐富,如水稻秸稈、小麥秸稈、玉米秸稈、高粱秸稈等[11]。小麥和大麥秸稈具有纖維豐富、產量大、分布廣泛、成本低、易于獲得,且能經常更新等優點,也是草食家畜重要的粗飼料來源。然而,農作物秸稈的合理利用率較低,甚至被農戶就地焚燒,浪費資源且造成環境和空氣污染[12]。前期研究發現,采用苜蓿干草與麥秸分別作為湖羊日糧粗飼料來源,以麥秸作為粗飼料飼喂,湖羊采食量顯著低于苜蓿,但體增重和血液生化指標等無顯著差異[13]。本研究擬從胃腸道,特別是瘤胃代謝的角度,通過觀察分析胃腸道pH、內容物排空、組織學、瘤胃脂肪酸及代謝異常產物脂多糖(Lipopolysaccharide, LPS)釋放和臟器指數等指標,探究麥秸飼喂對湖羊瘤胃發酵、代謝及胃腸道組織形態等的影響,以期豐富秸稈類粗飼料在反芻動物中的合理使用,平衡飼料利用結構,降低飼養成本。
1 材料與方法
1.1 主要儀器和試劑
RM2235石蠟切片機(德國徠卡公司);BH-2型顯微鏡(日本奧林巴斯株式會社);ZX-GF101-1-BS電熱恒溫鼓風干燥箱(上海躍進醫療器械有限公司);6890 N氣相色譜儀(Agilent 公司,美國);MIKRO-22R型高速冷凍離心機(Andreas Hettich GmbH8 CO.KG,德國);GHP-9080隔水式恒溫培養箱(上海一恒科學儀器有限公司);TECAN多功能酶標儀(TECAN,瑞士普朗);LX-200迷你離心機(海門市其貝爾儀器);FE20試驗室pH計(梅特勒-托利多儀器上海有限公司)等。
AceQ q-PCR SYBR Green Master Mix試劑盒購于Vazyme Biotech公司;反轉錄試劑盒購于Promega公司;綿羊脂多糖(LPS)酶聯免疫分析(ELISA)試劑盒購自于上海酶聯有限公司; 4%多聚甲醛、梯度酒精、二甲苯、石蠟和蘇木素-伊紅染液均購自南京鼎國昌盛生物技術有限公司等。
1.2 動物分組與飼養管理
成年雄性健康湖羊12只, 體重(41.09±1.54) kg,5~6月齡,飼養于南京農業大學動物科學院動物房,每日定時飼喂2次(08:00和17:00),單欄飼養,自由飲水和采食。預飼期飼喂苜蓿干草+精料。之后按照體重相近原則,將湖羊隨機分為苜蓿干草組(精料+苜蓿干草)和麥秸組(精料+稻秸),正式飼喂期28 d,日糧精粗比均為60∶40,其組成及營養水平見表1。
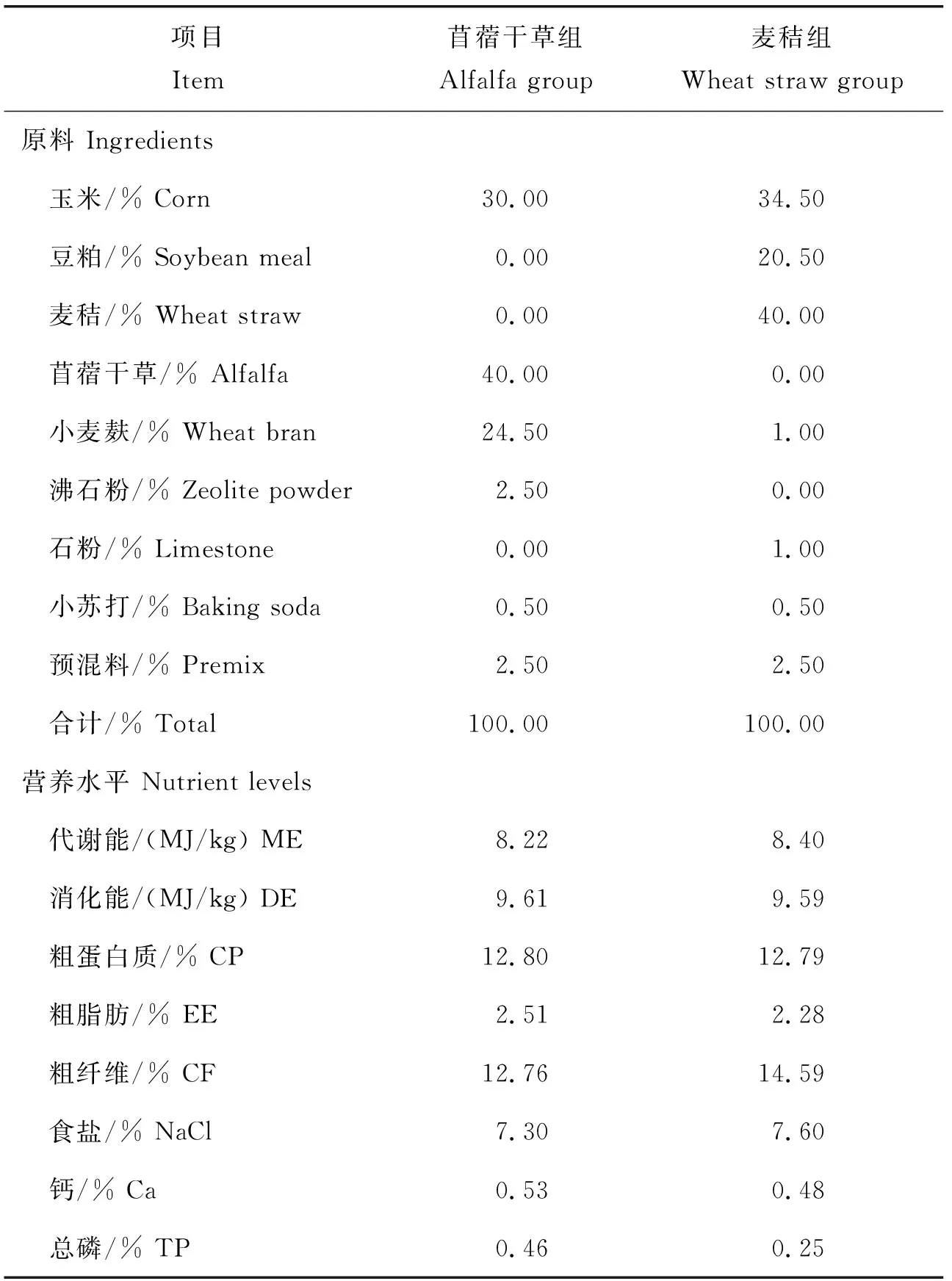
表1 日糧組成及營養水平(風干基礎)Table 1 Feed composition and nutrition level (dry basis)
1.3 樣品采集
1.3.1血液樣品的采集
于正式飼喂期28 d后選取禁食16 h的湖羊進行頸靜脈采血,3 000 r/min離心15 min獲得血漿,-20 ℃ 保存。
1.3.2消化道內容物和組織樣品的采集
屠宰前稱取湖羊宰前活重(Live weight before slaughter,LWBS),進行放血屠宰,按如下要求采集各種樣品。
1)臟器稱重及臟器指數計算
取肝臟、胰腺、脾臟、胸腺等組織臟器稱重,按如下公式計算臟器指數。
臟器指數=臟器濕重/屠宰前體重×100%
2)消化道樣品采集
取消化道內容物于5 mL EP管中,置于液氮中保存,-20 ℃保存。
取剪碎的各腸段組織于2 mL EP管中,置于液氮中保存,后放-80 ℃冰箱保存。部分組織4%多聚甲醛固定。
1.3.3消化道內容物 pH及重量的測定
試驗結束屠宰時,對消化道內容物用手持式pH計測定其中pH并記錄。
稱取消化道器官鮮重;消化道內容物清除并清洗干凈,分別稱取瘤胃、網胃、瓣胃、皺胃以及小腸的重量。
消化道內容物重量/kg=消化道鮮重/kg-
消化道空重/kg
消化道內容物重量占宰前活重比例/%=
消化道內容物重量/g/宰前活重/g
1.4 湖羊血漿、瘤胃內容物中LPS含量的測定
1.4.1瘤胃內容物樣品處理
取瘤胃內容物用4層紗布過濾,吸取過濾后的瘤胃液2 mL,10 000 r/min,4 ℃離心30 min,保留上清。
1.4.2LPS含量測定
血漿和瘤胃內容物中LPS含量測定采用ELISA方法。具體操作參照測定試劑盒說明書測定,在Synergy2多功能酶標分析儀上以空白孔調零,450 nm波長下依序測定各孔的吸光度(OD值)。
1.5 湖羊瘤胃中果膠酶、木聚糖酶、纖維素酶、液相羧甲基纖維素酶的活性測定
1.5.1酶液的制備
取固相食糜解凍后稱取1 g食糜后加入7.5 mL濃度為0.1 mol/L的pH 6.8磷酸鈉緩沖液(內含溶菌酶0.02 g/L)放入50 mL離心管中,然后加入0.625 mL四氯化碳,39 ℃恒溫水浴振蕩3 h,14 000 r/min 離心30 min,上清液即為酶液,-20 ℃ 冷凍待測。
1.5.2酶活力的測定
參照梁松等[14]的方法,用分光光度計于530 nm比色依序測定各管的吸光度(OD值)。
1.6 瘤胃內容物中揮發性脂肪的測定
根據Jin等[15]描述的方法測量瘤胃中各種揮發性脂肪酸的濃度。用日本島津GC-7A氣相色譜儀依內標法進行分析測定。以巴豆酸為內標物。
1.7 各組織器官組織學切片制作
取4%多聚甲醛固定的湖羊十二指腸、空腸、盲腸組織。常規HE染色法制作組織學切片。按固定、脫水、透明、浸蠟、包埋、切片、染色、封片等操作步驟制作組織學切片。中性樹膠封片,顯微鏡下觀察。
1.8 數據處理
數據均采用SPSS 19.0統計分析,采用獨立樣本T檢驗進行顯著性檢驗,所有數值均以“平均值±標準差(Mean±SD)”表示,以P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結果與分析
2.1 飼喂麥秸對湖羊消化道內容物pH的影響
由表2可看出,與苜蓿干草組相比,麥秸組瘤胃內容物pH顯著降低(P<0.05),其他消化道內容物pH均無顯著差異(P>0.05)。
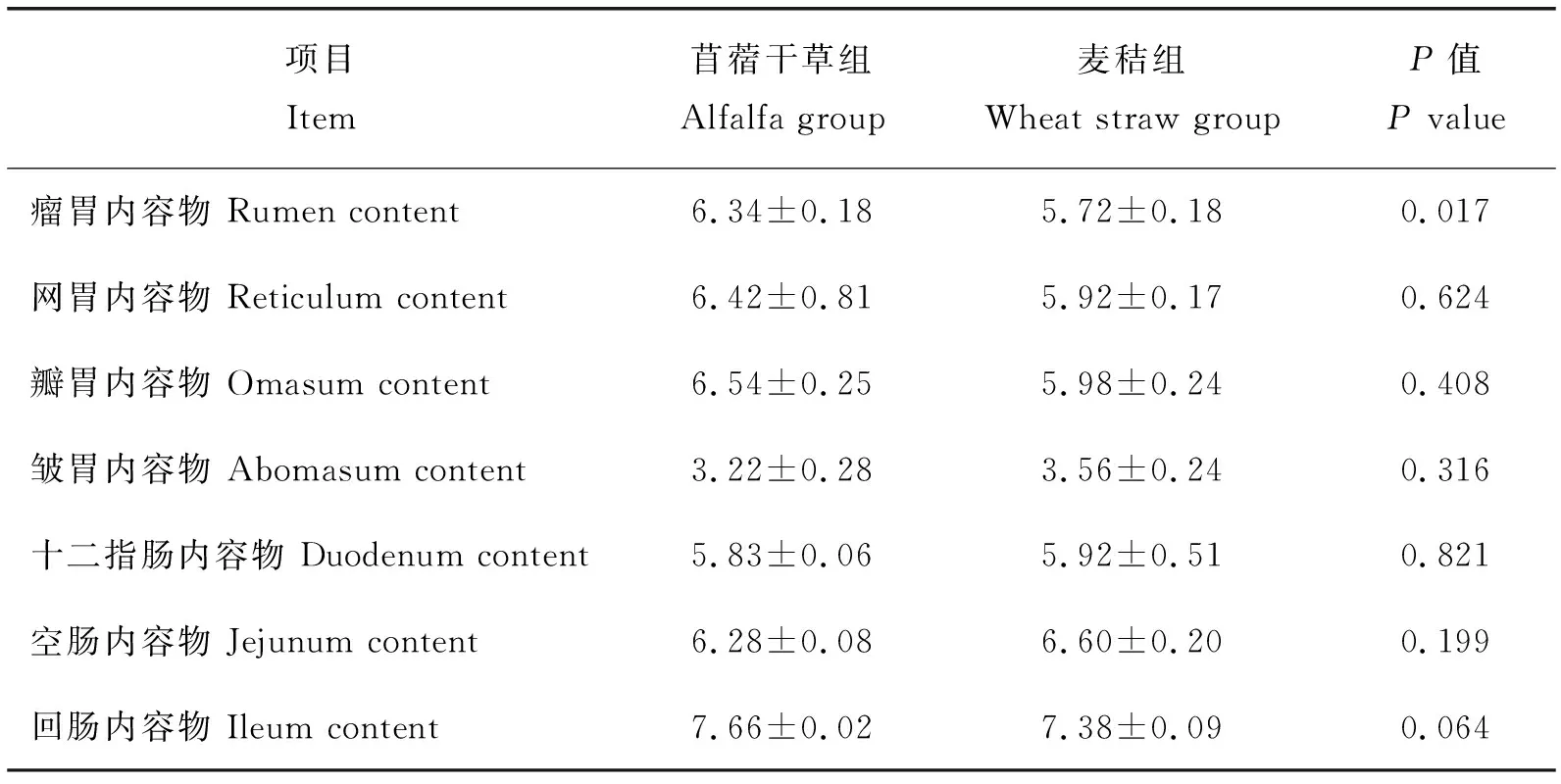
表2 飼喂麥秸對湖羊消化道內容物pH的影響(n=6)Table 2 The effect of feeding wheat straw on the pH value of the digestive tract of Hu sheep (n=6)
2.2 飼喂麥秸對湖羊消化道內容物重量的影響
由表3看出,麥秸組湖羊胃內容物重及占宰前活重比例均高于苜蓿干草組,其中瘤胃內容物重及占宰前活重比例極顯著高于麥秸組(P<0.01),瓣胃內容物重量顯著高于麥秸組(P<0.05)。腸道內容物重及占宰前活重比例兩組之間無顯著差異(P>0.05)。
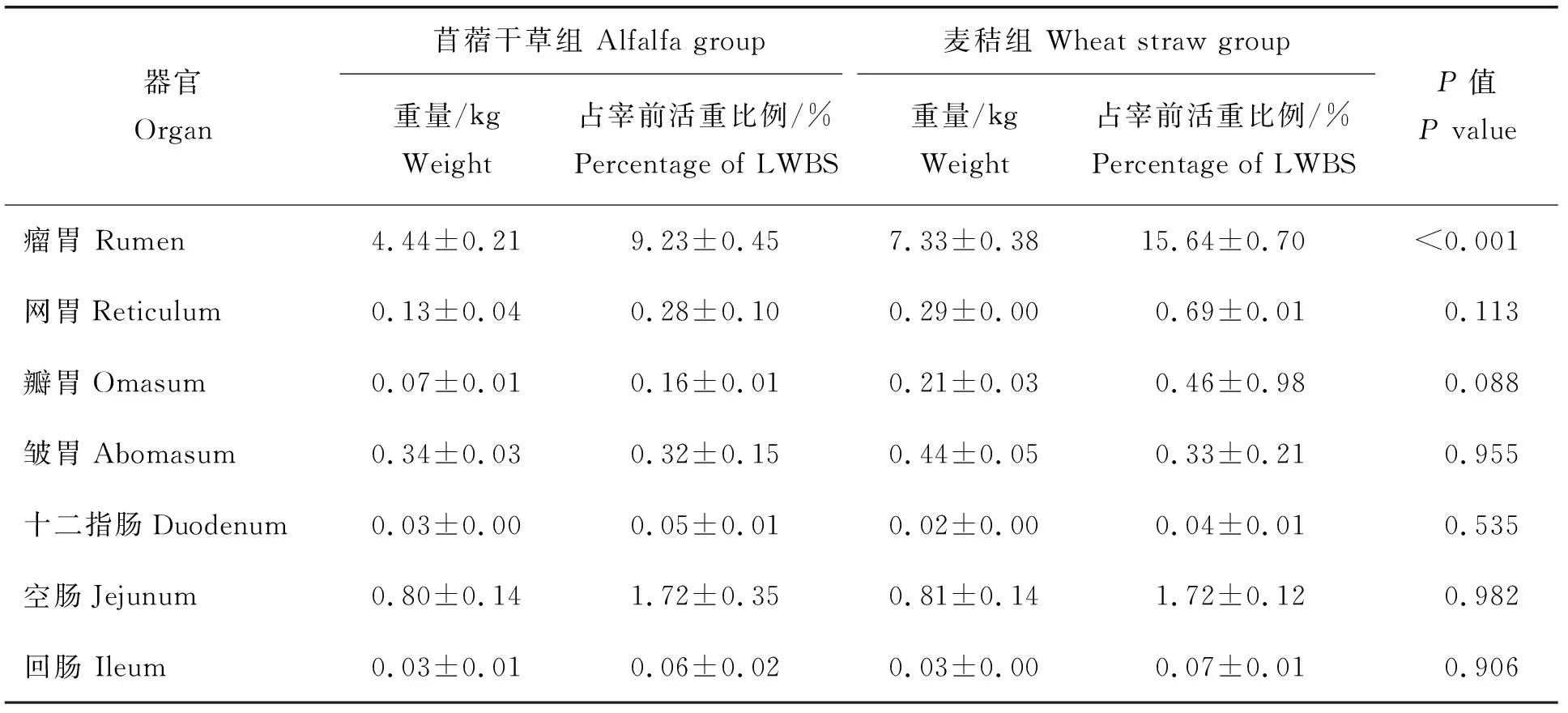
表3 飼喂麥秸對湖羊消化道內容物重量的影響(n=6)Table 3 The effect of feeding wheat straw on the weight of contents of the digestive tract of Hu sheep (n=6)
2.3 飼喂麥秸對湖羊血漿、瘤胃內容物中LPS含量的影響
結果如表4所示,與苜蓿干草組相比,麥秸組湖羊血漿及瘤胃內容物中LPS的含量均無顯著差異(P>0.05)。
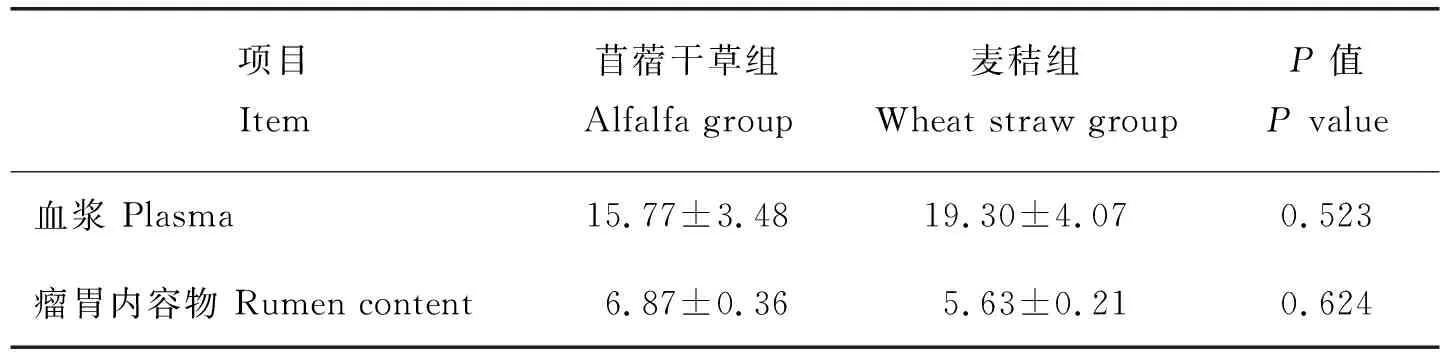
表4 飼喂麥秸對湖羊血清及瘤胃液中LPS含量的影響(n=6)Table 4 Effect of feeding wheat straw on the content of LPS inplasma and rumen content of Hu sheep (n=6)
2.4 飼喂麥秸對湖羊瘤胃內容物中酶活力的影響
瘤胃內容物中各種酶活力測定結果見表5。由表5可知,與苜蓿干草組相比,麥秸組湖羊瘤胃內容物中酶活力均有所升高,其中木聚糖酶活力極顯著升高(P<0.01)。

表5 飼喂麥秸對湖羊瘤胃內容物中酶活力的影響(n=6)Table 5 Effect of feeding wheat straw on enzyme activity in rumen content of Hu sheep (n=6)
2.5 飼喂麥秸對湖羊瘤胃內容物中揮發性脂肪酸含量的影響
結果見表6,與飼喂苜蓿干草相比,麥秸組湖羊瘤胃液中乙酸、丙酸及總揮發性脂肪酸的含量較高,而丁酸、異丁酸、戊酸及異戊酸含量降低,但均無顯著差異(P>0.05)。
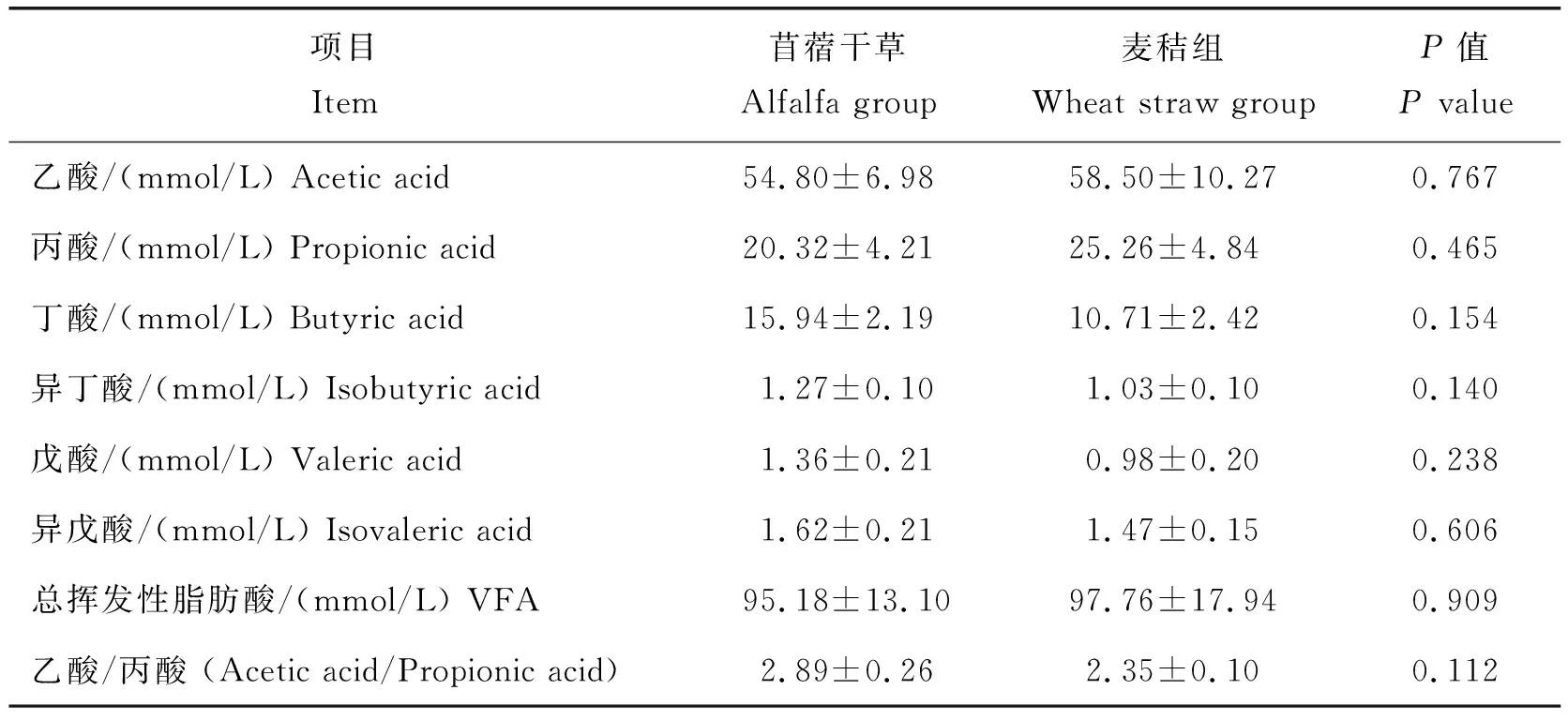
表6 飼喂麥秸對湖羊瘤胃內容物中揮發性脂肪酸的影響(n=6)Table 6 Effect of feeding wheat straw on volatile fatty acid content in rumen of Hu sheep (n=6)
2.6 臟器指數統計
各臟器統計結果見表7,與苜蓿干草組相比,麥秸組湖羊胸腺指數、肝臟指數及胰腺指數較低,但2組無顯著差異(P>0.05)。
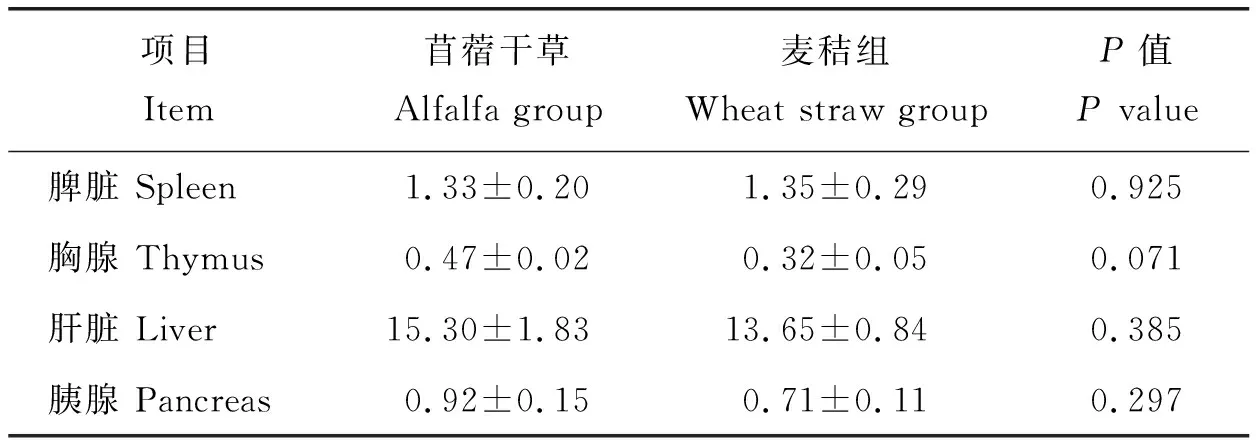
表7 飼喂麥秸對湖羊臟器指數的影響(n=6)Table 7 Effect of feeding wheat straw on the organ index of Hu sheep (n=6)
2.7 飼喂麥秸對湖羊十二指腸、空腸及盲腸組織形態的影響
2.7.1飼喂麥秸對湖羊十二指腸組織形態的影響
對湖羊十二指腸進行組織形態學觀察,結果如圖1所示,兩組湖羊十二指腸組織切片在低倍鏡下(圖1(a)和(b))可以觀察到清晰明顯的粘膜層、粘膜下層、肌層。高倍鏡下(圖1(c)和(d))可見完整的十二指腸腺,未見其他異常。
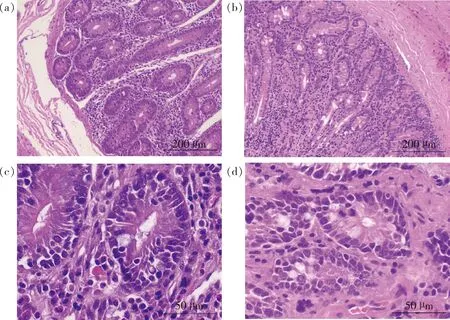
(a)苜蓿干草組(100×);(b)麥秸組(100×);(c)苜蓿干草組(400×);(d)麥秸組(400×)(a) Alfalfa group (100×); (b) Wheat straw group (100×); (c) Alfalfa group (400×); (d) Wheat straw group (400×)圖1 飼喂麥秸對湖羊十二指腸組織形態的影響Fig.1 Effect of feeding wheat straw on duodenal tissue morphology of Hu sheep
2.7.2飼喂麥秸對湖羊空腸組織形態的影響
對湖羊空腸進行組織形態學觀察,結果如圖2所示,兩組湖羊空腸組織切片在低倍鏡下(圖2(a)和(b))可以觀察到清晰明顯的粘膜層、粘膜下層、肌層。高倍鏡下(圖2(c)和(d))可見完整的腸腺,未見其他異常。
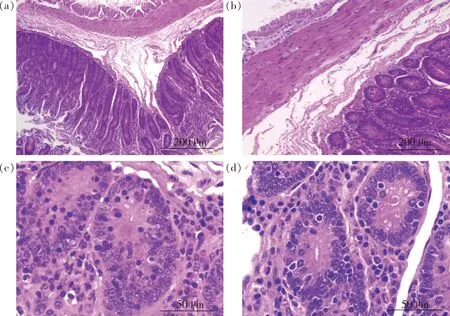
(a)苜蓿干草組(100×);(b)麥秸組(100×);(c)苜蓿干草組(400×);(d)麥秸組(400×)(a) Alfalfa group (100 ×); (b) Wheat straw group (100×); (c) Alfalfa group (400×); (d) Wheat straw group (400×)圖2 飼喂麥秸對湖羊空腸組織形態的影響Fig.2 Effect of feeding wheat straw on jejunum tissue morphology of Hu sheep
2.7.3飼喂麥秸對湖羊盲腸組織形態的影響
對湖羊盲腸進行組織形態學觀察,如圖3所示,兩組湖羊盲腸組織切片在低倍鏡下(圖3(a)和(b))可以觀察到清晰明顯的粘膜層、粘膜下層、肌層。高倍鏡下(圖3(c)和(d))可見完整的腸腺,未見其他異常。
3 討 論
3.1 飼喂麥秸對湖羊瘤胃pH及代謝異常產物LPS的影響
粗飼料在反芻動物日糧中起著至關重要的作用,能刺激反芻動物咀嚼和唾液分泌,飼料中的營養物質被反芻動物攝食后進入瘤胃中消化分解后生成VFA及其他有機酸,從而使得瘤胃液pH升高或降低,所以pH是反映飼料中可發酵成分在瘤胃內發酵程度和評價瘤胃內環境是否正常的敏感指標。一般情況下,變動范圍為5.5~7.5[16]。纖維分解菌對于pH變化比較敏感,當pH降低時,粗飼料的消化率下降。楊艷玲[17]發現飼喂不同精粗比的麥秸型粗飼料時,當纖維化學含量達到要求,瘤胃pH大小與中性洗滌纖維含量不相關,影響瘤胃pH的關鍵因素是日糧中易發酵的碳水化合物和瘤胃內的發酵產物;Zhu等[18]發現體外發酵精粗比為45∶55的不同來源的粗飼料研究中,苜蓿組和玉米秸稈組的pH差異不顯著。本研究結果中兩組湖羊的瘤胃pH均在正常范圍內,原因可能與試驗中的瘤胃發酵產物的累積程度不足以影響瘤胃的緩沖能力有關。
目前已知瘤胃液中 pH 降低可能導致部分不耐酸的革蘭氏陰性菌死亡和裂解,從而使瘤胃中游離LPS增加。Adesogan等[19]發現瘤胃內約 60%的 LPS 是由于革蘭氏陰性菌的快速生長而產生的,在細菌快速生長期,自溶酶有利于細菌的生長和繁殖,但是過量的自溶酶能使細菌自體溶解,從而釋放出大量LPS。故瘤胃內LPS的增加也可能是細菌的快速生長造成的。Nagaraja等[20]將母牛的瘤胃液分別與玉米和苜蓿干草進行體外培養,發現玉米培養液中 pH 比苜蓿干草培養液中 pH 的下降幅度大,相應的其內毒素含量也高。Gagnon等[21]給肉牛飼喂不同粗精比的日糧時,發現瘤胃內細菌內毒素LPS隨著飼喂精料比例的增加而不斷增加。本研究發現,與苜蓿干草組相比,麥秸組湖羊瘤胃和血液中LPS濃度差異不顯著,表明苜蓿干草和麥秸對湖羊瘤胃沒有產生不良影響。
3.2 飼喂麥秸對湖羊消化道內容物重量及腸道組織形態的影響
飼料中含有一定量中性洗滌纖維(NDF)對維持瘤胃功能具有重要作用,但是,中性洗滌纖維含量過高會影響消化道的排空速率,從而影響反芻動物的采食量[22],本研究結果顯示麥秸組湖羊瘤胃內容物重量顯著升高,說明麥秸組湖羊胃排空速率變慢,這與麥秸中中性洗滌纖維含量高于苜蓿干草相符合,與前人研究結果一致。
小腸的正常組織結構是動物機體對營養物質消化和吸收的重要保證,小腸的收縮運動與食糜的消化效率小腸粘膜、肌層厚度有直接關系,一旦出現腸粘膜發生萎縮現象就會影響到小腸的吸收功能[23]。通過觀察十二指腸、空腸和盲腸組織學切片,均未發現異常病理變化。臟器指數是試驗動物的重要生物學指標之一, 其大小在一定程度上能夠反映動物器官的功能強弱及受損情況。本研究結果顯示飼喂麥秸湖羊各臟器指數無差異,即對各臟器及組織結構均無影響。因此,以麥秸作為粗飼料飼喂,對湖羊腸道形態和臟器功能無顯著影響。
3.3 飼喂麥秸對湖羊瘤胃纖維素酶活性的影響
微生物對飼料消化的首要步驟是黏附在飼料顆粒上,而不同的飼料由于其物理結構和化學成分不同,影響瘤胃微生物對它的黏附[24]。反芻動物可以依靠瘤胃微生物分泌的纖維素酶來分解利用纖維物質[25]。其中,所有纖維素分解均能產生羧甲基纖維素酶,纖維素的降解首先通過此酶將大的不可溶多聚糖分解成可溶性的小單位,因此羧甲基纖維素酶是纖維素降解中的一個限速步驟。羧甲基纖維素酶主要是由纖維降解菌分泌的,從飼喂不同粗飼料中羧甲基纖維素酶酶活的角度來看,其變化趨勢與NDF降解率的變化趨勢一致。由此可以認為,纖維素利用菌數量及其分泌的纖維素酶酶活的變化是與粗飼料中NDF含量有關。本研究中,經過28 d試驗期發現,麥秸組纖維素酶活性均高于苜蓿干草組,麥秸干草屬于秸稈飼料,而苜蓿屬于青干草,秸稈類飼料的纖維素酶活性大于青干草類,可能是秸稈類飼料的纖維含量較高,所以更好地刺激了瘤胃中降解纖維的微生物的生長定殖,這與霍鮮鮮等[26]研究結果一致。近幾年通過分子生物學方法研究表明,當日糧中粗料比例增加時,3種主要的纖維降解細菌的濃度隨之增加[27-28],但對于瘤胃厭氧真菌來說,當日糧中粗料比例增加時,真菌數量隨之增加,但采食莖桿含量很低的飼草時,不利于真菌的生長。因此,不同的飼料品種所含的纖維物質的數量和種類也影響微生物對其黏附。
3.4 飼喂麥秸對湖羊瘤胃揮發性脂肪酸含量的影響
反芻動物通過瘤胃降解飼料中的碳水化合物,生成大量的揮發性脂肪酸(VFA),VFA是反芻動物能量需要的主要來源,乙酸是反芻動物瘤胃內重要的揮發性脂肪酸,其中會有很少的乙酸經瘤胃壁吸收轉化成酮體,其余大部分乙酸吸收進入血液經三羧酸循環作用合成脂肪酸,丁酸在經瘤胃壁吸收的過程中,大部分轉變為β-羥丁酸,β-羥丁酸是機體內多種體組織尤其是肌肉組織的重要能量來源[29]。丙酸通過糖異生生成葡萄糖,為葡萄糖的合成提供80%~90%的原料。生成的葡萄糖在動物體內直接被氧化酵解產能,為動物提供能量[30]。瘤胃pH、微生物及其活性、瘤胃吸收速率等因素對反芻動物瘤胃揮發性脂肪酸的濃度產生重要影響。Schoonmaker等[31]研究發現,不同來源的粗飼料經瘤胃發酵所產生的VFA濃度不同。Zhao等[32]研究發現,與飼喂玉米秸稈相比,飼喂苜蓿干草導致反芻動物瘤胃液中戊酸濃度水平顯著升高,但對其他揮發性脂肪酸濃度無顯著影響。這與本研究結果基本一致,本研究中,與飼喂苜蓿干草相比,飼喂麥秸對瘤胃中各種揮發性脂肪酸的濃度和乙酸/丙酸均沒有顯著影響,表明麥秸沒有改變湖羊瘤胃發酵模式,仍是以乙酸發酵為主。在正常情況中低精料日糧水平的VFA的乙酸/丙酸偏高,高精料日糧水平的乙酸/丙酸偏低[33]。本研究中,飼喂麥秸對湖羊瘤胃乙酸/丙酸沒有顯著影響,表明麥秸沒有影響瘤胃微生物群中有益菌菌群的繁殖和生長,即不改變微生物合成能力或對瘤胃中的碳水化合物的降解程度。
4 結 論
飼喂麥秸可提高湖羊瘤胃木聚糖酶活力,對瘤胃發酵代謝及腸道組織形態均無有害影響,所以在苜蓿干草不足的情況下,可將麥秸作為粗飼料飼喂反芻動物,本研究為麥秸在反芻動物上的合理利用提供了基礎數據。

