不同抗凍保護劑對雞精液冷凍效果及基因表達的影響
李博宇 郭 勇 倪和民 盛熙暉 陳 余 王 梁 王相國 肖龍菲 邢 凱* 齊曉龍
(1.北京農學院 動物科學技術學院,北京 102206; 2.北京市畜牧總站,北京 100107)
冷凍精子通常用于人工授精(AI)、體外受精(IVF)和卵胞漿內單精子注射(ICSI)。在農業、水產養殖、瀕危物種保護等方面具有廣闊的應用前景[1]。在近幾十年中,冷凍精液已經進行了廣泛應用,抗凍保護劑是影響精液冷凍保存效果的重要條件之一,主要包括提供精子存活所需要能源物質,維持適宜滲透壓和pH的精液稀釋液以及防止或減少冷凍過程中精子冰晶形成的抗凍劑。DMA和DMSO是目前公認的效果最好的2種抗凍劑。現在大多數抗凍保護劑研究主要集中于稀釋液配方的優化或者抗凍劑的選擇上,李潔等[2]通過在抗凍保護劑中添加不同抗氧化劑,發現一定濃度的褪黑素對雞精液保存具有顯著作用,同樣添加不同濃度的紅景天多糖、枸杞多糖等能顯著提高雞精子的凍后活率[3]。然而不同抗凍保護劑對雞精液抗凍效果及抗凍機制的相關研究較少。而且由于家禽精子獨特的生理學特征及個體差異性,到目前為止,尚未發現一種特別有效的雞精液抗凍保護劑[4]。
基因表達譜芯片已被應用到動物精子基因表達水平檢測。Singh等[5]采用表達譜芯片鑒定出了幾千個雞精液中高表達的基因。而針對冷凍前后的精液,Chen等[6]比較了荷斯坦牛鮮精和凍融精的基因表達水平,并鑒定出15個差異表達的基因(Differentially expressed genes,DEG)。這些研究表明表達譜芯片是鑒定精子基因表達的一種研究方法。
因此本研究以海蘭褐種公雞為研究對象,通過分析不同抗凍保護劑處理組的精子活性,旨在篩選冷凍效果更好的抗凍保護劑。并通過采用Affymetrix公司全基因表達譜芯片對兩組雞精液進行全基因組基因表達檢測,并篩選出兩組間的差異表達基因,為闡明不同抗凍保護劑的抗凍機制提供參考。
1 材料與方法
1.1 材料
1.1.1樣品采集
試驗用的海蘭褐種公雞飼養在北京農學院動物房至6月齡。飼養條件為自然光周期,自然溫度,自由飲食和飲水。采用腹部按摩法對18只健康的種公雞進行精液采集。采集得到的每只種公雞的精液平均分成兩組,分別添加兩種稀釋保護液,然后用于制作凍精,2種稀釋液分別用DMA和DMSO做抗凍保護劑。
1.1.2主要試劑
Trizol購自Invitrogen公司;反轉錄試劑盒購自Promega公司;其余試劑未作特殊說明均購自Sigma公司。
1.1.3抗凍保護劑配方
抗凍保護劑Ⅰ:谷氨酸鈉0.867 g,D-果糖0.5 g,磷酸二氫鉀0.065 g,磷酸氫鉀1.27 g,乙酸鈉0.26 g,六水氯化鎂0.03 4 g,檸檬酸鉀0.064 g,用水補至100 mL,pH=7.4,終質量濃度含6%DMA。
抗凍保護劑Ⅱ:谷氨酸鈉1.4 g,葡萄糖0.7 g,D-果糖0.2 g,一水合檸檬酸鈉0.14 g,聚乙烯吡咯烷酮0.1 g,硫酸魚精蛋白0.02 g,無水磷酸氫鈉0.98 g,無水磷酸二氫鈉0.21 g,用水補至100 mL,pH=7.4,終質量濃度含10%DMSO。
1.2 方法
1.2.1精液的程序化冷凍及解凍
將采集得到的鮮精分別與抗凍保護劑Ⅰ和抗凍保護劑Ⅱ按1∶1稀釋處理,5 ℃平衡30 min,用2種保護劑再次稀釋,使終稀釋比例為1∶3,5 ℃平衡30 min后,通過程序化冷凍儀(CL-8800i型,上海京燦精密機械有限公司上海),制備雞細管凍精。冷凍程序為從5 ℃至-35 ℃,速率為7 ℃/min,-35 ℃至-120 ℃,速率為9 ℃/min,最后投入液氮保存,冷凍7 d后進行后續研究。精液解凍時將冷凍保存的精液在37 ℃水浴解凍40 s。
1.2.2精液活力和活率的檢測
精液的活力通過偉力精子分析儀進行精液活力的檢測(WLJY-9000型,偉力彩色精子質量檢測系統,北京偉力新世紀科技發展有限公司,北京)。每個樣品重復測量3次,取均值代表樣品精子活力。活率的檢測利用伊紅-苯胺黑染色方法。精子冷凍-解凍后置于1.5 mL離心管中,滴加1~2滴伊紅染色液,混勻,放置30 min。滴加苯胺黑染色液3滴,混勻,放置30~60 s制成精液-伊紅-苯胺黑染色液。滴加精子-伊紅-苯胺黑染色液1滴于載玻片,制成涂片,晾干后在40倍油鏡下進行統計,對載玻片的兩端及中間部位分別計數,每次計數200個精子,共600個精子,求出平均數。未著色的精子為活精子。
1.2.3總RNA的提取、質量檢測和純化
將2組凍精解凍后的各18支精液隨機分為3組,等量混勻,然后采用密度梯度離心法進行純化。純化后的精液去除緩沖液,并至于冰上30 min使用體細胞裂解液處理。
按照Trizol試劑盒的說明書,采用Trizol法提取精液中的總RNA。RNA的純度使用OD260/OD280值、OD260/OD230值和1%的凝膠電泳評估。使用分光光度計檢測總RNA的濃度。使用脫氧核糖核酸酶Ⅰ去除總RNA中的DNA。測得RNA的OD260/OD280值在1.8~2.0,OD260/OD230值在2.0~2.2。滿足Affymetrix公司全基因表達譜芯片使用標準的RNA進入下一步試驗。
1.2.4芯片雜交
采用Affymetrix公司雞全基因表達譜芯片(購自北京博奧晶典生物技術有限公司),共包含38 535個探針。純化后的總RNA經反轉錄合成first strand cDNA和second strand DNA后,形成雙鏈DNA。以second strand cDNA為模板,利用T7 Enzyme Mix合成cRNA,摻入生物素Biotin。使用磁珠純化cRNA,除去鹽、酶等雜質,并對cRNA進行定量。將cRNA片段化成適宜雜交的大小以備雜交使用。根據Affymetrix公司相應試劑盒,將cRNA與芯片進行雜交。并進一步對芯片進行清洗、染色和掃描。使用AGCC軟件將芯片的熒光掃描圖像保存分析。
1.2.5qPCR結果驗證
為了驗證表達譜芯片數據的準確性,選擇了5個 DEG進行qPCR檢測。采用AriaMx G8830A qPCR系統(美國安捷倫科技公司)并按照制造商的說明,使用TransStart?Top Green qPCR SuperMix(TransGen Biotech,北京)進行qPCR驗證。采用Primer Premier 5.0軟件設計引物,引物序列見表1。引物由上海生工生物工程技術服務有限公司合成。使用甘油醛-3-磷酸脫氫酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)基因作為內參,使用2-ΔΔCt方法計算基因的相對表達水平。
1.2.6數據分析
使用Expression Console軟件(Affymetrix)將文件的圖像信號轉化為數字信號,即每個探針的熒光信號強度。使用RMA算法將數據進行背景校正和歸一化。使用SAM R程序包分析DEG,DEG的篩選標準為:q-value≤0.05且Fold change≥2或≤0.5。使用Molecule Annotation System對DEG進行基因功能(Gene ontology, GO)和KEGG通路富集分析,顯著的閾值為P≤0.05。驗證結果使用SPSS版本10.0(IBM Corporation,NY) t-test進行對不同組之間的精子活力進行差異顯著性分析。P<0.05表示在兩組之間差異顯著。
2 結果與分析
2.1 不同抗凍保護劑凍后精子活力檢測
由表2 得知,保護劑Ⅰ組的精子活力27.05±1.22高于保護劑Ⅱ組20.65±1.50,且差異顯著(P<0.05),而且,保護劑Ⅰ組的精子凍后活率47.65±5.89明顯高于保護劑Ⅱ組35.15±5.15。表明保護劑Ⅰ的冷凍效果明顯高于保護劑Ⅱ,更適合海蘭褐種公雞精液冷凍保存。
2.2 不同抗凍保護劑冷凍解凍后精液差異表達基因分析
為了研究不同抗凍保護劑對雞精液冷凍-解凍后基因表達的情況,本研究采用雞全基因組表達譜芯片鑒定保護劑Ⅰ和保護劑Ⅱ中精子的基因表達情況(每組3個重復)。經掃描分析信號后,38 535個探針被檢測到在雞精液中表達,其中的73.73%注釋到雞的基因上。對雞精液基因表達進行主成分分析(PCA)發現,保護劑Ⅰ和保護劑Ⅱ的樣本被明顯的區分開(圖1)。通過解凍后兩組間的比較,發現了1 604個基因在兩組中顯著差異表達(|log2(FC)|>1;q-value<0.05),與保護劑Ⅱ相比,在保護劑Ⅰ組中高表達1 380個基因,低表達224個基因(圖2)。
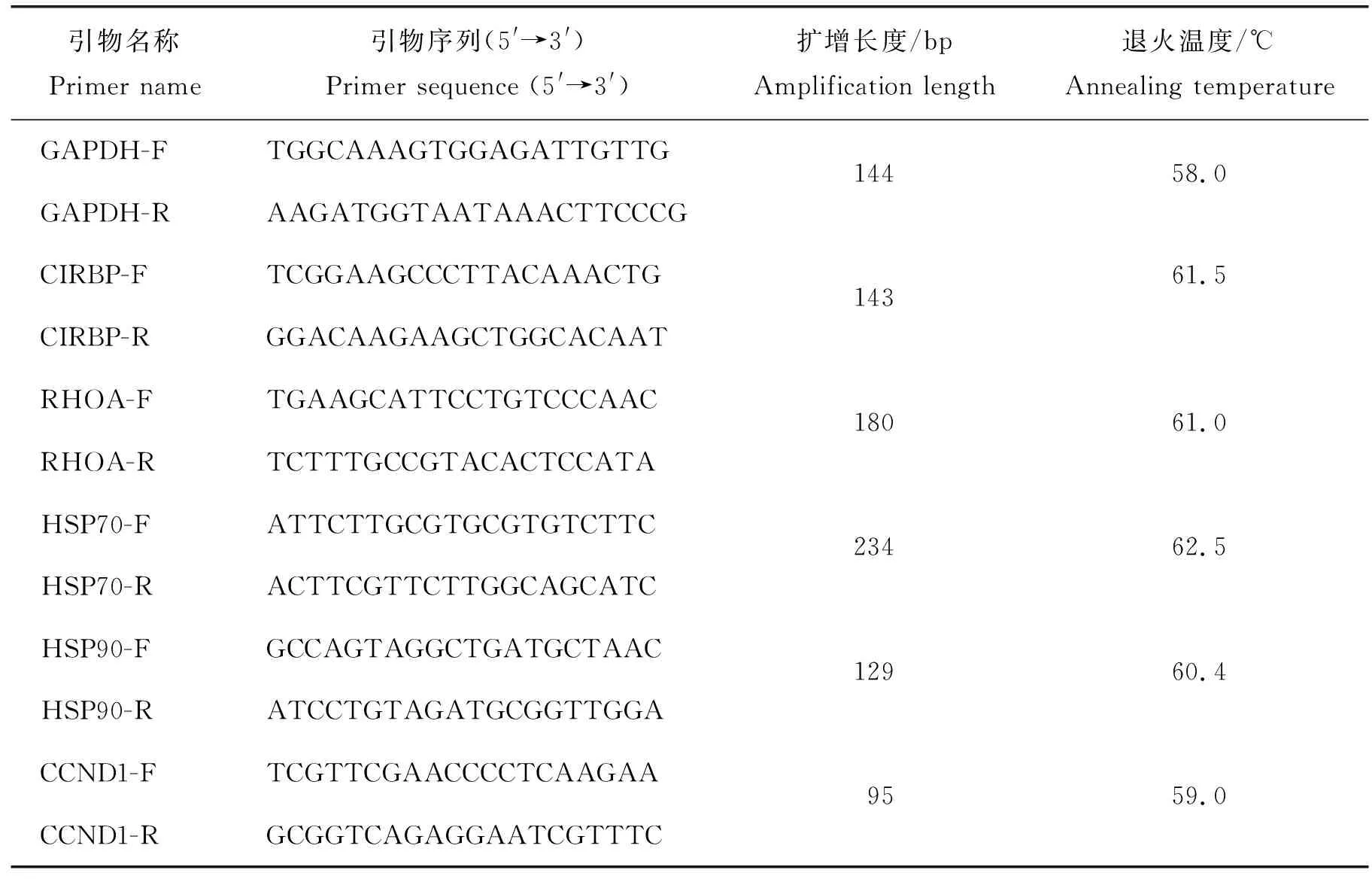
表1 本研究中的引物信息Table 1 Information of primers in the study

表2 不同抗凍保護劑組間精液凍后活力活率Table 2 Sperm viability after freezing in different cryoprotectants groups
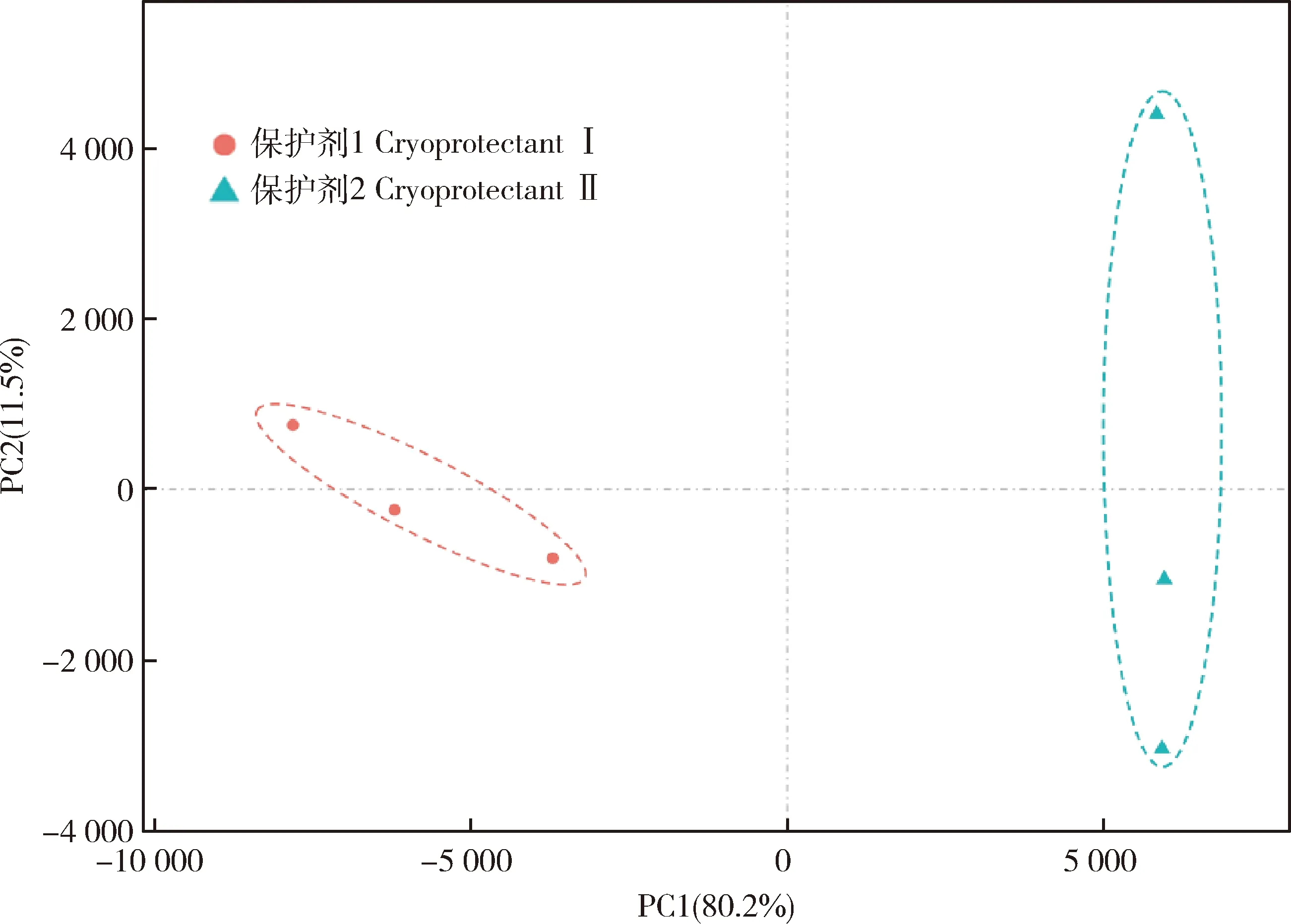
圖1 不同樣本間基因表達水平的PCA分析Fig.1 PCA analysis of gene expression levels among different samples
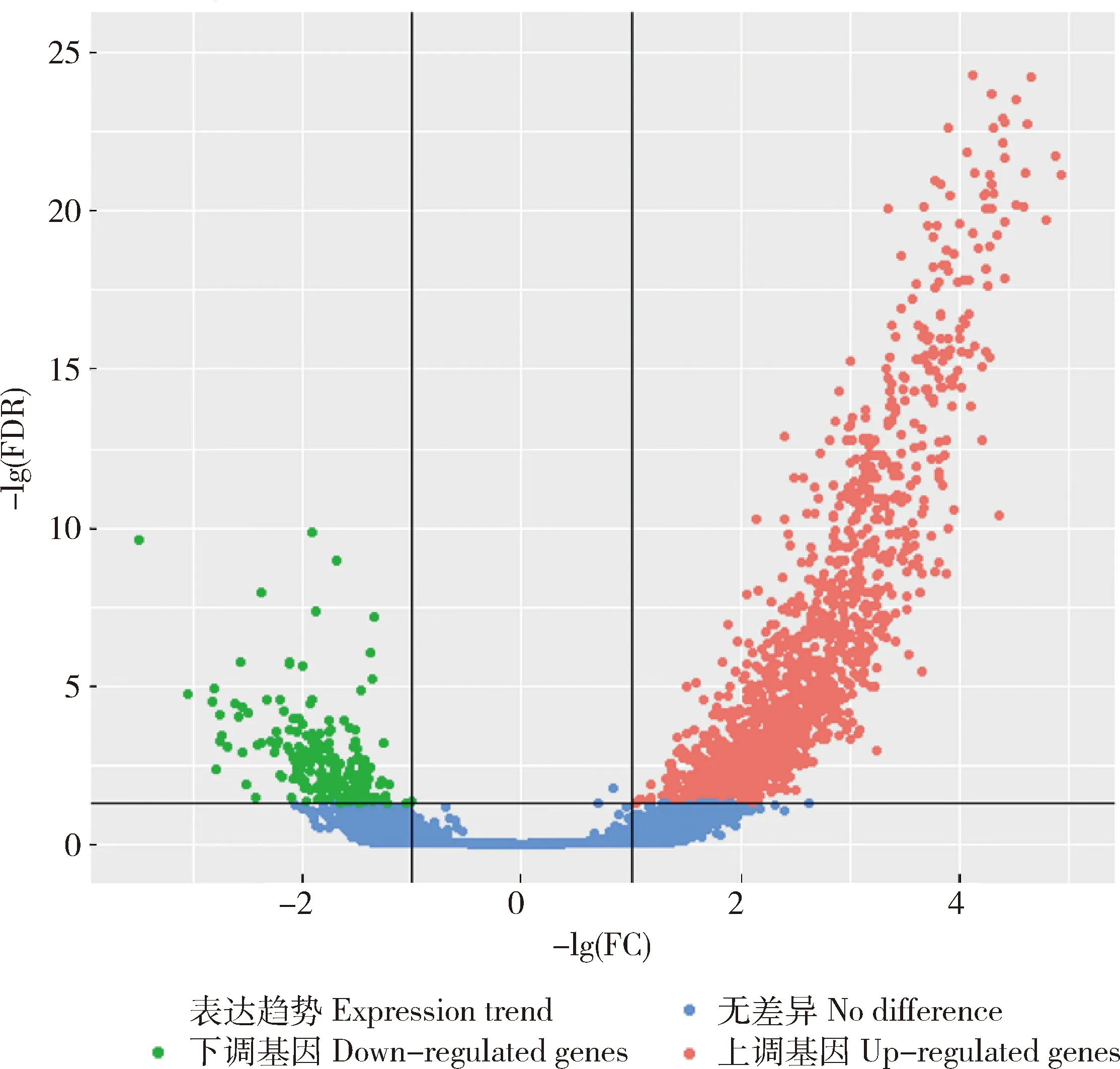
圖中橫坐標表示樣品間的差異倍數對數值,縱坐標表示2個樣品的-lg(FDR)值。紅色表示保護劑Ⅰ相對于保護劑Ⅱ表達量上調的基因,綠色表示表達量下調的基因,藍色表示沒有差異的基因。The abscissa represents the logarithm of the difference between the samples, and the ordinate represents the -lg (FDR) value of the two samples. Red indicates up-regulated genes in cryoprotectant Ⅰ compared with cryoprotectant Ⅱ, green indicates down-regulated genes, and blue indicates no difference.圖2 差異表達基因的火山圖Fig.2 Volcano map of differentially expressed genes
2.3 差異表達基因功能分析
為了解DEG涉及的生物學功能,使用超幾何檢驗的方法對DEG進行GO(Gene ontology)和KEGG (Kyoto encyclopedia of genes and genomes)通路的功能富集分析。富集GO條目的結果顯示,在生物學過程、細胞組分和分子功能3個方面共發現622個顯著富集的GO條目(q<0.05)。主要參與核糖體合成、線粒體組成及功能調節、蛋白質結合、微管蛋白活性、蛋白質靶向翻譯和mRNA分解代謝等過程(表2)。對DEG進行KEGG通路功能富集分析,共鑒定出18個顯著的通路,其中包括內質網應激通路、氧化磷酸化、蛋白質泛素化、核糖體調控以及線粒體呼吸調控等通路(圖3)。
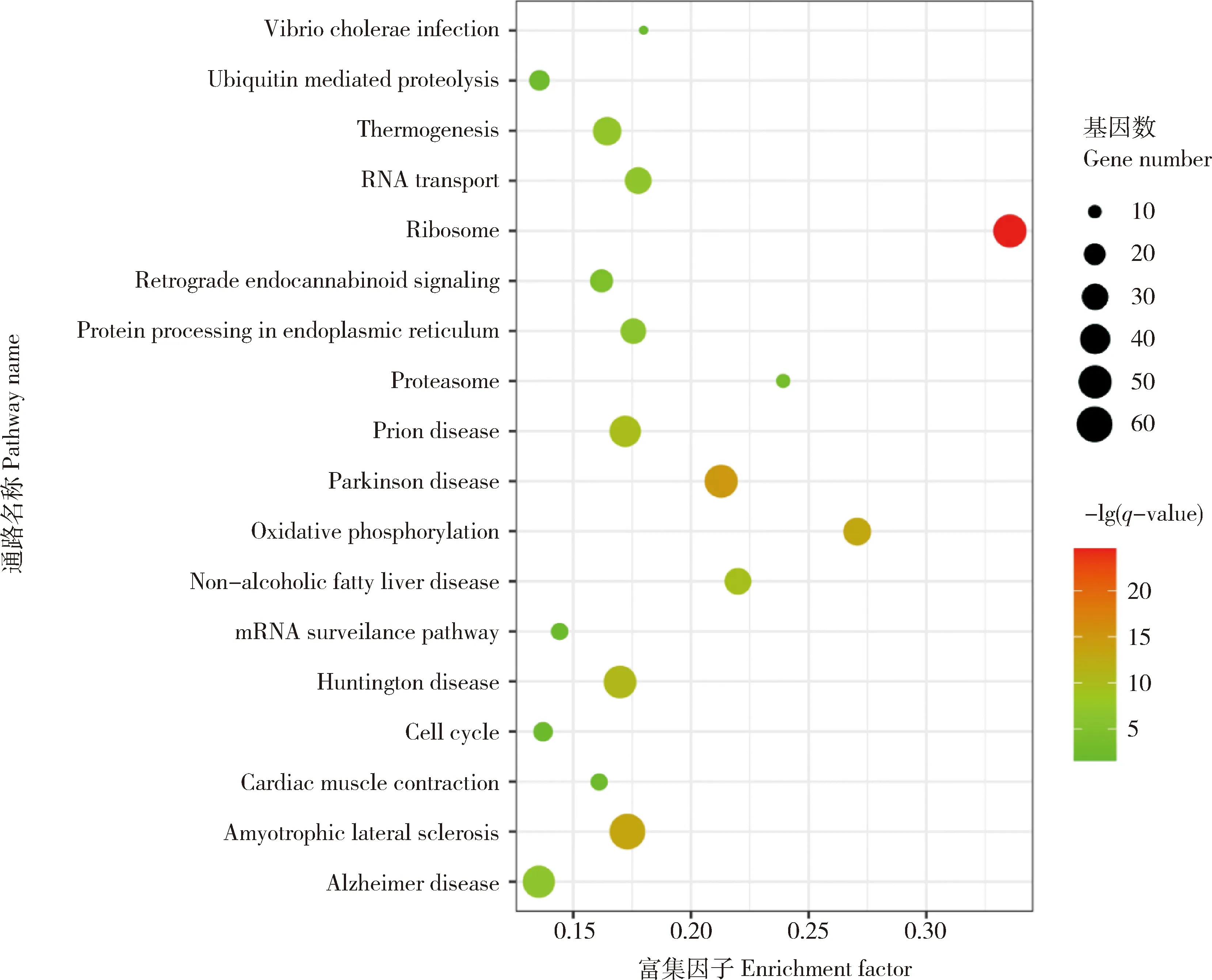
富集因子:參與通路的DEG數與該通路總基因數的比值。Enrichment factor: the ratio of the number of DEG involved in the pathway to the total number of genes in the pathway.圖3 DEG富集的顯著通路Fig.3 The pathways involved by differentially expressed genes
2.4 qPCR驗證差異表達基因
通過對芯片結果的相關分析,再結合相關文獻的研究進展,從差異表達基因中挑選了CIRBP、CCND1、RHOA、HSP90和HSP70這5個基因,并對其進行qPCR的驗證。由圖4可知,目的基因的qPCR檢測結果雖然與表達譜芯片的檢測結果數值上有些差異,但是整體趨勢是完全一致的。經過qPCR的驗證對比可知,表達譜芯片的檢測結果基本可靠,所篩選出來的差異表達基因基本符合其真實表達情況。
3 討 論
隨著養禽業的快速發展,雞人工授精技術得到廣泛應用。作為人工授精技術發展的重要環節,雞精液抗凍保護劑直接影響該技術的應用。該技術水平的高低直接影響優良種公雞的利用效率和養雞生產的經濟效益。用于精液冷凍保存的抗凍保護劑本質上有助于在冷凍過程中和冷凍后維持精子的結構和功能[7]。很少有研究比較抗凍保護劑間在雞精液冷凍過程中的效果。抗凍保護劑Ⅰ已廣泛應用到雞冷凍精液中,而抗凍保護劑Ⅱ在松雞外的其他家禽中很少報道。因此本研究比較了這2種抗凍保護劑凍后精液的差異基因的表達情況,篩選出更為合適的海蘭褐種公雞精液抗凍保護劑,并闡明其抗凍機制。
能量代謝直接影響精子的冷凍保存[8]。已經發現精子線粒體是冷凍保存過程中受損最嚴重的細胞器之一,很可能是由于凍融后運動力和生育力喪失,而通過上調線粒體呼吸鏈調節酶的活性,可以增強精子活力[9]。本研究通過對2種抗凍保護劑DEG進行KEGG通路功能富集分析,發現了一些與能量代謝相關的途徑,如線粒體呼吸調控,氧化磷酸化,內源性大麻素信號通路,與之相關的基因包括NADH脫氫酶(NADH dehydrogenase),泛醇-細胞色素c還原酶(Ubiquinol cytochrome C reductase),ATP合酶(ATP synthase),細胞色素b(Cytochrome b)和琥珀酸脫氫酶(Succinate dehydrogenase)等。這些基因的差異表達可能是導致了2種保護劑間精子活性差異的重要因素。本研究發現,凍融處理影響了雞精子線粒體呼吸鏈酶的表達,進而減少了ATP的生成,從而阻斷了精子運動的能量來源,其背后的具體調節機制值得進一步研究。

表3 差異表達基因最顯著富集的GO條目Table 3 GO entries with the most significant enrichment of differentially expressed gene
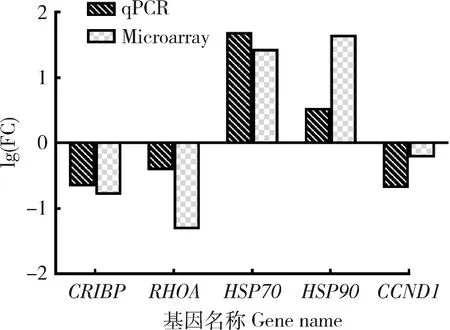
圖4 表達譜芯片與qPCR中各基因差異表達情況Fig.4 Different expression of each gene in expression profile chip and qPCR
精子發生是一個高度復雜而獨特的分化過程。細胞周期調節基因在精子發生中起重要作用。細胞周期蛋白及其依賴細胞周期蛋白激酶CDK是細胞周期的關鍵調節因子[10]。細胞周期蛋白D1(CCND1)在細胞周期G1/S轉換過程中發揮特定作用。對小鼠精原細胞的研究發現,PI3K-AKT和MAPK信號通路在CCND1的調控中發揮重要作用[11]。在本研究中,在細胞周期途徑中顯著富集了17個DEG,包括CCND1、CDK4、CDK6和CDKN1B等。結果表明,這些基因不僅參與細胞周期調控,而且選擇性的保留在成熟精子中,并且可能與精子的抗凍結能力有關。細胞周期調控基因水平的降低是否會導致凍融后雞精子活力的下降,尚需進一步研究。
HSP90和HSP70同屬于HSPs(熱應激蛋白)家族。70 ku熱休克蛋白(HSP70)在生殖系統發育和功能調節中具有重要作用[12]。70 ku熱休克蛋白2(HSPA2)已被證明對小鼠精子發生過程中生殖細胞分化的進展至關重要[13]。最近研究發現,同樣在雄性生殖系統中高度表達的HspA1L作為絲氨酸/蘇氨酸激酶MAPKAP激酶2(MK2)的底物,通過P38 MAPK信號通路在精子的發生中發揮重要作用[14]。90 kDa熱休克蛋白(HSP90)已發現其位于所有檢查物種的精子尾巴中,并在精子繁殖力中起關鍵作用[15]。Casas等[16]研究表明,在豬精液冷凍保存前進行低溫平衡、添加保護劑過程時,抗凍組的公豬HSP90基因的表達量顯著高于不抗凍組,這可能是精子在適應冷應激所做出的反應。同樣,王紅等[17]研究表明,HSP90蛋白的含量與凍后牛精子的活力、質膜完整性、頂體完整性之間存在一定的正相關,可能與冷凍過程中相關抗凍蛋白的降解有關。本研究發現,HSP90和HSP70的mRNA水平在2種抗凍保護劑凍后表現出顯著差異,而且凍后精子活力高的保護劑Ⅰ中HSP90和HSP70較保護劑Ⅱ顯著上調,提示保護劑Ⅰ具有更好的抗凍保護效果,可以更好的應用到海蘭褐種公雞精液的冷凍保存中。然而HSP90蛋白改善解凍后精子活力和活率的潛在機制仍有待進一步研究。
冷誘導RNA結合蛋白(CIRBP),是冷休克蛋白的一種,參與細胞功能所需的多種信號轉導途徑。CIRBP高表達時維持正常的生精功能,而在精子冷凍后顯著下調,導致有絲分裂或減數分裂紊亂,生精細胞過度凋亡,引起各種機能紊亂[18]。本研究發現,與保護劑Ⅰ相比,凍融處理后保護劑Ⅱ中CIRBP的mRNA水平顯著下降,這表明抗凍保護劑Ⅰ更適合海蘭褐種公雞精液的冷凍保存。不過由于相關研究報道較少,具體原因還有待進一步研究。
綜上所述,本研究發現抗凍保護劑Ⅰ更適合海蘭褐種公雞的精液保存,并通過采用表達譜芯片技術,篩選出不同抗凍保護劑凍后精子的差異表達基因1 604個,主要參與線粒體調節、氧化磷酸化、核糖體調節和細胞周期循環等生物學過程和物質能量的新陳代謝、信號傳導、細胞增殖與凋亡等通路。這些差異表達基因(如CCND1、HSP70、HSP90、RHOA和CIRBP)的變化可能影響不同抗凍保護劑的抗凍效果,為雞精液抗凍保護劑的選擇及其抗凍機制的研究奠定基礎。

