長基因間非編碼RNA963不同可變剪接體在胃癌細胞系中的表達和作用*
杜洪, 夏萬松, 韋四喜,, 夏英,3, 金泳, 李紅羽, 袁婷, 黃海,***
(1.貴州醫科大學附屬醫院 臨床檢驗中心, 貴州 貴陽 550004; 2.貴州醫科大學 醫學檢驗學院, 貴州 貴陽 550004; 3.貴州中醫藥大學第一附屬醫院 檢驗科, 貴州 貴陽 550001)
胃癌(gastric cancer,GC)是世界上常見的惡性腫瘤之一[1]。由于GC起病隱匿,無典型臨床表現,導致GC被發現時常常已是中晚期,患者往往錯失了最佳手術治療時機[2]。因此,迫切需要深入挖掘GC發生發展的分子機制,以期尋找有效的GC早期診斷分子標志物及相應的治療靶點。長鏈非編碼核糖核酸(long noncoding ribonucleic acid,lncRNA )是由RNA聚合酶Ⅱ轉錄生成的一類轉錄本長度超過200 nt的RNA分子[3],研究表明lncRNA在腫瘤的發生發展中發揮重要作用[4-5],本課題組前期研究也表明小核仁RNA宿主基因16(small nucleolar RNA host gene 16,SNHG16)和GC增殖增強轉錄本1(gastric carcinoma proliferation enhancing transcript 1,GHET1)可促進GC的惡性進程[6-8]。長基因間非編碼RNA963(long intergenic non-protein coding RNA 963,LINC00963)定位于人染色體9q34.11,國家生物技術信息中心(National Center for Biotechnology Information,NCBI)數據庫報道僅有1個可變剪接體(alternative splice variant,V),有研究顯示該基因在肺癌、乳腺癌等腫瘤中高表達,可參與腫瘤的惡性進程[9-11],但LINC00963基因是否調控以及如何調控GC發生發展機制卻報道較少。因此,本研究通過克隆測序檢測LINC00963存在的多個V,分析其蛋白編碼能力、并檢測其在GC細胞系中的表達量,同時利用基因沉默技術進一步研究LINC00963不同V的功能,現報告如下。
1 材料與方法
1.1 實驗材料
1.1.1細胞來源 GC細胞系AGS、MKN45、HGC-27、MGC-803及胃正常黏膜細胞系GES-1購自中國科學院細胞庫。
1.1.2主要試劑和儀器 UNlQ-10柱式Trizol總RNA抽提試劑盒(上海生工生物),PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)、TB Green?Premix Ex TaqTMⅡ (Tli RNaseH Plus)及PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(日本,Takara),FirstChoice RLM-RACE Kit和Lipofectamine?RNAiMAX Reagent(美國Invitrogen),BCL2相關X凋亡調節因子(BCL2 associated X apoptosis regulator, Bax)、BCL2凋亡調節因子(BCL2 apoptosis regulator,Bcl-2)及半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartate-specific protease 3,Caspase-3;美國Abcam);LightCycler480熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)儀(瑞士羅氏),凝膠成像分析儀(美國BIO-RAD),臺式冷凍離心機和普通PCR儀(美國Thermo Fisher),DYY-Ⅲ2型穩壓穩流電泳儀(北京六一儀器),化學發光儀(上海培清)。
1.1.3引物和小干擾RNA(small interfering RNA,siRNA)合成 實驗所用引物及siRNA均由上海生工生物股份有限公司合成,以次黃嘌呤磷酸核糖基轉移酶1(hypoxanthine phosphoribosyl transferase 1,HPRT)為內參,具體序列見表1和表2。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequence

表2 si-RNA序列Tab.2 si-RNA sequence
1.2 實驗方法
1.2.1細胞培養 GC細胞系AGS、MKN45、HGC-27、MGC-803及胃黏膜細胞系GES-1培養于含有10%胎牛血清、1%青霉素-鏈霉素抗生素的RPMI-1640培養基中,含5%CO2、37 ℃恒溫恒濕培養箱培養。
1.2.2常規PCR及實時熒光定量PCR(real-time quantitative PCR,qRT-PCR) 常規PCR反應采用3步法:95 ℃ 30 s,68 ℃ 30 s、72 ℃ 1 min,擴增40個循環擴增GC細胞系AGS、MKN45、HGC-27、MGC-803及胃黏膜細胞系GES-1,產物經瓊脂糖凝膠電泳后送生工生物工程(上海)股份有限公司進行克隆測序。qRT-PCR擴增反應采用兩步法:95 ℃ 10 s、60 ℃ 30 s,擴增40個循環。采用2-△△Ct分析GC細胞系AGS、MKN45、HGC-27、MGC-803及胃黏膜細胞系GES-1中基因的相對表達量,進行3次生物學重復。
1.2.3cDNA末端快速擴增(rapid amplification of cDNA ends,RACE)實驗 取“1.2.2”項下已提取的RNA按試劑盒說明書操作進行RACE實驗,RACE產物進行逆轉錄反應成cDNA后用于常規PCR反應下游引物用LINC00963-R1557。PCR反應采用3步法:95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,擴增40個循環。PCR產物經1%瓊脂糖凝膠分離后切膠送生工生物工程(上海)股份有限公司進行克隆測序。
1.2.4蛋白編碼潛力預測 測序數據采用SnapGene軟件讀取,并應用基礎比對搜索工具(basic local alignment search tool,BLAST)進行序列比對分析,采用美國國家生物技術信息中心(National Center for Biotechnology Information,NCBI)開放閱讀框查找工具(https://www.ncbi.nlm.nih.gov/orffinder/)分析V蛋白質編碼潛力。
1.2.5免疫印跡分析 GC細胞HGC-27培養于6孔板中,設置si-NC、si-V1-a、si-V1-b及si-V1-a+b組。50%密度轉染siRNA 72 h后,提取蛋白,經電泳后轉印于聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,使用牛奶封閉、相應一抗孵育過夜,最后孵育二抗并采用辣根過氧化物酶化學發光劑曝光,收集并分析結果。
1.3 統計學分析
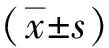
2 結果
2.1 未見報道的LINC00963 V
LINC00963-F598/R739引物擴增時發現該擴增產物大小與理論不符,測序發現該基因轉錄本第2外顯子5′端多出59個堿基、且與第1內含子3′端59個堿基完全匹配。應用LINC00963-F503/R1557擴增發現存在多個擴增產物,切膠測序證實至少存在3個NCBI未收錄的V,分別命名為LINC00963-V1(第三外顯子缺失、第2外顯子多59個堿基,且R711引物設在其中)、LINC00963-V2(第3外顯子缺失)及LINC00963-V3(第2、3外顯子缺失)。見圖1。

注:A為LINC00963可變剪接電泳圖,1、2泳道表示HPRT理論長度125 bp,3、4泳道表示LINC00963-F687/R807理論長度121 bp,5、6泳道表示LINC00963-F687/R1557理論長度871 bp,7、8泳道表示LINC00963-F598/ R711理論長度123 bp;B為LINC00963可變剪接電泳圖,LINC00963-F503/R1557理論長度1 054 bp;C為LINC00963可變剪接體示意圖,數字代表引物開始第一個堿基在野生型序列的堿基位置,方框代表外顯子,線段代表內含子。圖1 LINC00963V的電泳結果及示意圖Fig.1 Schematic diagram of LINC00963 V
2.2 LINC00963不同V在GC細胞系中的表達
設計引物使得引物可擴增單一V,與胃黏膜上皮細胞GES-1相比,qRT-PCR檢測發現LINC00963-V1、LINC00963-V2主要在GC細胞系HGC-27中高表達(P<0.05),并將qRT-PCR產物進行瓊脂糖凝膠電泳。見圖2。

注:A為在GC細胞株中全部V和V1、V2的相對表達量;B為瓊脂糖凝膠電泳分析結果,1~5泳道為內參基因,6~10泳道為全部V,11~15泳道為V1,16~20泳道為V2,第1、6、11、16泳道模板為GES-1,第2、7、12、17泳道模板均為AGS,第3、8、13、18泳道模板為MKN45,第4、9、14、19泳道模板為HGC-27,第5、10、15、20泳道模板為MGC803;與GES-1細胞比較,(1)P<0.001,(2)P<0.01。圖2 GC細胞系中LINC00963 V基因的表達Fig.2 Expression of LINC00963 V in GC cell lines
2.3 LINC00963不同V的5′RACE表征
測序結果進行BLAST比對分析表明前期所發現未見報道V明確存在,且該基因轉錄本5′端發現比NCBI已收錄轉錄本更短;通過NCBI開放閱讀框查找器對新發現V的蛋白編碼能力進行分析,結果顯示LINC00963多個V蛋白編碼能力較弱或不具備蛋白編碼能力,該基因新發現的V極有可能也是非編碼RNA。見圖3。

注:A為5′RACE產物運用LINC00963-R1557引物擴增后克隆測序分析,NR_038955.1為NCBI已收錄轉錄本,其余5個為LINC00963 5′RACE擴增發現的不同轉錄起始位點,數字代表起始位點;B為NCBI 開放閱讀框查找器分析結果,紅色表示可能存在的開放閱讀框,藍色方框表示所預測結果中開放閱讀框最長的一段,白色箭頭代表翻譯方向。圖3 LINC00963不同V的5′RACE克隆測序分析Fig.3 Cloning and sequencing of LINC00963 V by 5′RACE
2.4 HGC-27細胞凋亡蛋白的表達
蛋白免疫印跡檢測結果表明,與si-NC組比較,si-V1-a組、si-V1-b組及si-V1-a+b組敲低LINC00963-V1后,HGC-27細胞凋亡蛋白Caspase-3表達增加、BCL-2表達降低,差異有統計學意義(P<0.05);si-V1-a組、si-V1-b組敲低LINC00963-V1后,HGC-27細胞凋亡蛋白Bax表達增加,差異有統計學意義(P<0.05)。見圖4。

注:A為免疫印跡法檢測結果,B為凋亡相關蛋白的定量結果;與NC組比較,(1)P<0.01,(2)P<0.05,(3)P<0.001。圖4 敲低LINC00963-V1后HGC-27細胞的凋亡相關蛋白表達變化Fig.4 Expression of apoptosis related proteins in HGC-27 cells after knockdown of LINC00963-V1
3 討論
本研究結果表明LINC00963存在多個未見報道的V,為了進一步深入分析LINC00963存在于GC中的V,本研究進行了5′RACE、克隆測序及qRT-PCR實驗,并檢測到LINC00963明確存在多個未見報道或NCBI尚未收錄的V在GC中表達,研究結果表明LINC00963存在新的V且V1、V2在GC細胞系中高表達。
LINC00963基因定位于染色體9q34.11,研究表明LINC00963基因在腫瘤的轉移中扮演著重要的角色[12-13]。LINC00963基因的表達失調往往預示著一些腫瘤侵襲轉移的發生,病情的惡化[14-16],越來越多的研究表明LINC00963與miRNA相互作用,充當分子海綿的作用,促進腫瘤的發生發展[9,17-21]。本研究結果顯示,在GC中LINC00963基因存在多個未見報道的新的V,蛋白質編碼能力較弱、表達失調,可能參與GC的惡性進程。真核生物基因表達是一個極為精細及復雜的過程,研究表明人類的基因數量范圍2~3萬個,但是蛋白質的類型卻遠遠多于基因,很大原因與RNA可變剪接修飾相關[22]。同一基因可產生不同的V,從而翻譯出不同的蛋白質發揮不同的功能[23-24]。也有研究指出LINC00963在肺癌中存在NCBI尚未收錄的V,僅5′端減少了部分堿基且在肺癌的發生發展中發揮著重要的作用,參與肺癌的增殖、轉移等分子機制[9]。也有研究顯示LINC00963在乳腺癌中發揮重要功能,但通過BLAST比對文章所提供引物,發現引物無法與模板匹配,或許在其他腫瘤中還存在其他V形式[25]。依據NCBI已收錄LINC00963基因RNA序列設計引物擴增時,本研究發現在GC細胞系中存在多個未見報道的V;運用qRT-PCR檢測不同V發現主要在HGC-27細胞株中高表達,提示可能參與GC更為重要的分子機制。5′RACE實驗發現LINC00963-V1是一類存在多個轉錄起始位點的V,但未見V2、V3,可能與V2、V3表達相對較低有關;同時NCBI開放閱讀框查找器分析LINC00963多個V,結果顯示該基因蛋白編碼較弱,提示LINC00963基因在發生可變剪接后依然以非編碼RNA的形式參與細胞功能。
本研究結果表明,在胃癌細胞系HGC-27中LINC00963-V1表達最高,后選擇V1作為主要研究對象。敲低LINC00963-V1后觀察到細胞密度較NC組低且死細胞較多,懷疑LINC00963-V1可能參與GC細胞抗凋亡的機制。此外,本研究中發現敲低LINC00963-V1后促進了細胞的凋亡,Caspase-3被激活,促進細胞凋亡的發生,Bcl-2家族蛋白中Bcl-2表達降低,Bax表達增加,誘導促進細胞凋亡。Bcl-2、Bax及Caspase-3蛋白分子在細胞凋亡的機制中扮演著非常重要的角色,研究報道Bcl-2家族蛋白在線粒體上對細胞凋亡發揮著對凋亡形成因子的釋放調節功能,Bcl-2表達增加則抑制凋亡形成因子釋放,抑制細胞凋亡;Bax表達增加則促進凋亡形成因子釋放,促進細胞凋亡;Caspase-3更是凋亡機制中重要的功能執行者[26-27]。本研究的結果表明LINC00963-V1可以通過影響Bcl-2家族蛋白和Caspase-3蛋白直接或間接抑制細胞凋亡蛋白的表達,在腫瘤細胞的惡性進程中發揮著促進作用。
綜上所述,本研究結果表明LINC00963在GC中存在的多個未見報道的V,且LINC00963可能通過誘導凋亡相關蛋白的表達促進GC凋亡。

