廣西北部灣入侵植物互花米草內生可培養細菌多樣性及促生防病活性分析
李慧穎 申乃坤 吳家法 楊立芳 吳宛容 鄧禮霞 姜明國


摘要:【目的】探究不同入侵程度互花米草(Spartina alterniflora)根、莖和葉內生可培養細菌的多樣性,并分析其對植物的防病促生活性,為互花米草入侵研究提供新思路,同時為后續的農業應用提供菌種資源。【方法】以不同入侵程度的互花米草為研究對象,采用6種選擇培養基,通過稀釋涂布法分離內生細菌;利用16S rRNA序列相似性及構建系統發育進化樹確定內生細菌的分類地位。通過平板對峙法檢測內生細菌拮抗香蕉枯萎病病原菌活性;通過功能培養基分析內生細菌產吲哚乙酸(IAA)、溶磷和固氮等促生活性。【結果】從互花米草的根、莖和葉中共分離出269株內生細菌,根據菌落形態和培養特征去重復后獲得82株細菌;對內生細菌進行16S rRNA測序及比對分析,82株細菌分屬于6綱16目19科31屬,其中包括固氮細菌21株(占25.61%)、產IAA細菌21株(占25.61%)、溶磷菌11株(占13.41%),可拮抗香蕉枯萎病病原菌14株(占17.07%),并發現潛在新種13株(占15.85%)。互花米草入侵程度不同,內生細菌多樣性也發生變化,隨著入侵程度的增加,γ變形菌占據優勢,而放線菌和芽孢桿菌多樣性增加。【結論】互花米草內生細菌具有豐富的多樣性,且多具有促生活性和生防功能,在未來農業生產中具有潛在應用價值。
關鍵詞: 入侵植物;互花米草;內生細菌;多樣性;促生活性;生防功能
中圖分類號: S459;Q938.1? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2021)04-1012-10
Diversity of culturable endophytic bacteria in invasive plant Spartina alterniflora of Guangxi Beibu Gulf and their biocontrol effect and plant-growth-promoting activity
LI Hui-ying1,2, SHEN Nai-kun1,2, WU Jia-fa1,2, YANG Li-fang3, WU Wan-rong1,2,
DENG Li-xia1,2, JIANG Ming-guo1,2*
(1Guangxi Key Laboratory for Polysaccharide Materials and Modifications, Nanning? 530008, China; 2School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning? 530008, China; 3School of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning? 530008, China)
Abstract:【Objective】To study diversity of culturable endophytic bacteria in the roots, stems and leaves in different degrees of invasion of Spartina alterniflora,and analyze their biocontrol and plant-growth-promoting activity,provide new research ideas for S. alterniflora invasion research and provide microbial resources for subsequent agricultural applications. 【Method】S. alterniflora with different invasion degrees were used as the research object, and six selective media were used to isolate microorganisms by dilution coating method. 16S rRNA? sequence similarity and construction of phylogenetic trees were used to determine the classification status of microorganisms. The plate confrontation method was used to detect the antagonistic activity of the bacterial strain against the pathogen of banana fusarium wilt; and the indole acetic acid production(IAA), phosphorus solubilization and nitrogen fixation were analyzed through functional plate analysis.【Result】A total of 269 endophytic bacteria were screened from the roots, stems and leaves of S. alterniflora. After deduplication according to the colony morphology and culture characteristics, the 16S rRNA sequencing and comparison of 82 strains were performed, and they belonged to 6 classes, 16 orders, 19 families and 31 genera, including 21 strains of nitrogen-fixing bacteria(25.61%), 22 strains of IAA-producing bacteria(25.61%), 11 strains of phosphate solubilizing bacteria(13.41%), 14 strains(17.07%) could antagonize the pathogen of banana fusarium wilt, and discovered potential 13 new strain species(15.85%). The degree of invasion of S. alterniflora was different, and the diversity of endophytic bacteria also changed. As the degree of invasion increased, γ-proteobacteria dominated, while the diversity of actinomycetes and bacillus increased. 【Conclusion】The endophytes of S. alterniflora are rich in diversity, and mostly have life-promo-ting and biological control functions. They have potential application value in future agricultural production.
Key words: invasive plant; Spartina alterniflora; endophyte; diversity; plant-growth-promoting activity; biocontrol effect
Foundation item: Science and Technology Major Project of Guangxi(Guike AA18242026); Specific Research Pro-ject of Guangxi for Research Bases and Talents(AD18281066,AD18126005); Innovation Project of Guangxi Graduate Education(gxun-chxzs2019037)
0 引言
【研究意義】互花米草(Spartina alterniflora)原產于大西洋沿岸,1979年由南京大學徐國萬教授等為了替代大米草保灘護岸、改良土壤引入我國(楊東和萬福緒,2014)。由于互花米草耐鹽、耐淹、繁殖力極強(Prasanta and Niranjan,2011),已擴散至除海南省外北起遼寧南至廣西的全部沿海省份(宮璐等,2017)。互花米草入侵造成生物多樣性降低及生態系統退化,對生態環境和水產養殖業等造成嚴重危害和巨大經濟損失(Li et al.,2008)。2003年國家環保總局公布首批16種外來入侵物種名單,互花米草作為唯一的海岸鹽沼植物被列入其中(謝寶華等,2019)。因此,開展互花米草內生菌多樣性及其防病促生活性研究,對了解互花米草入侵機制和擴大農業菌種資源具有重要意義。【前人研究進展】內生菌廣泛分布于各植物組織中,且在各組織中存在差異。植物內生菌可增加植物的抗逆性,促進植物生長(Baldan et al.,2014;陳利云等,2020)。隨著科學研究的不斷深入,植物內生細菌在生物防治及生理生態方面的作用逐步被挖掘,成為國內外農業和醫藥領域的研究熱點(何珊和田志宏,2020)。遲惠榮等(2019)采用平板對峙法從多花黃精中篩選生防菌,發現1株對尖孢鐮刀菌具有較強抑菌作用和促生作用的芽孢桿菌。鄧振山等(2019)、陽湖榮等(2019)采用稀釋涂布法對巨菌草和白術內生菌進行分離并鑒定其促生活性,發現其內生菌具有固氮、溶磷、解鉀和合成吲哚乙酸(IAA)的潛力。付思遠等(2020)采用IS-PCR指紋圖譜對泓森槐固氮內生菌進行聚類分析,發現其菌株多具有固氮、溶磷、解鉀等促生活性。目前,已有部分科學家關注入侵植物內生菌對入侵植物的影響,將內生菌與植物入侵機制相聯系,以探尋內生菌對植物入侵的作用機理。Rout等(2013)通過抗生素抑制入侵植物石茅內生菌,結果發現石茅生長速度和生物量明顯下降,根莖明顯減少,從側面證明入侵植物內生菌對植物入侵起重要作用。Dai等(2016)構建入侵植物南美蟛蜞菊接種其內生菌的完全無菌純培養系統,培養發現其內生菌可較明顯地促進南美蟛蜞菊的生長。侯曉杰等(2018)利用平板對峙法從入侵植物黃頂菊內生細菌中篩選出對蘋果輪紋病菌具有良好抑制效果的生防菌。程丹丹等(2019)利用16S rRNA序列的高通量測序技術和后續分析,探索入侵植物小蓬草內生菌群落的組成和多樣性,發現鞘氨醇單胞菌屬和根瘤菌屬等優勢菌株為植物益生菌。【本研究切入點】已有研究表明植物內生菌多具有促生和生防功能,且植物入侵可能與其內生菌群落結構和多樣性存在關聯,但關于不同入侵程度互花米草內生細菌多樣性差異及其功能分析至今未見報道。【擬解決的關鍵問題】采用分離培養法對不同入侵程度的互花米草內生細菌進行多樣性差異分析,探究內生細菌在互花米草入侵過程中發揮的作用,為從微生物學角度解釋互花米草入侵機制提供參考,同時篩選獲得具有防病促生功能菌株,為后續的農業應用提供菌種資源。
1 材料與方法
1. 1 試驗材料
1. 1. 1 樣品采集 于廣西北海市鐵山港區(東經108°18′9.76″~109°47′80.46″,北緯21°26′46.88″~21°47′0.78″)采樣時選取剛入侵(互花米草單種蓋度≤30%的入侵群落)和大范圍入侵(互花米草單種蓋度≥70%的入侵群落)的互花米草健康植株各5株,保存在無菌密封袋中,置于冰盒帶回實驗室,24 h內進行內生細菌分離。
1. 1. 2 供試病原菌 香蕉枯萎病病原真菌尖孢鐮刀菌(Fusarium oxysporum f. sp. cubense)由廣西多糖材料與改性重點實驗室提供。
1. 1. 3 分離培養基 (1)YIM171培養基:甘油10.00 g,天冬酰胺1.00 g,磷酸氫二鉀1.00 g,七水硫酸鎂0.50 g,碳酸鈣0.30 g,復合維生素0.03 g,微量元素溶液(七水硫酸亞鐵0.10 g,四水氯化錳0.10 g,七水硫酸鋅0.10 g,溶于100 mL水)1 mL,海鹽25.00 g,瓊脂15.00 g,蒸餾水1000 mL,pH 7.2±0.2。(2)R2A培養基:酵母浸出粉0.500 g,蛋白胨0.500 g,酪蛋白水解物0.500 g,葡萄糖0.500 g,可溶性淀粉0.500 g,磷酸二氫鉀0.300 g,硫酸鎂0.024 g,丙酮酸鈉0.300 g,瓊脂15.000 g,蒸餾水1000 mL,pH 7.2±0.2。(3)LB培養基:胰蛋白胨10.00 g,酵母提取物5.00 g,氯化鈉10.00 g,蒸餾水1000 mL,pH 7.2±0.2。(4)Zobell 2216E培養基:蛋白胨5.00 g,酵母膏1.00 g,磷酸高鐵0.01 g,瓊脂15.00 g,陳海水1000 mL,pH 7.2±0.2。(5)NBRIP培養基:葡萄糖10.00 g,磷酸三鈣 5.00 g,氯化鎂 5.00 g,七水硫酸鎂0.25 g,氯化鉀0.20 g,硫酸銨1.00 g,蒸餾水1000 mL,pH 6.8~7.0。(6)Ashby無氮培養基(g/L):甘露醇10.00 g,磷酸二氫鉀0.20 g,七水硫酸鎂0.20 g,氯化鈉0.20 g,石膏0.10 g,碳酸鈣 5.00 g,蒸餾水1000 mL,pH 7.2±0.2。
1. 2 試驗方法
1. 2. 1 樣品處理 分別取不同入侵程度互花米草植株的根、莖和葉,去除表面附著土壤顆粒并用無菌水沖洗3次后,取根、莖和葉組織各1 g,以75%酒精消毒根組織3 min、莖和葉組織1 min;1% NaClO溶液浸泡根組織5 min、莖和葉組織3 min;最后以無菌水進行反復沖洗,并吸干水分。吸取最后1次漂洗的無菌水100 μL涂布于配置好的培養基上,驗證消毒效果。將處理后的各樣品加入9 mL無菌水研磨至勻漿后,分別用無菌水稀釋3次,得到濃度為10-2、10-3和10-4稀釋液,取200 μL涂布于配置好的培養基上(劉魯峰等,2019)。
1. 2. 2 菌株分離及保存 將涂布好的培養基于30 ℃倒置培養3~7 d,挑取單菌落接種于LB培養基斜面上,根據菌落形態和培養特征去重復后,純化菌株,轉入斜面4 ℃短期保存,轉入20%(v/v)甘油管 -20 ℃長期保藏。
1. 2. 3 DNA提取與菌株鑒定 基因組DNA提取參考周雙清等(2010)的方法。采用細菌通用引物27F(5'-CAGAGTTTGATCCTGGCT-3')和1492R(5'-AGGAGGTGATCCAGCCGC-3')進行PCR擴增。PCR 擴增體系50.0 μL:2×Taq MasterMix 25.0 μL ,上、下游引物(10 μmol/L)各1.0 μL,DNA模板1.0 μL,ddH2O 22.0 μL。擴增程序:95 ℃預變性4 min;95 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,進行32個循環;72 ℃延伸10 min。
擴增產物送至生工生物工程(上海)股份有限公司進行測序。測序結果輸入EzBioCloud數據庫中進行比對,獲取分離菌株最相似菌株及其相似性,16S rRNA序列相似度小于98.65%定義為潛在新種(Kim et al.,2014),根據比對結果判斷分離菌株的分類地位。使用MEGA 6.0中的鄰接法(Neighbour-joining)構建系統發育進化樹。
1. 2. 4 促生菌株篩選 通過功能培養基分析內生細菌產吲哚乙酸(IAA)、溶磷和固氮等促生活性。
1. 2. 4. 1 固氮能力菌株篩選 將篩選出的互花米草內生細菌于LB液體培養基中活化1 d,分別接種于Ashby無氮固體培養基和Ashby無氮液體培養基,以清水為對照,3次重復,30 ℃恒溫培養3~7 d,觀察固體培養基中有菌落和液體培養基渾濁為陽性,則有固氮活性(姚玉玲等,2014)。
1. 2. 4. 2 溶磷能力菌株篩選 將篩選出的互花米草內生細菌于LB液體培養基中活化1 d,接種于NBRIP培養基,以清水為對照,3次重復,30 ℃恒溫倒置培養3~7 d,出現透明圈則該菌株具有溶磷活性(趙龍飛等,2015)。
1. 2. 4. 3 產IAA能力菌株篩選 采用Salkowski比色法,將待測菌株接種于加有色氨酸的LB液體培養基,30 ℃下180 r/min培養3 d,離心取上清液100 μL,加入等體積Salkowskis試劑混勻,室溫下避光反應30 min,觀察顏色變化,紅色或粉紅色為陽性,即產生IAA(Glickmann and Dessaux, 1995)。
1. 2. 5 抑制病原真菌能力菌株篩選 采用平板對峙法測定。使用滅菌打孔器(r=0.5 cm)從PDA培養基中獲取已培養完成的香蕉枯萎病病原菌尖孢鐮刀菌接種于PDA培養基正中心,并將分離得到的互花米草內生細菌接種于PDA培養基四周,以不接種內生細菌的PDA培養基為對照。30 ℃恒溫培養2~3 d,篩選得到具有抑菌效果的內生細菌,再接種于病原菌的四周,重復3次,進行復篩,測定病原菌直徑,計算抑菌率(徐亞軍等,2013)。抑菌率(%)=(對照菌落直徑-測定菌落直徑)/對照菌落直徑。
2 結果與分析
2. 1 互花米草內生可培養細菌多樣性分析結果
從互花米草植株中共分離出269株菌株,根據菌落形態和培養特征去重復后獲得82株菌株。對82株菌株進行16S rRNA序列測序,經EzBioCloud數據庫比對,82株菌株分屬于6綱16目19科31屬,6個綱分別為放線菌綱(Actinobacteria)、芽孢桿菌綱(Bacilli)、α-變形菌綱(Alphaproteobacteria)、γ-變形菌綱(Gammaproteobacteria)、異常球菌綱(Deinococci)和黃桿菌綱(Flavobacteriia)。選取各個屬中模式菌株以鄰接法構建系統發育進化樹。如圖1所示,γ-變形菌綱和α-變形菌綱為優勢類群,分別包括雷伯氏菌屬(Klebsiella)、假單胞菌屬(Pseudomonas)、嗜冷桿菌屬(Psychrobacter)等11個屬26株菌株(占31.71%)和Tistrella、Martelella等9個屬14株菌株(占17.07%)。此外,還分離出與已發現菌株相似性在96.13%~98.63%的潛在新種13株(占15.85%)(表1),表明互花米草存在大量可挖掘的新的微生物資源。
2. 2 互花米草不同組織內生可培養細菌多樣性差異分析結果
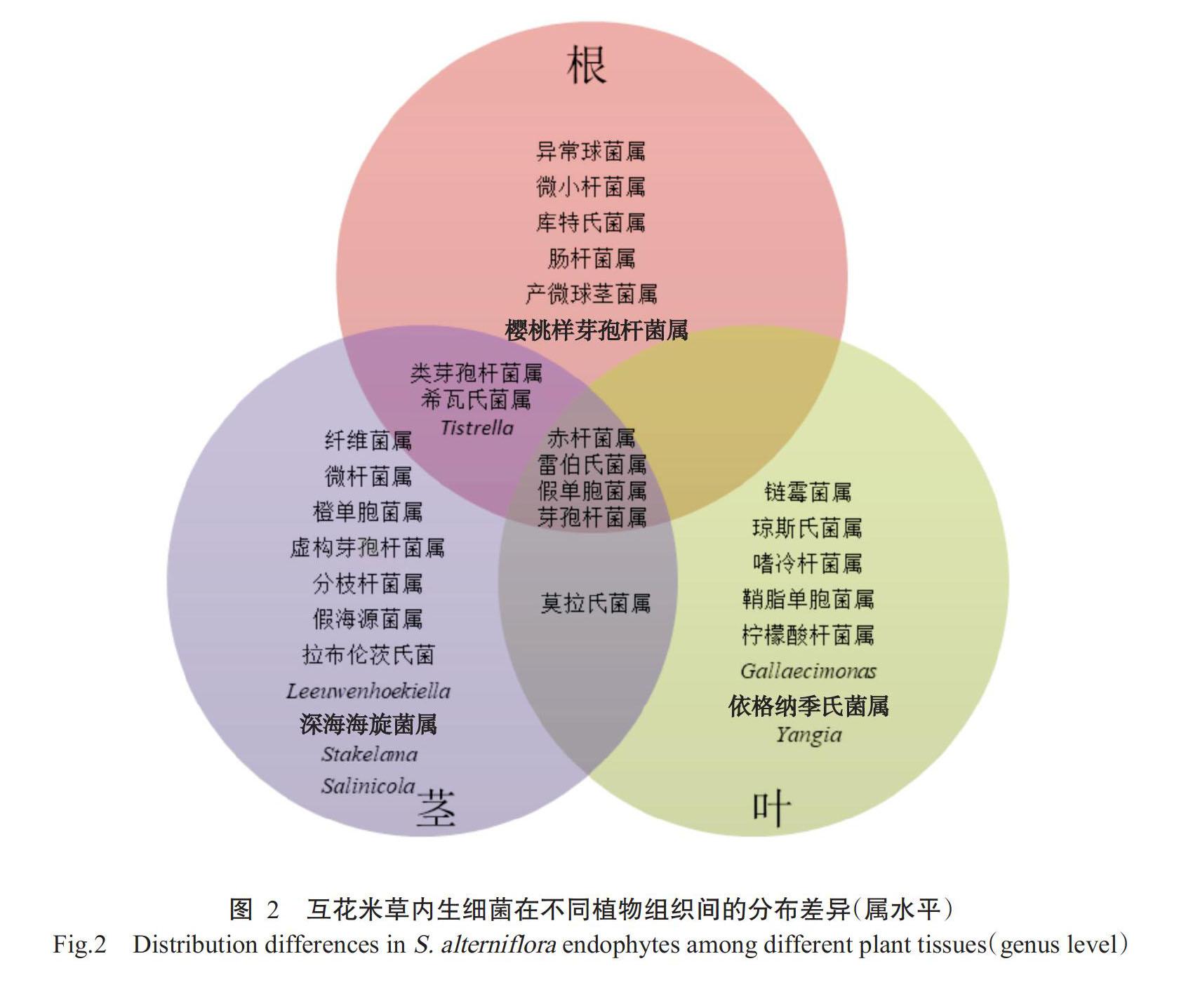
從互花米草根、莖和葉中分別分離得到107、93和69株內生菌,通過16S rRNA測序及EzBioCloud數據庫比對,分屬于6綱16目19科31屬,屬的差異如圖2所示。根的內生細菌分屬于13屬:異常球菌屬(Deinococcus)、微小桿菌屬、櫻桃樣芽孢桿菌屬(Cerasibacillus)、庫特氏菌屬(Kurthia)、腸桿菌屬(Enterobacter)、產微球莖菌屬(Microbulbifer)、類芽孢桿菌屬(Paenibacillus)、雷伯氏菌屬(Klebsiella)、希瓦氏菌屬(Shewanella)、Tistrella、赤桿菌屬(Erythrobacter)、假單胞菌屬和芽孢桿菌屬。莖的內生細菌分屬于19屬:虛構芽孢桿菌屬(Fictibacillus)、微桿菌屬(Microbacterium)、分枝桿菌屬(Mycolicibacterium)、纖維菌屬(Cellulomonas)、Leeuwenhoekiella、拉布倫茨氏菌(Labrenzia)、深海海旋菌屬(Thalassospira)、Stakelama、Salinicola、橙單胞菌屬(Aurantimonas)、假海源菌屬(Pseudidiomarina)、類芽孢桿菌屬、雷伯氏菌屬、希瓦氏菌屬、Tistrella、赤桿菌屬、假單胞菌屬、芽孢桿菌屬和莫拉氏菌屬(Moraxella)。葉的內生細菌分屬于13屬:鏈霉菌屬(Streptomyces)、瓊斯氏菌屬(Jonesia)、雷伯氏菌屬、Gallaecimonas、嗜冷桿菌屬(Psychrobacter)、鞘脂單胞菌屬(Sphingomonas)、Yangia、依格納季氏菌屬(Ignatzs-chineria)、假單胞菌屬、檸檬酸桿菌屬(Citrobacter)、赤桿菌屬、芽孢桿菌屬和莫拉氏菌屬。互花米草不同組織內生細菌分布差異明顯,根和莖有7個共有屬(類芽孢桿菌屬、希瓦氏菌屬、Tistrella、赤桿菌屬、 假單胞菌屬、芽孢桿菌屬和雷伯氏菌屬),莖和葉有5個共有屬(赤桿菌屬、雷伯氏菌屬、假單胞菌屬、芽孢桿菌屬和莫拉氏菌屬),根和葉有4個共有屬(赤桿菌屬、雷伯氏菌屬、假單胞菌屬和芽孢桿菌屬),根、莖和葉有4個共有屬(赤桿菌屬、雷伯氏菌屬、假單胞菌屬和芽孢桿菌屬)。從菌株數量上看,表現為根>莖>葉。
2. 3 不同入侵程度互花米草內生細菌差異分析結果
分別從互花米草剛入侵和大范圍入侵植株體內分離得到141和128株內生細菌,通過16S rRNA測序及EzBioCloud數據庫比對,141和128株內生細菌分別屬于19和25個屬,其中9個屬為共有屬。通過對比發現,互花米草大范圍入侵后,其內生細菌群落較剛入侵時發生明顯改變,放線菌綱中分枝桿菌屬被替換為瓊斯氏菌屬、纖維菌屬和鏈霉菌屬,芽孢桿菌中增加了微小桿菌屬、櫻桃樣芽孢桿菌屬、Kurthia和虛構芽孢桿菌屬等;α變形菌多樣性降低,深海海旋菌屬、Yangia、Stakelama、赤桿菌屬和鞘脂單胞菌屬等消失;γ變形菌多樣性則呈增加趨勢,檸檬酸桿菌屬、腸桿菌屬、Gallaecimonas、嗜冷桿菌屬、希瓦氏菌屬、Salinicola和依格納季氏菌屬等出現。表明入侵程度不同導致互花米草內生細菌的種屬差異明顯,隨著入侵程度的增加,γ變形菌占據優勢,而放線菌和芽孢桿菌多樣性增加。
2. 4 互花米草內生細菌促生性分析結果
對互花米草內生細菌進行菌株促生活性分析,結果分別獲得21株固氮菌和產IAA菌,分別占分離菌株總數的25.61%,溶磷菌11株(占13.41%),分屬于4綱7目10科17屬中(表2)。
2. 5 互花米草內生細菌抑菌功能分析結果
通過平板對峙法篩選到對供試香蕉枯萎病病原菌尖孢鐮刀菌具有抑制作用的菌株14株(占17.07%),抑菌率為15.46%~68.31%,其中抑菌活性最高的為貝萊斯芽孢桿菌(B. velezensis),抑菌率為68.31%(表3)。部分菌株對香蕉枯萎病病原菌的抑制效果見圖3。
3 討論
3. 1 互花米草內生細菌群落結構多樣性
從互花米草根、莖和葉中分別分離得到內生細菌107、93和69株,分屬于放線菌綱、芽孢桿菌綱、α-變形菌綱、γ-變形菌綱、異常球菌綱及黃桿菌綱。互花米草內生細菌種類較多,變形菌為主要優勢菌,占48.78%,其中γ-變形菌綱和α-變形菌綱分別占31.71%和17.07%,與李虎等(2014)報道互花米草的內生細菌及程亮(2019)發現矮火絨草的內生細菌優勢菌均為變形菌的結果一致。本研究發現潛在新種13株,與已發現菌株相似性在96.13%~98.63%,表明互花米草存在大量可挖掘的生物資源。
本研究結果顯示,從互花米草根、莖和葉組織中分離的內生細菌數量表現為根>莖>葉,與劉魯峰等(2019)對甘蔗不同組織內生菌的研究結果一致。大量研究表明,內生菌在植物組織的分布存在差異,可能是由于植物各組織結構不同導致供給內生菌營養成分有所差異(方珍娟等,2018)。
隨著互花米草入侵程度的增加,其體內內生細菌種類發生變化,互花米草內生放線菌瓊斯氏菌屬、纖維菌屬和鏈霉菌屬增加。瓊斯氏菌屬被發現來源于海洋(Zeynab et al.,2020),鏈霉菌屬被發現廣泛來源于紅樹林土壤中(候師師等,2020)。γ變形菌多樣性增加,檸檬酸桿菌屬、腸桿菌屬、Gallaecimonas、嗜冷桿菌屬、希瓦氏菌屬、Salinicola和依格納季氏菌屬等出現。Gallaecimonas屬在紅樹林沉積物和海水中被分離得到(Wang et al.,2013;Zhang et al.,2018),嗜冷桿菌屬和希瓦氏菌屬廣泛存在于紅樹林根內和海洋中(孫靜等,2014;聶唱等,2020; Maxim et al.,2020)。因此,隨著入侵程度的增加,互花米草內生細菌種類的增加可能是來源于紅樹林土壤及海洋中。這符合內生菌來源的假說之一,根際菌進入植物,經過長期的協同進化作用,與植物建立了一種和諧的內生關系,形成內生菌(徐亞軍,2011)。
3. 2 可培養細菌促生活性及生防功能
植物內生菌是一類種類及功能多樣的微生物。植物內生菌多對宿主產生有益作用,包括直接分泌生長素促進植物生長,溶磷解鉀作用、固氮作用和抑制病原菌等間接促進植物生長,以及增加植物的抗逆作用等(Raheem et al.,2017; Charlie et al.,2018;Xu et al.,2019;龐發虎等,2020),探究內生菌功能活性已成為研究熱點之一(Borah et al.,2019;Khan et al.,2020)。
鄧振山等(2019)從巨菌草(Pennisetum giganteum)中分離出具有溶磷、固氮、抑制病原菌能力,以及產鐵載體的內生菌;陽湖榮等(2019)從白術(Atractylodes macrocephala Koidz)中分離得到較多具有促生能力的芽孢桿菌以及1株兼具固氮、溶磷、解鉀能力且吲哚乙酸合成能力較強的內生芽孢桿菌屬內生菌;付思遠等(2020)從泓森槐(Robinia pseudoacacia ‘Hongsen)中分離得到的類芽孢桿菌屬(Paenibacillus sp.)內生菌具有固氮能力,而分離出的克雷伯氏菌屬兼具解鉀、溶磷、產生長素、產鐵載體和聯合固氮等多種促生長特性。本研究獲得抑菌活性最高的菌株與貝萊斯芽孢桿菌的相似性達100.00%。遲惠榮等(2019)研究發現多花黃精(Polygonatum cyrtonema Hua)內生貝萊斯芽孢桿菌對尖孢鐮刀菌有較強的抑制作用;程亮(2019)從青藏高原矮火絨草內生細菌中篩選得到的芽孢桿菌屬拮抗細菌的拮抗能力強、種類多,本研究結果與之一致。
隨著互花米草入侵程度的加深,γ變形菌多樣性增加,檸檬酸桿菌屬、腸桿菌屬和依格納季氏菌屬等屬出現,其中檸檬酸桿菌屬篩選得到具有溶磷活性的菌株,腸桿菌屬篩選出具有溶磷、固氮和產IAA活性的菌株;依格納季氏菌屬中篩選出具有固氮和產IAA活性的菌株;放線菌、芽孢桿菌和α變形菌中被保留的微桿菌屬、類芽孢桿菌屬、拉布倫茨氏菌屬均篩選出具有固氮活性的菌株。因此,隨著入侵程度的增加,內生菌種類更加趨向于對植株產生有益活性的菌株,與Cheng等(2019)的研究結果類似,為探究植物—細菌相互作用在植物入侵中的作用提供參考。
4 結論
互花米草內生細菌具有豐富的多樣性,且多具有促生活性和生防功能,可為后續相關研究及應用提供微生物資源。
參考文獻:
陳利云,呼麗萍,汪之波. 2020. 內生菌醇提取物對雞冠花生長與抗逆性的影響[J]. 江西農業學報,32(3):61-64. doi:10.19386 /j.cnki.jxnyxb.2020.03.11. [Chen L Y,Hu L P,Wang Z B. 2020. Effects of endophytic alcohol extract on growth and stress resistance of cockscomb[J]. Acta Agriculturae Jiangxi,32(3):61-64.]
程丹丹,趙菁,田忠賽. 2019. 入侵植物小蓬草的細菌群落組成和多樣性研究[J]. 安全與環境工程,26(2):16-24. doi:10.13578/j.cnki.issn.1671-1556.2019.02.003. [Cheng D D,Zhao J,Tian Z S. 2019. Composition and diversity of bacterial community of the alien invasive plant(Conyza canadensis L.)[J]. Safety and Environmental Enginee-ring,26(2):16-24.]
程亮. 2019. 青藏高原矮火絨草內生細菌多樣性及生物功能分析[J]. 南方農業學報,50(10):2222-2233. doi:10.3969/ j.issn.2095-1191.2019.10.11. [Cheng L. 2019. Diversity and biological function of endophytic bacteria in Leontopodium nanum of Qinghai-Tibetan Plateau[J]. Journal of Southern Agriculture,50(10):2222-2233.]
遲惠榮,張亞惠,曾欣,陳衛良,毛碧增. 2019. 多花黃精內生貝萊斯芽胞桿菌的分離鑒定及其抗菌與促生作用分析[J]. 植物保護,45(4):122-131. doi:10.16688/j.zwbh. 2018337. [Chi H R,Zhang Y H,Zeng X,Chen W L,Mao B Z. 2019. Isolation and identification of antagonistic endophytic Bacillus velezensis from Polygonatum cyrtonema Hua and analysis of its antimicrobial and growth-promoting activity[J]. Plant Protection,45(4):122-131.]
鄧振山,李買平,郝雷,陳凱凱,李靜,劉玉珍,張寶寶,齊向英. 2019. 巨菌草內生細菌多樣性及其促生特性[J]. 草地學報,27(5):1213-1221. doi:10.11733/j.issn.1007-0435.2019.05.013. [Deng Z S,Li M P,Hao L,Chen K K,Li J,Liu Y Z,Zhang B B,Qi X Y. 2019. Diversity and plant growth promoting activities of the culturable endophytic bacteria associated with Pennisetum sp.[J]. Acta Agrestia Sinica,27(5):1213-1221.]
方珍娟,張曉霞,馬立安. 2018. 植物內生菌研究進展[J]. 長江大學學報(自科版),15(10):41-45. doi:10.16772/j.cnki. 1673-1409.2018.10.011. [Fang Z J,Zhang X X,Ma L A. 2018. Research progress of plant endophytes[J]. Journal of Yangtze University(Natural Science Edition),15(10):41-45.]
付思遠,席雨晴,趙鵬菲,梁永健,宋旭,常華瑜,彭桂香,譚志遠. 2020. 泓森槐可培養內生固氮細菌多樣性與潛在促生長特性評價[J]. 微生物學通報,47(8):2458-2470. doi:10.13344/j.microbiol.china.190906. [Fu S Y,Xi Y Q,Zhao P F,Liang Y J,Song X,Chang H Y,Peng G X,Tan Z Y. 2020. Evaluating diversity and potential growth promoting characteristics of the culturable endophytic dia-zotrophic bacteria isolated from Robinia pseudoacacia ‘Hongsen[J]. Microbiology China,47(8):2458-2470.]
宮璐,李俊生,柳曉燕,趙相健,趙彩云. 2017. 我國部分國家級自然保護區外來入侵物種的分布概況[J]. 生態科學,36(4):210-216. doi:10.14108/j.cnki.1008-8873.2017. 04.028. [Gong L,Li J S,Liu X Y,Zhao X J,Zhao C Y. 2017. Analysis of invasive alien species in Chinese national nature reserves[J]. Ecological Science,36(4):210-216.]
何珊,田志宏. 2020. 植物內生細菌生物學效應的研究進展[J]. 安徽農學通報,26(4):20-23. doi:10.16377/j.cnki.issn1007-7731.2020.04.008. [He S,Tian Z H. 2020. Advances in the study of the biological effects of endophytic bacteria in plant[J]. Anhui Agricultural Science Bulletin,26(4):20-23.]
候師師,李蜜,姜舒,韓敏敏,劉永宏,易湘茜. 2020. 海南西海岸四種真紅樹根系土壤放線菌物種多樣性及其延緩衰老活性初篩[J]. 廣西植物,40(3):320-326. doi:10. 11931/guihaia.gxzw201904051. [Hou S S,Li M,Jiang S,Han M M,Liu Y H,Yi X X. 2020. Species diversity and anti-aging activity of actinobacteria from four true mangrove rhizosphere soils in the west coast of Hainan[J]. Guihaia,40(3):320-326.]
侯曉杰,梁魁景,歐陽汝欣,蘆站根. 2018. 入侵植物黃頂菊內生細菌對蘋果輪紋病菌的拮抗篩選[J]. 中國森林病蟲,37(3):38-40. doi:10.3969/j.issn.1671-0886.2018.03.010. [Hou X J,Liang K J,Ouyang R X,Lu Z G. 2018. Antago-nistic screening of endophytic bacteria of invasive plant Flaveria bidentis against Botryosphaeria dothidea[J]. Fo-rest Pest and Disease,37(3):38-40.]
李虎,廖丹,蘇建強,黃福義,洪有為. 2014. 外來種互花米草根內細菌多樣性及功能[J]. 應用與環境生物學報,20(5):856-862.? doi:10.3724/SP.J.1145.2014.03027. [Li H,Liao D,Su J Q,Huang F Y,Hong Y W. 2014. Diversity and function of endophytic bacteria in roots of exotic plant Spartina alterniflora[J]. Chinese Journal of Applied and Environmental Biology,20(5):856-862.]
劉魯峰,寸海春,何鵬飛,狄義寧,吳毅歆,何麗蓮,李富生,何月秋. 2019. 甘蔗內生菌分離鑒定及功能多樣性研究[J]. 熱帶作物學報,40(6):1144-1152. doi:10.3969/j.issn. 1000-2561.2019.06.016. [Liu L F,Cun H C,He P F,Di Y N,Wu Y X,He L L,Li F S,He Y Q. 2019. Isolation,identification and multiple function analyses of sugarcane endophytes[J]. Chinese Journal of Tropical Crops,40(6):1144-1152.]
聶唱,侯佳林,王寅炤,蹇華嘩. 2020. 深海嗜冷希瓦氏菌Shewanella psychrophila WP2的基因組學分析[J]. 應用海洋學學報,39(3):319-328. doi:10.3969/J.ISSN.2095-4972.2020.03.003. [Nie C,Hou J L,Wang Y Z,Jian H H. 2020. Genomic analysis of the psychrophilic deep-sea bacterium Shewanella psychrophila WP2[J]. Journal of Applied Oceanography,39(3):319-328.]
龐發虎,徐鴿,李敏,謝涵珠,陳兆進. 2020. 芒草根際、內生可培養細菌多樣性及促生潛力研究[J]. 河南農業科學,49(6):64-73. doi:10.15933/j.cnki.1004-3268.2020.06.009. [Pang F H,Xu G,Li M,Xie H Z,Chen Z J. 2020. Research on diversity and plant growth promoting activities of the cultivable rhizosphere and endophytic bacteria of Miscanthus[J]. Journal of Henan Agricultural Scien-ces,49(6):64-73.]
孫靜,王素英,張德超. 2014. 海南紅樹林根系土壤中可培養細菌的多樣性分析[J]. 海洋科學,38(7):27-33. doi:10. 11759/hykx20130608001. [Sun J,Wang S Y,Zhang D C. 2014. Diversity of culturable bacteria from the soil of root system of mangrove forest of Beigang island in Hainan Province[J]. Marine Sciences,38(7):27-33.]
謝寶華,路峰,韓廣軒. 2019. 入侵植物互花米草的資源化利用研究進展[J]. 中國生態農業學報(中英文),27(12):1870-1879. doi:10.13930/j.cnki.cjea.190339. [Xie B H,Lu F,Han G X. 2019. Resource utilization of invasive Spartina alterniflora:A review[J]. Chinese Journal of Eco-Agriculture,27(12):1870-1879.]
徐亞軍,趙龍飛,陳普,蔣曉瑞,韋革宏. 2013. 植物病原菌拮抗性野生艾蒿內生菌的分離、篩選和鑒定[J]. 生態學報,33(12):3697-3705. doi:10.5846/stxb201212061754. [Xu Y J,Zhao L F,Chen P,Jiang X R,Wei G H. 2013. Isolation,screening and characterization of phytopathogen antagonistic endophytes from wild Artemisia argyi[J]. Acta Ecologica Sinica ,33(12):3697-3705.]
徐亞軍. 2011. 植物內生菌資源多樣性研究進展[J]. 廣東農業科學,38(24):149-152. doi:10.3969/j.issn.1004-874X. 2011.24.049. [Xu Y J. 2011. Research progress on pesources diversity of plant endophytes[J]. Guangdong Agricultural Sciences,38(24):149-152.]
楊東,萬福緒. 2014. 外來入侵種互花米草的研究進展[J]. 植物保護,40(2):5-10. doi:10.3969/j.issn.0529-1542.2014. 02.002. [Yang D,Wan F X. 2014. Research progress on invasive alien species Spartina alterniflora[J]. Plant Protection,40(2):5-10.]
姚玉玲,王穎,王玉琴,楊成德. 2014. 矮生嵩草內生細菌溶磷、抑菌和產IAA能力的測定及鑒定[J]. 草地學報,22(6):1252-1257. doi:10.11733/j.issn.1007-0435.2014.06. 016. [Yao Y L,Wang Y,Wang Y Q,Yang C D. 2014. Identification of endophytic bacteria from Kobresia humilis and determination of phosphate-solubilizing,IAA secretion and antagonistic abilities[J]. Acta Agrestia Sinica,22(6):1252-1257.]
陽湖榮,陳飄雪,戴傳超. 2019. 白術內生細菌分離與促生活性[J]. 生態學雜志,38(12):3680-3688. doi:10.13292/j.1000-4890.201912.003. [Yang H R,Chen P X,Dai C C. 2019. Isolation and plant-growth-promoting ability of endophytic bacteria in Atractylodes macrocephala Koidz[J]. Chinese Journal of Ecology,38(12):3680-3688.]
趙龍飛,徐亞軍,曹冬建,李源,厲靜杰,呂佳萌,朱自億,秦珊珊,賀學禮. 2015. 溶磷性大豆根瘤內生菌的篩選、抗性及系統發育和促生[J]. 生態學報,35(13):4425-4435. doi:10.5846/stxb201406171262. [Zhao L F,Xu Y J,Cao D J,Li Y,Li J J,Lü J M,Zhu Z Y,Qin S S,He X L. 2015. Screening,resistance,phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules[J]. Acta Ecologica Sinica,35(13):4425-4435.]
周雙清,黃小龍,黃東益,胡新文,陳吉良. 2010. Chelex-100快速提取放線菌DNA作為PCR擴增模板[J]. 生物技術通報,24(2):123-125. doi:10.13560/j.cnki.biotech.bull. 1985.2010.02.024. [Zhou S Q,Huang X L,Huang D Y,Hu X W,Chen J L. 2010. A rapid method for extracting DNA from actinomycetes by Chelex-100[J]. Biotechno-logy Bulletin,24(2):123-125.]
Baldan E,Nigris S,Populin F,Zottini M,Squartini A,Baldan B. 2014. Identification of culturable bacterial endophyte community isolated from tissues of Vitisvinifera “Glera”[J]. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology,148(3):508-516. doi:10.1080/11263504.2014.916364.
Borah A,Das R,Mazumdar R,Thakur D. 2019. Culturable endophytic bacteria of Camellia species endowed with plant growth promoting characteristics[J]. Journal of Applied Microbiology,127(3):825-844. doi:10.1111/jam.14356.
Charlie E F,Ria S,Yekti A P,Tri R N,Donny W. 2018. Diversity of endophytic bacteria in sweet sorghum(Sorghum bicolor(L.) Moench.) and their potential for promoting plant growth[J]. Indian Journal of Science and Technology,11(11):1-10. doi:10.17485/ijst/2018/v11i11/120283.
Cheng D D,Tian Z S,Feng L,Xu L,Wang H M. 2019. Diversity analysis of the rhizospheric and endophytic bacterial communities of Senecio vulgaris L.(Asteraceae) in an invasive range[J]. PeerJ,6:e6162. doi:10.7717/peerj.6162.
Dai Z C,Fu W,Wan L Y,Cai,H H,Wang N,Qi S S,Du D L. 2016. Different growth promoting effects of endophytic bacteria on invasive and native clonal plants[J]. Frontiers in Plant Science,7:706. doi:10.3389/fpls.2016.00706
Glickmann E,Dessaux Y. 1995. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology,61(2):793-796. doi:10. 1002/bit.260450314.
Khan M A,Asaf S,Khan A L,Adhikari A,Jan R,Ali S,Imran M,Kim K M,Lee I J. 2020. Plant growth-promoting endophytic bacteria augment growth and salinity tolerance in rice plants[J]. Plant Biology,22(5):850-862. doi:10. 1111/plb.13124.
Kim M,Oh H S,Park S C,Chun J. 2014. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. International Journal of Systematic and Evolutionary Microbiology,64(2):346-351. doi:10.1099/ijs.0.059774-0.
Li B,Liao C Z,Zhang X D,Chen H L,Wang Q,Chen Z Y,Gan X J,Wu J H,Zhao B,Ma Z J,Cheng X L,Jiang L F,Chen J K. 2008. Spartina alterniflora invasions in the Yangtze River estuary,China:An overview of current status and ecosystem effects[J]. Ecological Engineering,35(4):511-520. doi:10.1016/j.ecoleng.2008.05.013.
Maxim S K,Alexandra S K,Lyudmila A R,Irina V C,Oleg V C. 2020. Structure and in vitro bioactivity against cancer cells of the capsular polysaccharide from the marine bacterium Psychrobacter marincola[J]. Marine Drugs,18(5):268. doi:10.3390/md18050268
Prasanta K S,Niranjan B. 2011. Spartina alterniflora Loisel.,a halophyte grass model to dissect salt stress tolerance[J]. In Vitro Cellular & Developmental Biology-Plant,47(4):441-457. doi:10.1007/s11627-011-9361-8.
Rout M E,Chrzanowski T H,Westlie T K,DeLuca T H,Calla-way R M,Holben W E. 2013. Bacterial endophytes enhance competition by invasive plants[J]. American Journal of Botany,100(9):1726-1737. doi:10.3732/ajb.1200 577
Raheem S,Abdul L K,Saqib B,Muhammad W,Kang S M,Lee I J. 2017. Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance in Oryza sativa[J]. Environmental and Experimental Botany,136:68-77. doi:10.1016/j.envexpbot.2017.01.010.
Wang J N,Lai Q L,Duan X,Fu Y Y,Wang L P,Wang W P,Shao Z Z. 2013. Gallaecimonas xiamenensis sp. nov.,isolated from seawater[J]. International Journal of Systema-tic and Evolutionary Microbiology,63(3):930-933. doi:10.1099/ijs.0.042283-0.
Xu W F,Wang F,Zhang M,Ou T,Wang R L,Strobel,G,Xiang Z H,Zhou Z,Xie J. 2019. Diversity of cultivable endophytic bacteria in mulberry and their potential for antimicrobial and plant growth-promoting activities[J]. Microbiological Research,229:126328. doi:10.1016/j.micres.2019.126328.
Zeynab S S,Fereshteh J K,Zohreh Z. 2020. Isolation,characterization,and decolorization of Disperse Blue 60 by newly isolated bacterial strains from Kashan textile wastewater[J]. Water Environment Research,92(6):873-879. doi:10.1002/wer.1282.
Zhang W Y,Yuan Y,Su D Q,He X P,Han S B,Epstein S S,He S,Wu M. 2018. Gallaecimonas mangrovi sp. nov.,a novel bacterium isolated from mangrove sediment[J]. An-tonie van Leeuwenhoek,111(10):1855-1862. doi:10. 1007/s10482-018-1076-y(0123456789).
(責任編輯 麻小燕)

