當歸-骨碎補配伍治療骨折三期辨證中期的網絡藥理學機制
李志鴻, 葉學勁, 劉經鵬, 陳文陽, 滕居贊
(1.廣州市荔灣區中醫醫院,廣東廣州510000;2.廣西中醫藥大學,廣西南寧530011;3.廣西中醫藥大學附屬瑞康醫院,廣西南寧530000)
骨折常導致骨折不愈合[1-2]。中醫學將骨折治則分為三期,骨折中期相當于原始骨痂形成期,此期的特點是腫痛較前期減輕,但瘀腫尚未消盡,筋骨雖連而未堅,故此期宜和營生新、接骨續損。骨折的愈合是從修復過程的起始直至骨折最終塑形完成為止的一個連續不斷的過程。而骨折中期是連接初、后期的一個必不可少的“樞紐”。一旦骨折中期愈合欠佳,將會導致骨折初期治療盡棄,而骨折后期過程停滯,最終導致骨折不愈合。骨折中期治療常用的代表中藥為當歸、骨碎補[3]。當歸始載于《神農本草經》,為傘形科多年生草本植物當歸Angelica sinensis(Oliv.)Diels的干燥根,有補血活血、調經止痛、潤腸的作用。骨碎補始載于《藥性本草》,為水龍骨科多年附生蕨類植物槲蕨Drynaria fortune(Kunze)J.SM.的干燥根莖,其功效主要為活血續傷、補腎強骨。當歸、骨碎補對推進骨折愈合進程有明顯的作用[4],骨折的愈合與血液供應、骨膜完整性破環程度、斷端的接觸、周圍肌群的影響相關。中藥因其成分復雜,對其有效成分的研究開展受限,而中藥網絡藥理學則可從中藥的化合物-靶向-疾病關系反映、闡述其之間的相互作用。本研究系統性運用網絡藥理學方法綜合探討當歸-骨碎補可能的化合物構成,并分析當歸-骨碎補配伍治療骨折三期辨證中期可能的藥理學機制,以期為下一步的藥物基礎研究提供參考,現將研究結果報道如下。
1 資料與方法
1.1 當歸-骨碎補的化學成分借助中藥系統藥理 學 分 析 平 臺(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)分別檢索當歸、骨碎補的所有化學成分,以口服生物利用度(OB)≥30%[5],類藥性(DL)≥0.18[6]為篩選標準,篩選當歸、骨碎補中的活性成分,最后得到當歸2個、骨碎補18個化合物。
1.2 當歸-骨碎補化合物-靶點網絡的構建將通過TCMSP平臺按照篩選標準所得的當歸-骨碎補的20個化合物及其258個靶點,應用Cytoscape3.7.1開放源碼的生物信息分析軟件構建化合物-靶點網絡圖。
1.3 當歸-骨碎補靶蛋白相互作用網絡的構建應用STRING數據庫10.5線上軟件(http://string-db.org),將篩選所得的當歸-骨碎補靶點上傳,選擇智人種(homo sapiens),應用Cytoscape 3.7.1軟件構建當歸-骨碎補靶蛋白互作網絡圖。
1.4 閉合骨折相關靶點數據庫的構建基于CTD(https://ctdbase.org)和GeneCards(https://www.genecards.org)數據庫綜合篩選挖掘閉合骨折相關靶點,構建閉合骨折相關靶點數據庫,與當歸-骨碎補化合物靶點進行對比分析,篩選出當歸-骨碎補作用于閉合骨折的靶點,應用Venny 2.1在線工具(http://bioinfogp.cnb.csic.es/)繪制韋恩圖。
1.5 當歸-骨碎補化合物靶點與閉合骨折相關靶點網絡圖的構建根據當歸-骨碎補化學成分-靶點預測結果和靶點-疾病預測結果,應用Cytoscape 3.7.1軟件中的“Merge”功能,將2個預測結果合并成“化學成分-靶點-疾病”網絡圖,進行全局化可視網絡分析。通過Network Analysis功能計算網絡的拓撲參數,分析其相互關系。
2 結果
2.1 有效化合物的篩選本研究搜索到化合物共196個,其中,當歸化合物125個,骨碎補71個。最后篩選得到當歸2個、骨碎補18個化合物,主要活性成分的OB和DL值見表1。

表1 當歸、骨碎補主要有效化合物信息Table 1 Data of main effective constituents from Radix Angelicae Sinensis and Rhizoma Drynariae
2.2 當歸-骨碎補化學成分潛在靶點預測及相互作用篩選當歸、骨碎補化合物的有效靶點共258個,構建“化合物成分-作用靶點”網絡圖,見圖1。當歸-骨碎補化合物靶點蛋白互作網絡見圖2。

圖1 當歸-骨碎補化合物-靶點網絡圖Figure 1 Radix Angelicae Sinensis-Rhizoma Drynariae constituent-target network
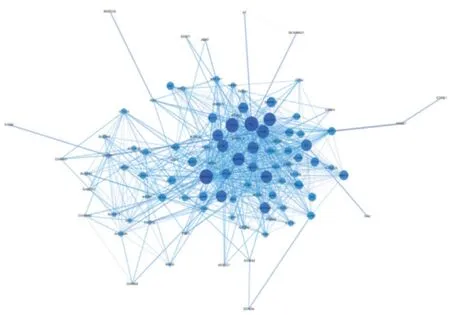
圖2 當歸-骨碎補靶點蛋白互作網絡圖Figure 2 Target protein interaction network of Radix Angelicae Sinensis-Rhizoma Drynariae
2.3 閉合骨折相關靶點數據庫的構建以“Closed Fracture”或“Fracture Closed”作為關鍵詞在CTD、GeneCards數據庫中查詢,初步篩選出CTD數據庫72個,GeneCards數據庫2 950個,共3 022個候選基因。根據“Reference Count”值取GeneCards數據庫中相關度最高的前200個結果,其中與閉合骨折靶點有25個重合,分別為VEGFA、RB1、PPARG、MET、ESR1、CA2、AR、MMP2、IL-6、TP53、VCAM1、PTGS2、NOS2、ABCC1、MAPK3、MAPK1等。當歸-骨碎補靶點與閉合骨折靶點的韋恩圖,見圖3。當歸-骨碎補對閉合骨折作用靶點的蛋白互作網絡,見圖4。當歸-骨碎補化合物-靶點-閉合骨折的全局性網絡,見圖5。

圖3 當歸-骨碎補靶點與閉合骨折靶點的韋恩圖Figure 3 Venn diagram of targets related with Radix Angelicae Sinensis-Rhizoma Drynariae and closed fracture

圖4 當歸-骨碎補對閉合骨折作用靶點蛋白的互作網絡Figure 4 Interaction network of target proteins of Radix Angelicae Sinensis-Rhizoma Drynariae for closed fracture
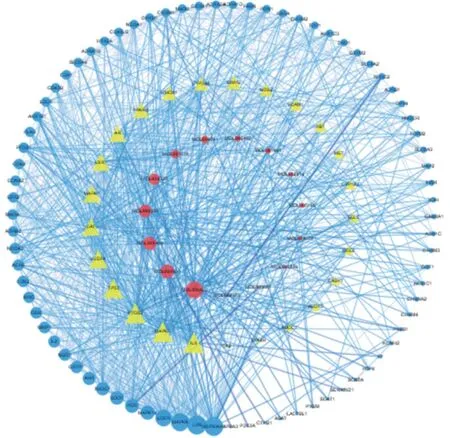
圖5 當歸-骨碎化合物-靶點-閉合骨折網絡圖Figure 5 Radix Angelicae Sinensis-Rhizoma Drynariae constituent-target-closed fracture network
2.4 當歸-骨碎補對閉合骨折作用靶點的京都基因與基因組百科全書(KEGG)分析和基因本體論(GO)分析將當歸-骨碎補對閉合骨折的25個作用靶點上傳ClueGO插件中進行GO分析,GO分析注釋圖見圖6~8。得出111個生物學過程(biological process,BP),包括:對雌激素的反應(response to estrogen),對缺氧的反應(response to hypoxia),轉錄的正調節,NDA模板化(positive regulation of transcription,DNA-templated),細胞對缺氧的反應(cellular response to hypoxia)等;19個細胞組成(cellular component,CC),包括細胞膜穴樣內陷(caveola)、細胞外空隙(extracellular space)、細胞質(cytosol)等。24個分子功能(molecular function,MF),包括:酶結合(enzyme binding)、血紅素結合(heme binding)、轉錄因子逆結合(transcription factor binding)、相同的蛋白結合(identical protein binding)等。KEGG通路富集分析發現,當歸-骨碎補作用于閉合骨折的靶點的通路有51條,主要包括:癌 癥 通 路(pathways in cancer)、膀 胱癌(bladder cancer)、低氧誘導因 子1信號通路(HIF-1 signaling pathway)、腫瘤壞死因子信號通路(TNF signaling pathway)、磷脂酰肌醇-3-激酶/蛋白激酶B信號通路(PI3K/Akt signaling pathway)、血管內皮生長因子(VEGF)信號通路(VEGF signaling patway)等等,見圖9。
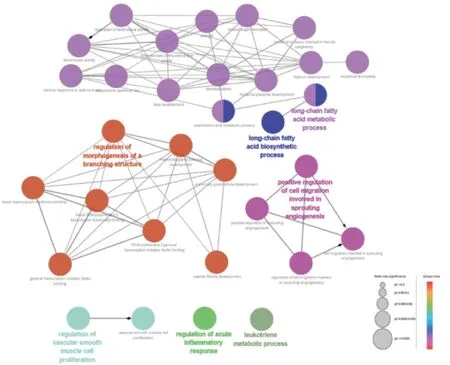
圖6 當歸-骨碎補對閉合骨折作用靶點的GO分析Figure 6 GO analysis results for the targets of Radix Angelicae Sinensis-Rhizoma Drynariae for closed fracture

圖7 當歸-骨碎補對閉合骨折作用靶點的GO分析結果(P<0.05)Figure 7 GO analysis results for the targets of Radix Angelicae Sinensis-Rhizoma Drynariae for closed fracture(P<0.05)

圖8 當歸-骨碎補治療閉合骨折靶點的GO分析結果餅狀圖(P<0.05)Figure 8 Pie chart of targets of Radix Angelicae Sinensis-Rhizoma Drynariae for closed fracture by GO analysis(P<0.05)

圖9 當歸-骨碎補對閉合骨折作用靶點的KEGG分析的氣泡圖Figure 9 Bubble diagram for targets of Radix Angelicae Sinensis-Rhizoma Drynariae for closed fracture by KEGG analysis
3 討論
骨折屬于中醫學“骨折病”的范疇。《正體類要》指出:“肢體損傷外,則氣血傷于內,營衛有所不貫,臟腑由之不和。”開創了“氣血學說”和“平補法”的理論基礎,主張以補氣血、活血、補肝腎為主的治法。當歸-骨碎補作為骨折三期辨證中期治療常用的藥物配伍,其臨床療效肯定。現代藥理學研究證實,當歸具有抗凝血、止血[7],改善血液循環[8],促進造血[9]的作用;骨碎補具有促進成骨細胞生成[10]、礦化[11],促進骨折愈合[12]的作用。但目前國內對當歸、骨碎補促進骨折愈合機制的研究多局限在當歸多糖、當歸提取物,骨碎補總黃酮[13-14]、骨碎補提取物這一類化合物,且對當歸-骨碎補在骨折愈合的體內代謝作用機制研究鮮見。故本研究通過網絡藥理學對當歸-骨碎補配伍治療骨折三期辨證中期的機制進行可能性推斷。
本研究篩選最后得到當歸2個、骨碎補18個化合物。其中:β-谷甾醇(beta-sitosterol)可能通過改變體外成骨活性而改善骨脆性和骨折形態[15]。山柰酚(kaempferol)能抑制破骨細胞分化并促進其凋亡,促進骨細胞樣MG-63細胞系的分化,并減弱TNF在MC3T3-E1小鼠成骨細胞系中的信號傳導[16],亦可通過促進成骨細胞功能和抑制骨髓中的脂肪細胞形成來預防去卵巢大鼠模型誘導的骨質流失[17]。柚皮素(naringenin)可作為超氧化物清除劑,有助于內源性抗氧化防御系統保護骨骼免受骨質疏松癥的侵害,而含有柚皮素的假蒟(Piper sarmentosum)的提取物則具有抑制脂肪組織和骨中11β-羥基類固醇脫氫酶1(11β-HSD1)表達和活性能力,從而恢復骨骼結構和強度[18]。木犀草素(luteolin)可以通過促進糖皮質激素誘導的骨質疏松癥中的成骨細胞分化、礦化和增殖來增加骨形成,其通過抑制活性氧(ROS)的過度生成來抑制成骨細胞增殖,增強成骨標志物的表達以促進成骨細胞分化和增加骨保護素(OPG)/核因子κB受體活化因子配體(RANKL)比率以維持骨量,從而減弱成骨細胞凋亡。此外,木犀草素可增強OPG/RANKL比率和成骨細胞分化減輕糖皮質激素誘導的骨質疏松癥[19]。本研究分析結果表明,當歸-骨碎補化合物主要以甾醇類、黃酮類為主,且與目前現有研究結果一致。此外,還包括黃烷酮類(flavanones)、固醇類(stigmasterols)、海州骨碎補苷(marioside_qt)等。
對當歸-骨碎補對閉合骨折的25個作用靶點進行GO分析,涉及111個生物學過程、19個細胞組成、24個分子功能。KEGG通路富集發現當歸-骨碎補作用于閉合骨折的通路有51條,主要明確涉及HIF-1信號通路、TNF信號通路、PI3K/Akt信號通路、VEGF信號通路等。氧供是影響骨折愈合的重要因素,HIF-1在調節氧穩態中起關鍵作用,研究[20]發現,缺氧條件下MC3T3-E1小鼠成骨細胞活力下降,HIF-1α蛋白表達增加,HIF-1α轉染的MC3T3-E1細胞的存活率高于未強制表達HIF-1α的細胞,HIF-1α在MC3T3-E1細胞系中的強制表達通過抑制細胞凋亡減弱了缺氧誘導的成骨細胞活力下降。TNF-α在干細胞向成骨分化過程中扮演著雙重角色(促進或抑制成骨分化),而TNF-α的作用時間,作用濃度及作用的干細胞類型又可能是決定其促進或抑制干細胞成骨分化的主要因素[21]。PI3K/Akt信號通路是調節細胞增殖、分化、存活、遷移和代謝過程的最為重要的一個信號通路。越來越多的證據表明,骨組織中的許多信號分子能夠選擇性激活PI3K/Akt信號通路的相關基因,通過調控成骨細胞和破骨細胞的活動,破壞骨重建過程中骨形成與骨吸收的動態平衡[22]。miR-28-3p可以通過活化PI3K/Akt信號途徑而加速骨折愈合過程[23]。miR-181a/b-1通過調節第10號染色體缺失的磷酸酶及張力蛋白同源物基因(PTEN)/PI3K/Akt軸和線粒體代謝促進骨生成[24]。VEGF是一種重要的信號蛋白,參與血管生成(胚胎循環系統的新生形成)和血管生成(從已存在的血管系統中生長血管)。研究[25]表明,骨碎補可通過激活VEGF/VEGFRs的表達,促進骨折愈合。早期骨質疏松細胞(Osterix+)的VEGFA,但不是成熟的成骨細胞/骨細胞(Dmp1+),對于快速骨膜血管生成和編織骨形成的骨損傷時至關重要。而在損傷時需要來自另一種細胞來源而非來自成骨細胞譜系的VEGFA,以獲得最大的皮質缺損髓內血管生成和骨生成[26]。因此,預測當歸-骨碎補可能通過調控HIF-1、TNF、PI3K/Akt、VEGF等信號通路促進骨折三期辨證中期的愈合。
綜上所述,本研究以當歸-骨碎補主要活性成分為研究對象,借助網絡藥理學方法,通過分析其主要的活性成分,構建“化合物-靶向-疾病”的關系,初步在分子層面展示了當歸-骨碎補作用于骨折三期辨證中期的機制,且大部分預測結果與現代藥理學研究相符,為科學用藥提供了指導;然而,本研究僅在分子水平初步預測當歸-骨碎補的作用機制,缺乏入血移行成分預測,且缺乏藥物相互作用機制研究,具有一定的局限性,因此,有待進一步加以理論完善以及實驗驗證。

