進水亞硝氮限制下Anammox去除氨氮研究
牛晚霞,袁林江,有小龍,牛澤棟 (西安建筑科技大學,陜西省環境工程重點實驗室,西北水資源與環境生態教育部重點實驗室,陜西 西安 710055)
與傳統生物脫氮技術相比,厭氧氨氧化(Anammox)因不需要曝氣、不需要有機碳源、污泥產量低等明顯優勢,被公認是一種效率高、能耗低的生物脫氮處理技術[1-3].相關研究[4]提出Anammox反應中氨氮去除量與亞硝氮去除量以及硝氮產生量之間(ΔNH4+-N/ΔNO2--N/ΔNO3--N)的理論比值為1:1.32:0.26.由 于 AnAOB(Anaerobic ammonium oxidation bacteria)很難進行純培養,當 Anammox體系中存在異養型亞硝酸鹽氧化菌或反硝化菌時,利用微生物內碳源消耗部分亞硝氮,使 ΔNO2--N/ΔNH4+-N大于1.32[5].然而,有許多Anammox研究[6-8]得到ΔNO2--N/ΔNH4+-N小于1.32,即氨氮被超量去除.且當進水中亞硝氮供給比例減少時,Anammox反應器會出現氨氮相對更多的去除[9].
在 Anammox體系中通過研究氨氮和硫酸鹽轉化途徑時發現在NO2-缺失且 SO42-未被去除的情況下,NH4+就能穩定去除,認為該體系中氨氮的去除存在其他未知的電子受體[10].有研究[11]根據Anammox化學模型,從化學平衡移動的角度對此進行了分析,但對其中微生物機理尚不清楚.減少進水NO2--N進行厭氧氨氧化脫氮,可減少廢水中亞硝化過程、且還能保證廢水中氨態氮的去除量,對污水脫氮處理具有重要實用價值.
本研究設計了一系列批式實驗,探究了Anammox反應器中氨氮超量去除方式以及超量去除氨氮量的限制性因素,同時結合微生物菌群解析對氨氮去除的代謝途徑進行分析,旨在為厭氧氨氧化直接脫除水中氨態氮技術開發奠定基礎.
1 材料與方法
1.1 反應器實驗裝置及進水水質
實驗采用有機玻璃制作的 UASB反應器(圖1),有效體積 6.28L,總體積10.5L.反應器內側柱高114.4cm,直徑100mm,壁厚5mm,外側為32℃水浴保溫層,厚 10mm;在保溫層外包裹鋁箔紙進行隔光,進水由蠕動泵打入反應器底部.實驗開始前,該反應器在室溫條件下饑餓放置 120d后提供基質短期恢復為氮去除負荷達 1.3kgN/(m3?d)并穩定運行.
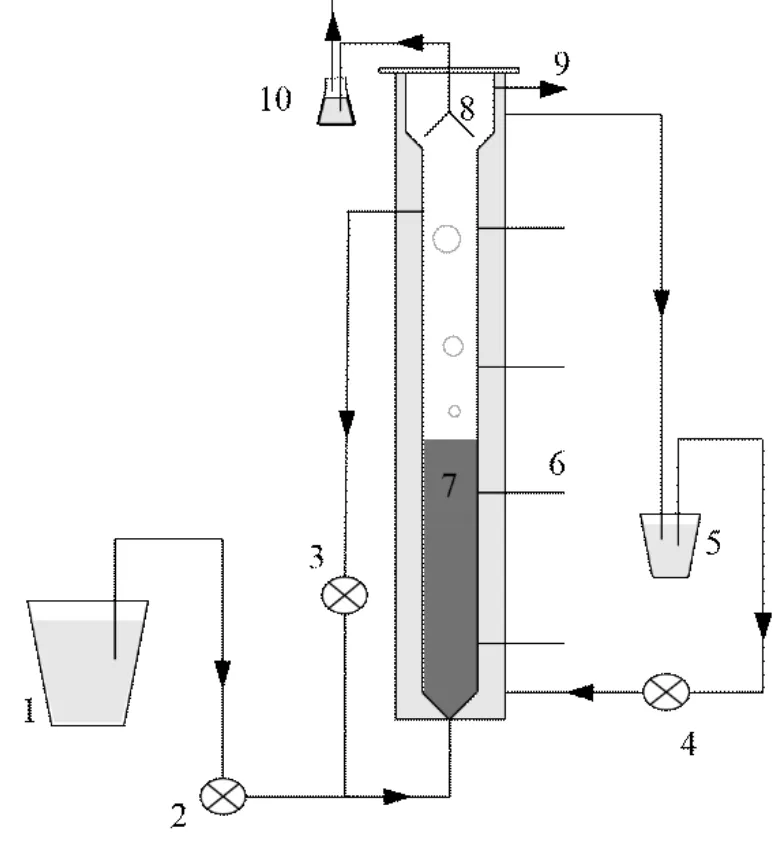
圖1 Anammox-UASB裝置示意Fig.1 Schematic diagram of the Anammox-UASB reactor
實驗采用人工配制進水,配水成分為:KHCO31250mg/L,KH2PO427.2mg/L,MgCL2·6H2O 165mg/L,CaCl2·2H2O 250mg/L,微量元素Ⅰ 1mL/L,微量元素Ⅱ 2mL/L,NH4+-N和NO2--N分別以NH4Cl、NaNO2按需提供,SO42-由 Na2SO4提供,投加濃度為342.3mg/L.各階段主要進水基質如表 1所示.利用1mol/L的HCl調節pH值為(7.5±0.2),水力停留時間(HRT)為20h.
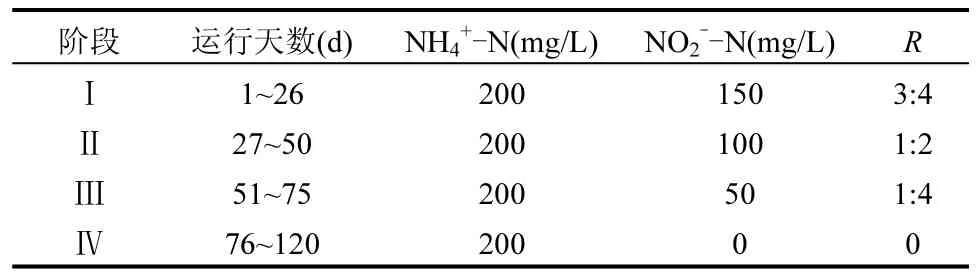
表1 各階段主要進水基質Table 1 Components of influent
1.2 批式實驗裝置及運行條件
據實驗需求,在反應器的不同階段,從反應器中分別取10mL泥水混合物倒入50mL離心管,用磷酸鹽緩沖溶液(PBS)洗滌2~3次,然后將清洗后的污泥和120mL配制好的基質(基質提前曝高純氮氣除氧20min),倒入總容積為 130mL的血清瓶,后利用高純氮氣對血清瓶中泥水進行除氧5min,將其密閉后置于恒溫振蕩器(150r/min,35℃)進行反應.在驗證Fe3+與氨氮超量去除的關系時,主要基質為NH4+,取樣間隔為 12h;驗證內碳源反硝化與氨氮超量去除的關系時,主要基質為 NH4+和 NO3-,每隔 24h取一次樣;驗證DO與氨氮超量去除的關系時,主要基質為 NH4+,每隔 24h取一次樣.其他配水元素與反應器進水相同.
為提高實驗代表性,批式實驗均設 3組平行.為保證血清瓶內厭氧環境,每次用注滿氮氣的注射器取樣,且平行組取樣體積保持一致.取樣后用0.22μm有機濾頭過濾后測定相關指標.
1.3 分析方法
常規指標的測試方法參考《水和廢水監測分析方法》[12]:pH值采用PHS-3S型pH計測定;DO采用MO128-2M型便攜式溶解氧儀測定;硝酸鹽氮采用紫外分光光度法和離子色譜法;亞硝酸鹽氮采用N-(1-萘基)-乙二胺光度法;氨氮采用納氏試劑分光光度法;硫酸鹽采用 ICS1100離子色譜儀;總鐵采用火焰原子吸收法.
污泥微生物群落結構分析采用基于 Illumina MiSeq測序平臺的細菌16S rDNA高通量測序技術.測序流程包括微生物總DNA 提取、目標片段 PCR擴增、擴增產物回收純化、擴增產物熒光定量、MiSeq文庫構建和MiSeq測序[13-14].其中PCR 擴增采用的引物為Miseq測序平臺的V3-V4通用引物341F(5’-CCTACGGGNGGCWG-CAG-3’)和 805R(5’-GACTACHVGGGTATCTAATCC-3’).Miseq 測序得到的PE reads首先根據overlap關系進行拼接,同時對序列質量進行質控和過濾,區分樣本后進行OUT聚類分析和物種分類學分析.以上工作均由生工生物工程(上海)股份有限公司完成.
2 結果與討論
2.1 不同亞硝氮濃度供給條件下Anammox反應器運行特性
2.1.1 氨氮、亞硝氮及硝氮變化規律 階段Ⅰ~Ⅰ逐步減小 R(降低進水亞硝氮濃度)條件下,反應器氨氮、亞硝氮及硝氮變化情況如圖2所示.階段Ⅰ投加NH4+-N為200mg/L,R為3:4,氨氮平均去除率為81%,亞硝氮去除率始終接近 100%,硝氮平均產生量為30.8mg/L.階段Ⅱ保持 NH4+-N濃度不變,調整 R為1:2,此時氨氮平均去除率為 74.2%,亞硝氮依然沒有剩余,硝氮平均產生量為 17.7mg/L.階段Ⅲ繼續減小R為1:4,氨氮平均去除率為45.2%,出水檢測到極少量亞硝氮,硝氮平均產生量為6.6mg/L.階段Ⅰ對反、應器停供亞硝氮,R=0,連續運行了 45d,停供亞硝氮后氨氮仍有去除,平均去除率為 22.5%,出水監測到少量的亞硝氮,無硝氮產生.從階段Ⅰ至階段Ⅰ,隨進水NO2-濃度的降低,氨氮去除率由81%降至22.5%.因為較低濃度的亞硝氮不會對Anammox系統造成毒性抑制,故氨氮去除率降低是由于電子受體的減少.Jetten等[15]指出厭氧氨氧化過程中產生少量的硝氮,因此,硝氮的產量在一定程度上反映了反應器內厭氧氨氧化反應的情況.隨進水 NO2-濃度的降低,硝氮產量從 30.8mg/L最后降至 0,說明厭氧氨氧化反應越來越弱.
2.1.2 Anammox反應化學計量比及 pH值變化規律 反應器中 ΔNH4+-N/ΔNO2--N,ΔNH4+-N/ΔNO3--N值對系統中厭氧氨氧化反應以及其它反應可能性的程度具有指導意義.逐步降低進水亞硝氮濃度條件下,如圖 3(a)所示,當 R 為 3:4 時,ΔNO2--N/ΔNH4+-N平均比值為0.96;當R為1:2時,ΔNO2--N/ΔNH4+-N平均比值為 0.76;當 R為 1:4時,ΔNO2--N/ΔNH4+-N平均比值為 0.58.可見 ΔNO2--N/ΔNH4+-N 均小于厭氧氨氧化理論值1.32,說明氨氮實際去除量大于厭氧氨氧化反應理論去除量,即存在氨氮超量去除現象[7,16-17].圖 2(c)顯示了硝態氮實際產生量與理論產生量之間的差異,階段Ⅰ到階段Ⅲ,硝態氮實際產量平均值分別為 30.77,17.7,6.62mg/L,而根據厭氧氨氧化反應理論比值衡算硝態氮理論產量平均值分別為32.26,20.7,10.48mg/L,可見硝態氮實際產生量均小于理論產生量.此外,由圖 3(a)可知,從階段Ⅰ到Ⅲ,ΔNO3--N/ ΔNH4+-N 平均值分別為0.18、0.13、0.07,隨 R的降低而減小,且均小于厭氧氨氧化理論值0.26.造成這種現象的原因除了氨氮超量去除,還有另一種可能是厭氧氨氧化生成的硝態氮被部分消耗,這與硝態氮實際產量總是小于理論產量相吻合,說明反應器內存在某種消耗硝態氮的反應.
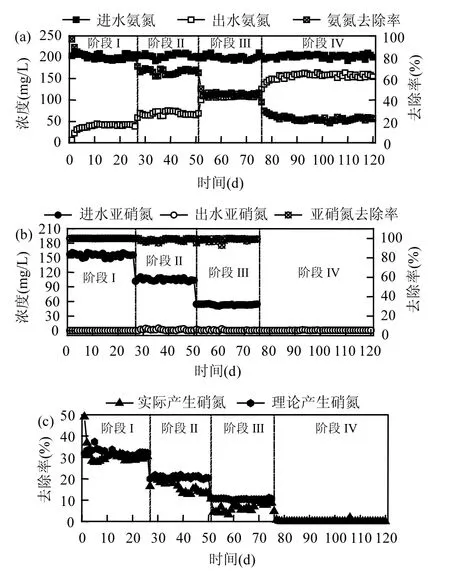
圖2 限NO2-厭氧氨氧化反應器運行狀況Fig.2 Performance of Anammox reactor with less nitrite
降低進水亞硝氮濃度過程中,反應器進出水 pH值變化如圖3(b)所示.階段Ⅰ初始,反應器出水pH值高于進水,從階段Ⅰ末至階段Ⅰ,出水 pH 值均低于進水.單純厭氧氨氧化反應是一個產堿的過程,而反應器出水pH值低于進水,可以判斷氨氮超量去除途徑是一個pH值降低的過程.

圖3 限NO2-厭氧氨氧化反應器ΔNO2--N/ΔNH4+-N,ΔNO3--N/ΔNH4+-N和進出水pH值變化Fig.3 ΔNO2--N/ΔNH4+-N,ΔNO3--N/ΔNH4+-N variation and pH value of Anammox reactor with less nitrite
2.2 氨氮超量去除的可能途徑
有研究在逐漸提高進水氨氮濃度且體系中始終供給亞硝氮條件下,出現的氨氮超量去除,認為氨氮過量供給使得 Anammox反應化學平衡向生成N2H4的方向移動,表現為Anammox體系對氨氮的額外吸納現象[11].而本研究中始終保持進水氨氮濃度一定、逐漸降低進水亞硝氮濃度直至停供亞硝氮,難以利用該化學平衡說來解釋氨氮的超量去除現象.
無機條件下,AnAOB除了利用最佳電子受體亞硝氮外,還會以SO42-為電子受體進行反應[18-19].但是本反應器長期投加 SO42-,并沒有 SO42-去除現象(圖4),這與劉福鑫[20]研究類似.因此,本研究中 NH4+的超量去除與 SO42-沒有明顯關系.Bi[10]通過對 NH4+和SO42-同時去除的轉化途徑研究認為Anammox過程不會以 SO42-為電子受體氧化氨,而是兩者各自獨立轉化.
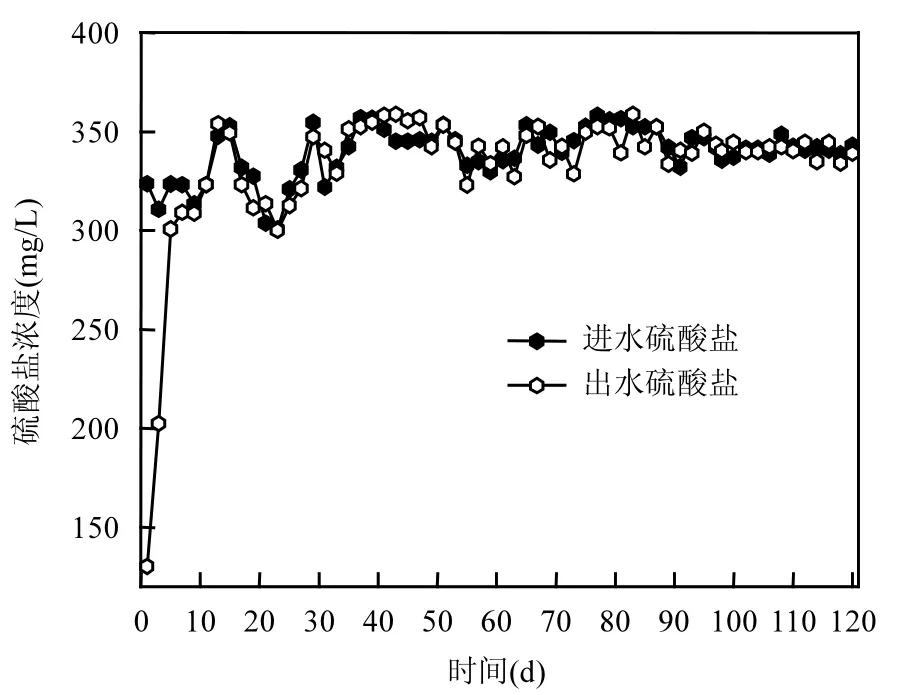
圖4 反應器進出水硫酸鹽濃度Fig.4 SO42- concentrations in effluent and influent
由于本反應器進水未采取除氧措施,故進水中向系統中引入少量的 DO(進水 DO約 8mg/L),為了驗證進水 DO對氨氮超量去除的影響,保持其它條件不變,從 85d開始對反應器進水進行曝氮氣除氧,使DO降至2mg/L以下,并將進水桶密封防止進水復氧,連續 10d對進水除氧發現氨氮去除量并未發生明顯變化,這與嚴鋒[21]研究結果相同.經計算 6mg/L的DO僅能氧化1.75mg/L的NH4+-N,因此,進水中DO遠不足以去除如此多的氨氮.故必然存在其他的電子受體參與氨氮的超量去除.
2.3 氨氮超量去除的轉化方式
2.3.1 Fe3+與氨氮超量去除關系 研究表明,亞硝氮缺乏時,Fe3+可以作為電子受體被 AnAOB利用[22-23],由于微生物自身細胞含有 0.02%的鐵元素[24].從反應器取適量污泥測定總鐵,發現污泥中的鐵含量(0.43mg/gVSS)不足以引起氨氮的超量去除.并且研究發現AnAOB體內的鐵對其氮代謝途徑無顯著影響[25-26].由于配水中加入的微量元素Ⅰ也含有鐵鹽,推測此類物質參與了氨氮的超量氧化.故設計批式實驗驗證配水中微量元素Ⅰ中Fe3+是否參與了氨氮的超量氧化.
研究認為[27]Fe3+投加量為 0.08mmol/L時,反應器氮去除性能最好,而本研究微量元素Ⅰ中 Fe3+濃度為 0.02mmol/L.因此設置對照實驗,確定 B組加4.48mL/L微量元素Ⅰ,A組不加微量元素Ⅰ,兩組實驗主要基質為氨氮.由圖 5可知,前 24h,A組氨氮從44.4mg/L降至 37.7mg/L,B組從 45.2mg/L降至34.8mg/L,在12h監測到A、B兩組亞硝氮積累量分別為0.02,0.05mg/L,硝氮積累量分別為2.5, 1.6mg/L.24h至實驗結束,A、B組氨氮含量均未發生下降,實驗結束時測得 A、B組氨氮濃度分別為 35.4和34.6mg/L.雖然B組下降較快,但與A組相比,實驗結束時 B組沒有去除更多的氨氮,說明本研究中氨氮的超量去除與鐵沒有明顯相關關系.研究報道[28-29]在厭氧環境下 Fe3+還原氨氧化的現象,而本研究未發現 Fe3+參與氨氮的氧化現象,可能是由于實驗條件的不同,有待于進一步研究.

圖5 Fe3+與氨氮超量去除關系Fig.5 The relationship between Fe3+ and excess removal of ammonium
2.3.2 內碳源反硝化以及與氨氮超量去除之間的關系 對于反應器中可能存在消耗硝酸鹽的反應的問題,設計批式實驗探究反應器中是否存在內碳源反硝化.如圖 6(a)所示,經 48h反應,硝酸鹽濃度從39.6mg/L降至 34.3mg/L,同時檢測到2.8mg/L亞硝氮,pH值從7.51升至7.81.
早有 Graaf[30]發現硝酸鹽作為間接電子受體與氨氮同步去除.由圖 6(b)可知,氨氮和硝氮均勻下降,氨氮由71.25mg/L降至38.77mg/L,硝氮由54.17mg/L降至 11.13mg/L,整個過程未監測到亞硝氮,實驗結束體系pH值為8.2,高于初始pH值.

圖6 內碳源反硝化與氨氮超量去除之間的關系Fig.6 The relationship between endogenous denitrification and excess removal of ammonium
Waki等[31]認為AnAOB不能直接以NH4+-N和NO3--N作為電子供受體,要使其順利進行,需要在其他電子供體存在的條件下將NO3--N還原為NO2--N后,進行緩慢的 Anammox反應.該批式實驗中氨氮與硝酸鹽同步去除,這是由于Anammox反應器內存在少量的反硝化菌[32],無機條件下,異養反硝化菌會利用有限的內碳源將Anammox過程產生的硝酸鹽部分還原為亞硝酸鹽[33],從而與氨氮發生Anammox反應.亞硝酸鹽是 Anammox最適合的電子受體,能夠與氨氮在短暫的時間內完全反應[34],這為系統中未監測到亞硝氮提供了依據.由于缺乏碳源,硝酸鹽還原為亞硝酸鹽過程緩慢,內碳源反硝化過程為氨氮的超量去除提供了一種理論依據.
2.3.3 氨氮超量去除的限制性因素 為了進一步探究氨氮超量去除的原因,只投加氨氮進行批式實驗.如圖 7所示,初始氨氮濃度為 48.21mg/L,前 24h氨氮降低了13.62mg/L,有少量的亞硝氮和硝氮產生,24~72h氨氮濃度穩定在 35.17mg/L左右,未監測到亞硝氮和硝氮.72h時向系統注入約10mL空氣,96h氨氮濃度為 20.24mg/L,同時檢測到 4.03mg/L的亞硝氮和2.24mg/L的硝氮,pH值從7.6降至7.29.

圖7 溶解氧與氨氮超量去除的關系Fig.7 The relationship between dissolved oxygen and excess removal of ammonium
前 24h,氨氮濃度下降,緊接著又保持不變,說明反應體系中某種物質含量有限.而向系統注入空氣后發現氨氮濃度迅速降低,足以說明氨氮的去除與DO有關,認為Anammox體系中存在AOB參與了氨氮的超量去除.將 DO 和氮去除之間關系衡算,系統總氮損失量為 0.61mmol/L,假定總氮都通過厭氧氨氧化方式去除,通過式(1)計算得所需的氨氮、亞硝氮及通過該步驟產生的硝氮含量分別為 0.3,0.39,0.08mmol/L;假定Anammox所需的亞硝氮和反應體系剩余的亞硝氮均由亞硝化所得,通過式(2)計算出該亞硝化過程所需氧氣的量為 1.02mmol/L;根據反應體系共產生硝氮的量,得知 0.083mmol/L的硝氮由硝化過程產生,通過式(3)可得該過程所需氧氣量為0.17mmol/L.故實驗共需氧氣量為1.19mmol/L,通過血清瓶中剩余溶液體積(以 80mL計)換算得3.04mg的氧氣,再根據氧氣質量分數及實驗溫度下空氣密度(25℃.1.184mg/mL)計算出實驗所需空氣量為 11.15mL,接近于注入的 10mL空氣.因此,該批式實驗中氨氮是通過AOB和AnAOB共同去除的.

前文已經證實反應器進水中DO的量不足以去除反應器中氨氮超量去除的量,但批式實驗說明氨氮的去除必與氧氣有關,故存在其它 DO滲入反應器的途徑.UASB回流過程會把部分帶有DO的出水重新帶到反應器底部,同時回流過程會造成三相分離器空間變化引起內外氣壓差,使得外界空氣更容易進入反應器[35].
除了以上原因,還有報道稱[36-37]微生物代謝過程能夠產生活性氧類物質,形成超氧自由基(O2-)和羥基自由基(OH?),在缺乏亞硝氮的Anammox反應器中,微生物抑制或腐爛過程同樣釋放出 OH?等氧化劑,這些自由基也是氨氮超量氧化的潛在電子受體來源[38].甚至有研究[20]認為亞硝氮缺乏時,HCO3-作為電子受體氧化了氨氮,NH4+和 HCO3-之間發生的是生物反應.但這些報道只是理論推測,還需進一步研究.
2.4 污泥微生物菌群解析
反應器中氮素的脫除是微生物作用的結果,通過高通量測序進行微生物群落結構的解析能夠更進一步對氨氮去除的代謝途徑進行預測分析.分別在 R為3:4運行末期和停供亞硝氮后運行45d從反應器取2個污泥樣品,分別記為A2、A4,進行高通量測序.如表2所示,兩個樣本的Coverage指數均為 100%,說明測序結果足夠代表樣本中的微生物群落組成.ACE和Chao指數[39]均有所增大,說明從進水供少量亞硝氮階段到停供亞硝氮階段,物種總數在增多.Simpson指數越大,說明優勢菌群占總體生物菌群比例越大[40];Shannon[41-42]指數越高,群落復雜程度越大.停供亞硝氮后微生物多樣性在增加,說明停供亞硝氮后氨氮的去除需要更多類型的微生物共同完成.
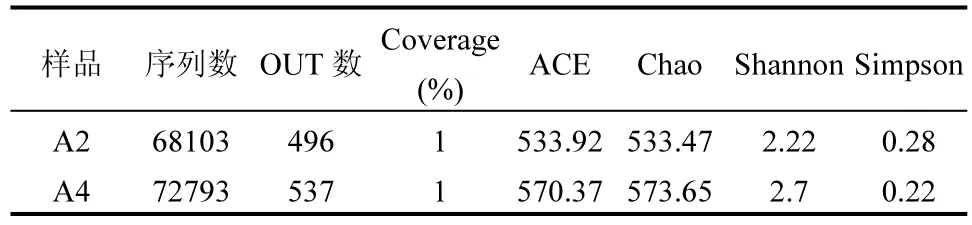
表2 污泥樣品Alpha多樣性Table 2 Alpha diversity of the two samples
利用高通量測序技術分別考察了反應器 R為3:4和停供亞硝氮兩個階段污泥在屬水平上的微生物菌群結構,如圖8所示,在限亞硝氮和停供亞硝氮2個階段微生物群落中,厭氧氨氧化菌、好氧氨氧化菌、反硝化菌和亞硝酸鹽氧化菌同時存在.Anammox體系中停供亞硝氮前后亞硝化單胞菌屬(Nitrosomonas)相對豐度從 3.29%增長到 7.3%,雖然Anammox體系為厭氧環境,但Nitrosomonas被認為是需氧氧化銨[43],說明反應器內部確實存在外界氧氣滲入的可能,這與2.3.3討論相吻合.檢測到的反硝化菌屬主要為Ignavibacterium,其相對豐度由0.54%增加到 3.14%, Ignavibacterium能夠利用細菌衰老和死亡的細胞產物進行厭氧發酵和反硝化作用[44].
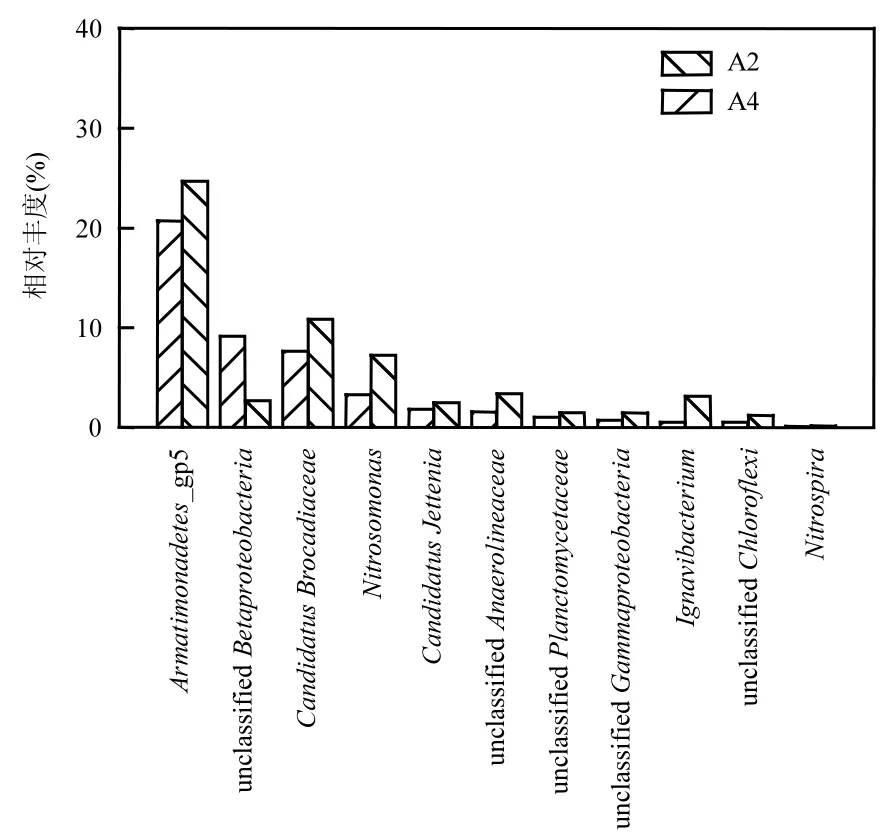
圖8 NO2--N/NH4+-N為3:4和停供亞硝氮2階段主要脫氮細菌(屬)組成變化Fig.8 Microbial community for nitrogen removal in the reactor NO2--N/NH4+-N is 3:4 and after no feeding of nitrite
停供亞硝氮后Candidatus_Brocadiaceae屬有所增長,相對豐度由 7.67%增長到 10.83%,而Candidatus_Jettenia屬無明顯變化,這是由于氨氧化菌將部分氨氮氧化為亞硝氮,反硝化菌將部分硝酸鹽還原為亞硝氮,為AnAOB供應了極少量的亞硝氮,說明Candidatus_Brocadiaceae能夠適應極低亞硝氮環境并生長繁殖,Candidatus_Jettenia也能夠在此環境中生存.反應器從 R為 3:4到停供亞硝氮階段,Armatimonadetes_gp5相對豐度由 20.7%增長到24.6%,Mi等[45]認為Armatimonadetes_gp5是一種適合在低氨氮濃度下生存的新型厭氧氨氧化菌.兩個污泥樣品中還檢測到極少量的亞硝酸鹽氧化菌屬(Nitrospira),約占總細菌的0.1%,Nitrospira未增長說明不適合在該環境中生長.
不管是反應器R為3:4還是停供亞硝氮,超量去除的這部分氨氮均由氨氧化菌、厭氧氨氧化菌和反硝化菌共同完成.主要有兩種途徑:一是在微量 DO的作用下,氨氧化菌將部分氨氮氧化為亞硝氮,AnAOB再將該部分亞硝氮與剩余的氨氮去除;二是Anammox產生的硝氮有一部分被反硝化菌經內碳源反硝化作用還原為亞硝氮,該部分亞硝氮與體系中其余的氨氮也通過Anammox作用去除.
2.5 反應器中氨氮超量去除量變化規律
由圖9可知,從階段Ⅰ到階段Ⅰ,當R為3:4時,超量去除氨氮量均值為45.5mg/L;當R為1:2時,均值為 57.2mg/L;而當 R為 1:4時,其均值為 52mg/L;當R為0時,均值為45.5mg/L.可見,當R從3:4減小為1:2時,超量去除氨氮的量有所增加;而當R從1:2降至 0時,超量去除氨氮的量緩慢減少;當 R為 1:2時,超量去除氨氮的量最大.

圖9 限NO2-厭氧氨氧化反應器氨氮超量去除量Fig.9 Excess removal of ammonium in the Anammox reactor with less nitrite
由前文可知,氨氧化菌在氨氮超量去除中起著關鍵的作用.階段Ⅰ(R為 3:4)進水亞硝氮濃度為150mg/L,污泥層的亞硝酸鹽濃度較高可能會對氨氧化菌活性造成抑制,氨氧化速率較低,使得氨氮超量去除量較低.而R小于1:2時,反應器中厭氧氨氧化菌可利用的基質已相對較少,反應器中氮的去除主要由氨氧化協同厭氧氨氧化菌完成,由于Anammox過程產生的堿度已相對較少,體系中 pH值下降較多(圖 3b).并且,通過數據核算了各階段穩定后硝酸鹽實際生成量與理論生成量的差值(圖 2c),在 R等于3:4(17~27d穩定)時為1mg/L,在R等于1:2時(39~50d穩定)為 6.7mg/L,在 R等于 1:4時(65~75d穩定)為2.7mg/L,而在不投加亞硝酸鹽后,以亞硝酸鹽計的硝酸鹽生成量降低為0.可推測反硝化菌在各階段所起作用的程度大小,在R等于1:2時硝酸鹽實際生成量與理論生成量的差值最大.所以本文在R等于1:2時氨氮超量去除量達最大.
3 結論
3.1 當 Anammox體系中進水 R(NO2--N/NH4+-N)由理論比值1.32減小為1:2時,氨氮超量去除量增加;而當R由1:2減小至1:4時,氨氮超量去除量保持穩定.當R為1:2時,氨氮超量去除量最大,為57.2mg/L.批式實驗證明溶解氧是氨氮超量去除量的限制性因素.
3.2 當 Anammox體系長期停供亞硝氮時,氨氮依然得以脫除且 SO42-并未去除,無證據表明本Anammox體系能夠利用硫酸鹽為電子受體氧化氨氮.此外,停供亞硝氮后 Anammox體系中微生物群落多樣性有所增加,AnAOB、氨氧化菌(Nitrosomonas)和反硝化菌(Ignavibacterium)相對豐度均增加,氨氧化菌在微量 DO作用下將部分氨氮氧化為亞硝氮,AnAOB將與之協同實現氮的去除.Candidatus Jettenia屬和Candidatus Brocadia屬都能夠在亞硝氮缺失的條件下進行氮的脫除.
3.3 本Anammox體系中氨氮超量去除的途徑包括好氧氨氧化、Anammox與部分異養反硝化.參與上述生化反應的微生物有氨氧化菌、厭氧氨氧化菌和反硝化菌.

