流態變化對污水管網沉積污染物分布及轉化的影響
石 烜,田嘉盟,任 博,高 歌,金 鑫,王曉昌,金鵬康 (西安建筑科技大學環境與市政工程學院,陜西 西安 710055)
城市污水中攜帶有豐富的顆粒態污染物質,在污水管網輸送過程中受重力作用會逐漸沉積于管道底部形成沉積層,帶來的管道淤積是制約污水管網實現污水輸送的重要因素[1-3].同時沉積層中的污染物質為微生物繁衍增殖的環境基礎,其中厭氧微生物代謝產生了大量的甲烷、硫化氫等有毒有害氣體,顯著威脅了管網的安全運行[4-5].
在污水管網系統長時間、遠距離的輸送過程中,污水流態對沉積層的沖刷沉積以及微生物的生化作用對系統中碳、氮、硫類污染物質含量的變化產生重要的影響.研究表明,污水管道內復雜的水流運動會對顆粒態污染物輸移產生較強的滯留作用,同時影響污水管道的正常運行[6].隨著流速的增加,水流沖刷強度加大,污水中吸附在大顆粒上的有機污染物占比顯著增加,而吸附在較小顆粒上的氮、磷類污染物占比減幅較小[7].研究發現[8],流經管道的污水水質發生了變化,SCOD濃度降低,且沉積物中微生物和污水中的微生物對其降解各占 60%和 40%.同時,受到污水沖刷,沉積層釋放污染物進入到水體中,會造成水體污染[9-11].
目前,有關污水管網的研究主要集中在污水與沉積物之間污染物質的轉化以及沉積沖刷模型[12-13]等方面,污水管網匯流點位是連接不同管段重要的組成部分,因其不同管道匯流所帶來的復雜水力作用,污染物在匯流區域會產生與管段內部不同沉積、轉化特性,但相關研究較少.本研究建立一套污水管網匯流管式反應器,模擬不同匯流流態下的城市污水管網運行狀態,探索匯流區域沉積污染物分布特征,利用微生物測序手段,研究不同匯流流態下以碳、氮、硫類污染物為基質進行代謝的功能性微生物繁衍特性,旨在為污水管網安全穩定運行提供參考.
1 材料與方法
1.1 實驗裝置及運行條件
城市污水匯流管道模擬反應器為管徑200mm的有機玻璃管,總有效長度16m,支管管徑100mm的有機玻璃管,總有效長度 8m,為了模擬實際污水管道重力式水流狀態,坡度均設置為5‰,干管轉彎處通過尺寸D×H為400mm×600mm的圓柱形檢查井連接,連接口均使用法蘭、橡膠圈密封,保證系統的密閉性,內部設有擋板為保證水流流態.每段模擬管段上均設有取樣點,便于觀察模擬管段內的水流狀態.由于系統體積較大,為保證其內部溫度恒定與抑制光照藻類生長,管道外部均包有20mm厚的保溫材料.
整個系統在室溫下運行,系統通過潛污泵將實驗用水提升至模擬管道系統的循環水箱,進行內循環模擬實際污水管網.實驗初期 100d,系統在干管、支管均為 0.2m/s的低流速狀態下運行,穩定沉積層生物相.之后每隔30d天轉變1次流態,前30d內,干管0.2m/s、支管0.2m/s(干低支低);運行30~60d,增大支管流量,干管 0.20m/s、支管 0.5m/s(干低支高);運行 60~80d,增大干管流量,干管0.5m/s、支管 0.2m/s(干高支低).
1.2 原水水質
城市污水匯流管道模擬反應器使用西安市第五污水處理廠進水作為原水,原水中所攜帶的顆粒態物質沉降可促使沉積層的形成.原水水質如下:固體懸浮物濃度 SS=(580±100)mg/L;揮發性懸浮物濃度 VSS=(390±70)mg/L;總化學需氧量 TCOD=(610±100)mg/L;溶解性化學需氧量SCOD=(270±50)mg/L;總氮 TN=(55±3)mg/L;氨氮 NH3-N=(34±8)mg/L;總磷=(7.3±0.6)mg/L;pH=7.0±0.5.
1.3 取樣方法
反應器共設 4個取樣點,分別位于干管距匯流口2m處、支管距匯流口1m處、匯流口、匯流口后2m處,在每一運行周期沉積層生物相繁殖穩定之后,選取固定取樣口采集沉積物樣品,每一取樣點取上、中、下3層沉積物,樣品取出后放入無菌培養皿中,送至實驗室-80℃超低溫冰箱保存,分別進行常規污染物、DO、ORP以及微生物的測試.
1.4 分析方法
1.4.1 DO、ORP分析方法 對系統污水中的 DO與ORP進行測定使用HQ30d便攜式測定儀(HACH.USA).沉積物中的 DO 與 ORP,使用微電極儀器(Unisense Denmark)進行檢測,各電極的頂端直徑均為 10μm.使用 N2吹脫后的超純水為基液,將沉積物樣品固定于尼龍網上保持靜止,將微電極自表層向內穿透沉積物分析其內部環境因子的變化[14].
1.4.2 常規污染物分析方法 常規水質指標TCOD、SCOD、TN、NH3-N、NO3-N、硫酸鹽、硫化物均采用國家標準方法測定[15].
1.4.3 微生物種群分析方法 微生物種群采用16S高通量測序分析,由北京諾禾致源生物信息科技有限公司依照以下步驟展開[16-18]:
(1)DNA提取與檢測:使用試劑盒提取樣品中的DNA之后,使用濃度為 1%的瓊脂糖凝膠電泳檢測所提取出來的DNA.
(2)PCR擴增:提前選定所需測序的區域,依據此合成特異性引物,PCR 檢測所選取 ABI GeneAmp?9700型的PCR儀器,每個DNA樣品設置兩個平行樣本,一共 3個重復樣本按照全部實驗步驟進行檢測分析,PCR擴增完成之后,將屬于各個樣本的重復 PCR產物進行混合,并使用瓊脂糖凝膠電泳進行跑帶操作,然后割膠回收不同樣本的 PCR產物,接下來使用Tris-HCl溶液進行洗脫;最后再使用2%濃度的瓊脂糖電泳進行驗證分析.
(3)Miseq文庫構建:使用PCR方法將接頭序列拼接到目標區域外端,然后接著使用凝膠回收試劑盒割膠回收PCR的產物,對回收的產物進行洗脫,使用瓊脂糖電泳進行檢測,最后進行氫氧化鈉變性過程,使目標DNA形成單鏈條的片段.
(4)Miseq測序:首先在DNA片段兩端加上序列已知的通用接頭構建文庫,文庫加載到測序芯片Flowcell上,文庫兩端的已知序列與Flowcell基底上的 Oligo序列互補,每條文庫片段都經過橋式 PCR擴增形成一個簇,測序時采用邊合成邊測序反應,即在堿基延伸過程中,每個循環反應只能延伸一個正確互補的堿基,根據 4種不同的熒光信號確認堿基種類,保證最終的核酸序列質量,經過多個循環后,完整讀取核酸序列.
2 結果與討論
2.1 不同匯流流速下管網沉積層內 DO、ORP的變化規律
由圖 1(a)可以看出,在沉積物表層,因與污水直接接觸,具有較強的好氧性,沿沉積層縱深的變化,逐漸由好氧轉變為厭氧狀態,以干管高流速、支管低流速下的狀態為例,在0,2,4cm的縱深處,DO含量分別為0.54,0.35,0.12mg/L.在干管、支管低流速的狀態下,表層 DO 含量最低,這是由于低流速狀態下,污水對沉積層的沖刷效果最弱,DO進入沉積層內部的含量最低,增加干管或支管流速后,表層 DO含量升高,其中干管高流速、支管低流速具有最高的表層含量,高達 0.54mg/L.而在沉積層底部,由于致密沉積層的存在,阻礙了溶解氧的滲透作用,不同匯流流速下,溶解氧沒有顯著的差異,僅有0.03~0.12mg/L.
如圖 1(b)所示,在上層水體自然復氧狀態下從沉積層上層至最下層,不同深度沉積層 ORP數值不斷下降.其中,3種匯流流態下沉積層表面 ORP為-63~-29mV,處于弱還原狀態;而在沉積物底層處,沉積層的ORP為-289~-221mV,處于強還原狀態,此區域也是厭氧硫酸鹽被還原的位置,在此處有大量的硫化氫、硫化物產生.同時,可以看到在干管、支管低流速的狀態下,沉積物底層 ORP最低,為-289mV,這種狀態下沉積物中硫化物積累量最多.

圖1 不同流態下匯流區域后不同沉積層DO、ORP的變化趨勢Fig.1 Variation trend of DO and ORP of different sedimentary layers in confluence area under different flow patterns
2.2 不同匯流流速下管網沉積層污染物分布特性
如圖 2所示,隨著沉積層深度的變化,TCOD和SCOD均表現為持續下降的趨勢,以干管、支管低流速的匯流狀態為例,在沉積層表面、縱深 2cm 處、縱深 4cm處 TCOD的濃度分別為 13900~14800,10800~12500,9760~11300mg/g;SCOD的濃度分別為246~267,199~236,153~174mg/g.這是由于沉積物表層直接與污水相接觸,污水中的有機污染物質沉降到沉積層表面,而在沉積層內部受到污水的沖刷沉積作用較弱,TCOD、SCOD的濃度相對降低.且沉積層中微生物的生化作用也會對有機污染物起到一定的降解作用,但微生物的生化作用比物理沖刷沉降對污染物的含量影響可以忽略.增加干管或支管流速,污水沖刷作用增強,污染物顆粒沉降作用減弱,對應區域的TCOD、SCOD濃度均有所降低.
從圖2可以看出,TN濃度沿沉積層垂直方向呈現遞減趨勢,以干管、支管低流速的匯流狀態為例,在匯流點沉積層表面、縱深2cm處、縱深4cm處TN的濃度分別為201,154,127mg/g.這是由于沉積層表面的孔隙率更大,吸附污水中的氮類污染物的能力更強,隨著沉積層深度的增加,沉積層更加致密,孔隙率降低,吸收污染物的能力減弱.同時,增大管道流速,污水對沉積層的沖刷作用加強,更多的顆粒態污染物質從沉積層剝離進入污水中,TN的濃度在沉積層垂直方向變化較大.NH3-N、NO3-N來源于污水中原本攜帶的污染物質以及 TN降解轉化的產物,同樣受到污水的沖刷沉積作用而與TN具有在沉積層中類似的分布規律.

圖2 不同匯流流態下碳、氮、硫類污染物沿沉積層縱深的變化規律Fig.2 Variation rules of carbon, nitrogen and sulfur pollutants along the depth of sedimentary layer under different confluence flow patterns
由于污水的沖刷沉積作用,沿縱深方向沉積層中的硫酸鹽含量逐漸降低,以干管、支管低流速的匯流狀態為例,在匯流點沉積層表面、縱深 2cm處、縱深4cm處硫酸鹽的濃度分別為0.49,0.36,0.21mg/g,同時,管道流速的增大,也會加強污水的沖刷作用,硫酸鹽濃度進一步降低.而由于污水中原有硫化物的含量較低,沉降在沉積層表面的硫化物很少且硫酸鹽還原菌嚴格厭氧,在沉積層深處更有利于硫化物的產生,沿縱深方向沉積層中的硫化物含量逐漸升高,以干管、支管低流速的匯流狀態為例,在匯流點沉積層表面、2cm縱深處、4cm縱深處硫化物的濃度分別為0.57,0.68,0.94mg/g.
2.3 不同匯流流態下沉積層中微生物多樣性變化特征
利用匯流口后2m處沉積層生物相檢測到的種群數量(Observed species)反映不同匯流流速下污水匯流管道微生物的種群結構[19],如圖 3所示,干管、支管低流速的匯流狀態下,沉積物具有具有最多的種群數量,這與沉積層 DO 的檢測結果相一致,低流速狀態下,污水對沉積層的沖刷作用最弱,沉積層受污水流速擾動較小,DO含量最低,更有利于厭氧微生物的增長,增大干管、支管流速,污水對沉積層的沖刷作用加劇,攜帶污水中的溶解氧進入沉積層中,不同程度的影響微生物的繁殖.
由圖 3還可見,干管、支管低流速狀態下,微生物種群的多樣性最大,這是由于低流速狀態下不同沉積層氧化還原電位值具有最大的跨度,有利于不同種微生物的繁殖生長.
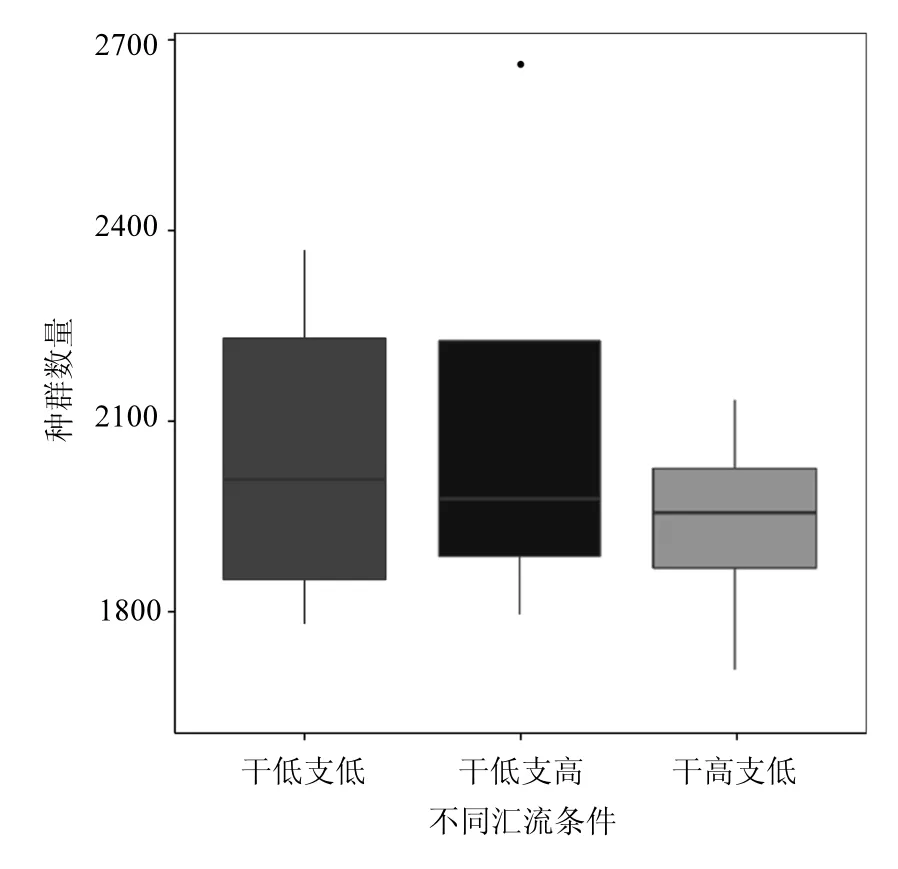
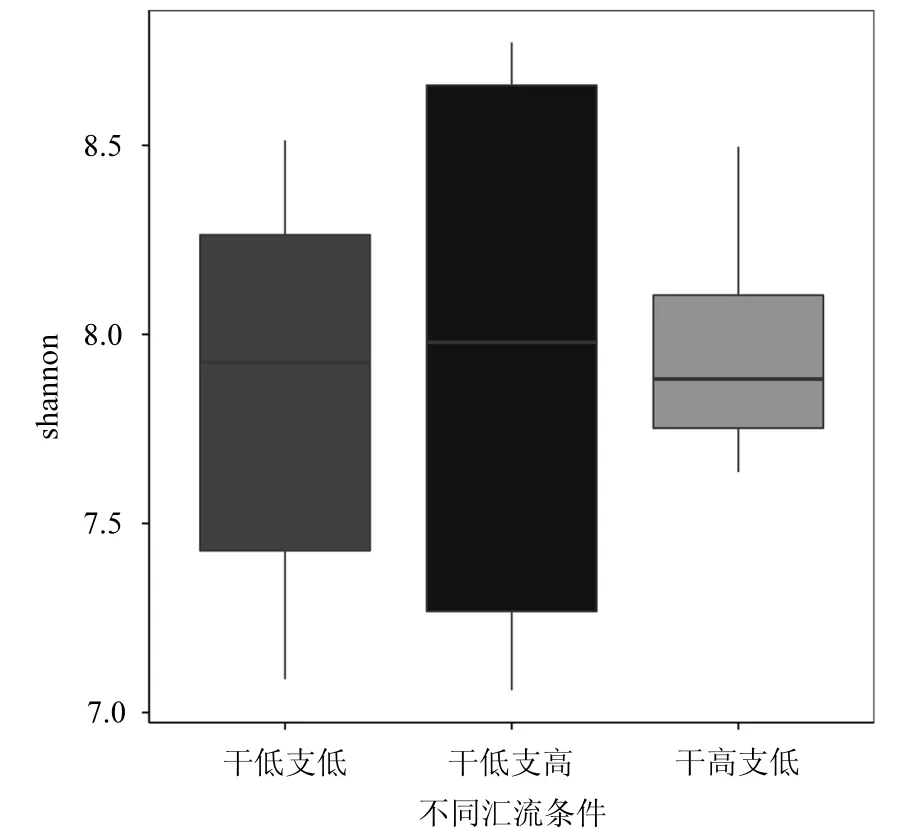
圖3 匯流區域后不同沉積層Observed species和Shannon indexFig.3 Observed species and Shannon Index of different sedimentary layers after confluents
為進一步探明不同匯流流速下匯流管道沉積層不同縱斷面內功能性微生物種群分布的差異性,利用三元相圖對3種匯流流速狀態下的微生物種群結構進行表征分析.如圖 4(a)所示,匯流管網中甲烷絲菌屬(Methanosaeta)具有最高的豐度且在干管、支管低流速的匯流狀下是最優勢的微生物種群,相對豐度高達12.38%,表明Methanosaeta是污水管道沉積物中最為優勢的微生物種群.
如圖4(b)、(c)、(d)所示,在匯流管網沉積層表面變形菌門中的菌屬(Sulfuritortus)和廣古菌門中的菌屬(ferruginibacter)豐度最高,說明這2種菌屬在好氧條件下具有更好的繁殖特性.其中Sulfuritortus在干管、支管低流速狀態下的沉積層表面相對豐度最高,高達10.88%,而ferruginibacter在干管高流速、支管低流速狀態下的沉積層表面聚集最多,相對豐度 4.35%.沿沉積層縱深向下,Sulfuritortus和 ferruginibacter的豐度逐漸降低,而甲烷絲菌屬(Methanosaeta)、產硫酸桿菌(Thiobacillus)和變形菌綱中的菌屬(Sulfurimonas)豐度逐漸增加.同時,在沉積層的最深處,甲烷絲菌屬(Methanosaeta) 是最優勢的微生物種群,在干管低流速、支管高流速的匯流狀態下相對豐度最高,高達17.00%,這表明在沉積層底部,強制厭氧以及低氧化還原電位的條件下, Methanosaeta具有最強的繁殖能力.

圖4 不同匯流流態下沉積層微生物種群分布Fig.4 Microbial population distribution in the sedimentary layer under different confluence flow states
2.4 不同匯流流態對沉積層內功能性微生物分布 特性的影響
如圖 5所示,由于污水管網中存在嚴重的甲烷逸散現象,因此產甲烷菌(MA)必然是沉積物生物相中的重要組成部分,在 3種匯流流速狀態下Methanosaeta[20]均是產甲烷菌(MA)中最優勢屬水平微生物種群,隨著支管、干管流速的增大,Methanosaeta的相對豐度逐漸降低,這是由于流速的增大一方面將沉積層中原有的碳源基質剝離到污水中,減少了微生物可利用的營養物質;另一方面造成沉積層內部 DO的上升,抑制了厭氧菌屬Methanosaeta的產生.Desulfomicrobium是硫酸鹽還原菌(SRB)中主要的微生物菌屬[21].其中隨著支管、干管流速的增大,相對豐度逐漸降低,這是由于Desulfomicrobium屬厭氧菌,管道流速的增加會造成的水流紊動會導致沉積層內部溶解氧上升,抑制了Desulfomicrobium的產生,同時也造成了硫化細菌Thiobacillus種群豐度的增加,Thiobacillus[22]屬硫氧化細菌(SOB),好氧菌屬,能夠氧化硫化氫、元素硫、硫代硫酸鹽和連四硫酸鹽等,而形成硫酸,并從此過程中獲得能量.Caldisericum是水解發酵菌(FB)中最優勢屬水平微生物種群[23], Caldisericum屬于兼性厭氧菌,適宜生長在有機物質含量較高的環境中,具有水解發酵的特性,同時隨支管、干管流速的上升,由于污水對沉積層的沖刷沉積,沉積層有機質含量下降且溶解氧含量上升,Caldarium的相對豐度下降.以Denitratisoma為代表的反硝化細菌(DNB)數量極低[24],這是由于匯流管道處于厭氧環境,硝化反應很難進行,因此污水以及沉積層中的硝酸根含量極少,DNB難以進行穩定的代謝繁殖過程.

圖5 不同匯流條件下沉積層功能性微生物的相對豐度Fig.5 Relative abundance of functional microorganisms in sediments under different confluence conditions
綜上,城市污水匯流管網中污染物轉移轉化是由多種生化反應共同作用完成的,其中污水匯流管道中的污水對沉積層的沖刷沉積作用,造成沉積層內部溶解氧以及污染物的分布變化,DO的不同為各類屬種微生物提供了生長繁殖的環境,而不同污染物質為沉積層中的不同種類微生物提供代謝的營養物質,微生物的繁殖反過來對污水中的污染物質進行進一步的降解.
3 結論
3.1 城市污水匯流管網沉積層沿縱深方向 DO含量降低,ORP值降低且隨著管道流速的增加,DO含量在沉積層縱深方向呈現增大的變化趨勢.
3.2 城市污水匯流管網模擬系統研究沿沉積層深度方向,COD、TN、NH3-N、NO3-N、硫酸鹽含量逐漸減低、硫化物含量逐漸升高,同時增大管道流速,污染物的濃度在沉積層垂直方向變化也相應增大.
3.3 匯流管網中甲烷絲菌屬(Methanosaeta)具有最高的豐度且在干管、支管低流速的匯流狀下是最優勢的微生物種群,并且沿沉積層縱深向下,變形菌門中的菌屬(Sulfuritortus)和廣古菌門中的菌屬(ferruginibacter)的豐度逐漸降低,而甲烷絲菌屬(Methanosaeta)、產硫酸桿菌(Thiobacillus)和變形菌綱中的菌屬(Sulfurimonas)豐度逐漸增加.
3.4 屬水平微生物種群 MA、SRB、SOB、FW、DNB在不同匯流流速的城市污水匯流管網中發生了優勢種群的轉變,隨著支管、干管流速的增大,產甲烷菌(MA)中優勢菌屬Methanosaeta、硫酸鹽還原菌(SRB)中優勢菌屬Desulfomicrobium、水解發酵菌(FB)中優勢菌屬Caldisericum的相對豐度逐漸減低,硫氧化細菌(SOB)中優勢菌屬Thiobacillus相對豐度增加,以 Denitratisoma為代表的反硝化細菌(DNB)種群數量極低.

