菌株WYT降解還原藍4的關鍵基因
馬 倩,李海紅,王洋濤 (西安工程大學環境與化學工程學院,陜西 西安 710600)
蒽醌染料是紡織工業中普遍存在的合成著色劑[1].由于蒽醌染料價格低廉,容易獲取且染色效果好,是繼偶氮染料之后應用量最大的一類染料.蒽醌染料結構復雜并穩定,對微生物和人體細胞的毒性甚至大于偶氮染料[2].若將未徹底處理的印染廢水排放到環境中,會對水、土壤造成嚴重的污染.目前,處理印染廢水方法主要有物理、化學和生物處理法,包含吸附、絮凝、光催化、離子交換及生化氧化等方法[3-5].生物法處理蒽醌染料具有效率高、成本低且環保的優點,近年來成為研究熱點.還原藍4(VB4)作為一種蒽醌類染料,不易被降解,具有良好的色牢度[6-7].微生物主要通過生物降解和生物吸附將 VB4脫色.生物降解過程中,原始染料結構被微生物的酶分解成小分子化合物,芳香族聚合物被轉化為CO2、H2O和一些無機鹽[8].在生物吸附過程中,作為污染物的染料被吸收到微生物細胞質中或者表面,而不是結構被破壞[9].由于細胞表面富含多糖成分,被含有官能團的蛋白質和脂質包圍,染料可以與菌體表面的活性基團相互作用從而被吸附固定[10].池振明等[11]從印染廠排出水中分離出的鄰單胞菌Plesiomonas sp.X13脫色率可達75%以上.Velayutham等[12]篩選出一株Staphylococcus sp.K2204菌株,在12h內可完全降解活性藍 KN-R.Yang等[13]利用混合菌群降解活性藍19,可在 48h內脫色 89.2%的染料.雖然目前已篩選出一些高效降解脫色蒽醌染料的菌株,但對其降解機理研究較少,尤其缺乏對降解的關鍵基因和酶的研究.
本文對前期篩選出的一株高效降解 VB4的菌株 WYT進行研究,通過全基因組測序,確定該菌株中降解脫色的關鍵基因 DyP,通過基因敲除回補驗證DyP基因為降解VB4的關鍵基因.以期為印染廢水的微生物處理技術提供參考.
1 材料與方法
1.1 材料
1.1.1 菌株 Pseudomonas aeruginosa(銅綠假單胞菌)WYT,是本課題組前期從印染廠活性污泥中篩選出的一株可高效降解VB4的革蘭氏陰性菌.
1.1.2 培養基及培養條件 培養基:無機鹽培養基(ISM):KH2PO41.0g, Na2HPO4?12H2O 2.0g, MnSO4?7H2O 0.02g,FeSO4?7H2O 0.01g,MgSO4?7H2O 0.2g,CaCl20.02g,NH4Cl 0.5g,2.0mL/L微量鹽溶液,用1mol/L NaOH與1mol/L HCl調節初始pH 7.0.121℃,20min高溫高壓滅菌備用.微量鹽溶液(mg/L):CoCl2?6H2O 4.0,MnSO4?H2On2.8,H3BO34.0, CuSO4?5H2O 0.02,ZnSO4?7H2O 28.0,MoO34.0.0.24μm 濾膜過濾備用.用于培養菌株時,按需要加入VB4染料及其他底物.LB培養基(g/L)、LB固體培養基.培養條件:Pseudomonas aeruginosa WYT菌株在ISM或LB中活化培養,大腸桿菌在 37℃恒溫培養,抗生素添加的濃度為:慶大霉素(Gm)50μg/mL,四環霉素(Tc)10μg/mL.異丙醇-β-D 硫代半乳糖苷(IPTG)添加至所需濃度,2,6-二氨基庚二酸(2,6-DAP)終濃度為0.3mmol/L.
1.1.3 試劑 基因組提取、質粒提取、膠回收、核酸純化采用 Omega公司的試劑盒(E.Z.N.A.TM).其他常規的化合物購于阿拉丁、國藥集團或美國Sigma-Aldrich科技有限公司,且均為分析純以上.
1.2 基因組文庫構建與測序分析方法
首先對菌株WYT處理后的樣品進行檢測,將合格的樣品用于文庫構建,用g-tubes將DNA基因組隨機打斷,產生 DNA 片段,利用 PacbioSMRTBELL建庫試劑盒構建,將大片段的連接產物用 BluPippin回收,最后對合格的文庫進行測序.
利用 SMRTAnalysisv2.3軟件對原始測序數據進行處理,計算得到有效數據.用三代數據拼接算法,對測序數據進行組裝和糾錯,將處理后的優質數據優化,得到基因組拼接序列.分析基因組進行組分,得到基因成分,參考 GO、KEGG 和 Swiss-Prot,以及NR和COG數據庫,將預測獲得的ORF區域進行功能注釋.
基因組提取、質粒提取、割膠回收及核酸純化等操作均按照試劑盒說明書進行.
1.3 關鍵目的基因分析比對
為探索影響 VB4降解脫色的關鍵基因,將測得的全基因組序列與主要基因庫中的所有數據進行比對,并未發現與VB4降解相關的基因.分析其他染料降解的過氧化物酶,根據 PeroxiBase數據庫,將DyP-type過氧化物酶分為4個類型,分別為A型、B型、C型以及D型.下載4個分組中的基因序列,用Bioedit軟件與原基因序列比對,然后利用MEGA進行系統發育樹分析,在WYT基因組的hits找到目的基因.
1.4 基因敲除與回補
1.4.1 抗生素敏感性測試 參考文獻[14],將WYT菌液分別接種到含有慶大霉素(GM)、四環霉素(Tc)青霉素(P)、氯霉素(C)、卡那霉素(Kan)等抗生素的培養基中培養,每種抗生素設不同濃度,慶大霉素(Gm)50μg/mL,四環霉素(Tc)10μg/mL.異丙醇-β-D 硫代半乳糖苷(IPTG)添加至所需濃度,2,6-二氨基庚二酸(2,6-DAP)終濃度為0.3mmol/L,觀察菌株的生長情況.
1.4.2 線性化質粒 PEX18Tc線性化:利用含有10μLTc的液體LB活化培養PEX18Tc菌株,提取2管質粒備用.選擇雙酶切位點:BamHI與 HindIII,質粒添加量需根據提取的濃度計算.酶切溫度選擇 2個內切酶溫度比較低的參數,酶切時間為 4h,然后跑膠驗證是否酶切完全.將酶切成功的質粒進行純化,用Nanodrop確定純化后的線性質粒濃度,濃度不可過低,過低導致后續連接效率變低.酶切反應的體系(50μL) 如下 :5μL Buffer10×K,1μL BamHI,1μL HindIII,40μL PEX18Tc質粒,3μL 無菌水.
1.4.3 構建敲除載體 利用 VectorNTI軟件構建敲除質粒[15],為保證敲除目的基因不受兩端堿基的影響,選擇擴增目的基因的上下游長度為1000bp的同源臂序列,模擬構建敲除載體[16-18].敲除質粒的構建順序為:質粒序列-上游1000bp上游同源臂-替代目的基因的抗性基因-1000bp下游同源臂-質粒序列,保證以上序列 ORF方向與待敲除的目的基因序列的方向一致.
1.4.4 擴增基因片段 設計 3對引物,設計規則根據無縫克隆設計[19-20].基因片段連接處重復 15bp,加18~22bp待擴增基因序列,總長為33~37bp且一對上下游引物設計的Tm值差距較小(無需考慮15bp的重復序列),將設計好的引物用于擴增目的基因的上游同源臂、下游同源臂及抗性基因序列.用高保真酶(fastPfu)對各個基因片段進行擴增,PCR擴增[21-22]的體系及程序如下:擴增體系:正向引物(10μmol/L)1μL,反向引物(10μmol/L)1μL,5×高保真酶緩沖液 10μL,2.5mmol/L 底物4uL,高保真酶DNA聚合物1uL,蒸餾水適量.擴增程序;95℃ 20s,33個循環為95℃ 20s,55℃ 20s,72℃ 20s,72℃ 5min,16℃ 1min.等待 3 個基因片段擴增完成后,跑膠驗證條帶大小是否正確,若準確則開始純化,用核酸純化試劑盒純化后測序,若未發現突變點,進行下一步的研究.
1.4.5 無縫克隆 無縫克隆[23-25]參考?HDCloning Kit的操作說明書進行,主要是上游同源臂、GM抗性基因片段、下游同源臂、線性化的PEX18Tc等4個片段的連接.無縫克隆的體系為:5×無縫克隆HD復合酶制劑2μL,上游同源臂50ng,下游同源臂50ng,線性化后質粒 50ng,基因組片段 50ng,加至10μ超純水.
研究需在冰上進行,完成后在 50℃的金屬浴中孵育 10min,迅速取出冰浴 2~3min,將無縫克隆后的產物導入 DH5α感受態細胞,涂抗性平板進行后續研究.在 DH5α平板上挑取單克隆,驗證各個片段的連接是否成功.重新設計 2對引物,最外端的引物需包含所有的片段,即200bp質粒上游-1000bp上游同源臂-GM 抗性基因序列-1000bp下游同源臂序列-200bp質粒下游片段.將PCR擴增產物跑膠,驗證條帶大小后測序.用VectorNTI軟件將測序結果與模擬序列比對,若無突變點,可進行下一步.
1.4.6 基因敲除 提取測序后的 DH5α質粒,用熱激法[26-27]導入 E.coli WM3064感受態細胞中,將含有E.coliWM3064菌液涂布到抗生素平板中,挑取單克隆后PCR擴增,跑膠驗證條帶大小.分別在LB(需添加 DAP 及抗生素)培養液中活化含有敲除載體的E.coli WM3064及待敲除菌株(WYT).收集生長至對數期的菌體,用 LB培養液清洗 3遍,以E.coliWM3064與WYT菌株的體積比為2:1均勻混合,涂布到含有DAP的LB平板,放置在30℃下培養,直到結合菌液周圍出現暈圈,用 LB清洗下來,涂含有抗生素(GM)的平板.在同源臂之外需再次設計引物,進行PCR擴增,然后測序驗證,若菌液中擴增出了完整的1000bp上游同源臂-GM序列-1000bp下游同源臂,則獲得敲除菌株.
1.4.7 基因回補 當菌株的 DyP基因被敲除且該菌株不具備降解VB4能力時,應設計回補實驗,將敲除的基因回補,驗證其降解能力.選取革蘭氏陰性菌質粒pRK415作為載體進行回補實驗.將pRK415質粒活化培養后,用HindIII與EcoRI作雙酶切,導入完整的 DyP基因序列,保證啟動子下游的翻譯起始框和DyP基因序列同框.擴增后的DyP基因與線性質粒無縫克隆連接,導入DH5α中后涂Tc抗性平板,挑取單克隆,將新設計的引物用于驗證,跑膠驗證和測序結果正確后,將質粒導入E.coliWM3064,再涂抗性平板,挑取單克隆,條帶大小準確則進行后續實驗.將帶有DyP基因序列的E.coliWM3064和WYT菌株過夜結合,洗脫結合菌體后涂抗性平板篩選,挑取單克隆做驗證實驗,驗證是否產生了雙交換,如果發生了改變就證明已經獲得敲除株△DyP.
1.5 敲除回補表型驗證
準備50mg/L的VB4培養液,將野生株、敲除株及回補株接入進行降解脫色實驗,每隔 4h提取0.5mL培養液,以8000r/min的轉速離心10min去除菌體,測其在特征波長615nm下的吸光度,計算脫色率率.公式如下:
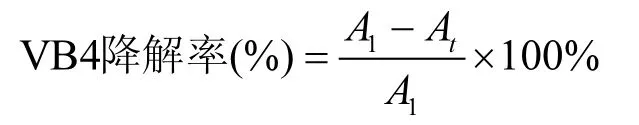
式中:A1為初始的吸光度,At為培養 t h的吸光度值[28].
2 結果與討論
2.1 全基因測序結果及統計分析
對基因組數據進行測序后對菌種的堿基修飾類型進行分析,預測該基因組的編碼區及非編碼RNA結構、串聯重復序列、微衛星 DNA序列、CRISPR結構組件,最后對預測的編碼蛋白質的基因進行數據庫比對的功能注釋.利用軟件得到有效數據后,統計其中的數量、數據產量、序列的平均長度等參數,見表1.

表1 測序數據統計Table 1 Sequencing data of WYT
通過基因預測、重復序列預測、非編碼 RNA預測等方法,可獲取測序基因組的組成情況,見表2.
由表 2可知,基于測序數據組裝得到基因組的大小為6.94Mb,GC含量65.86%.基因組組分分析后發現,基因組含有6357個基因,總長度為6190347bp,平均長度 974bp,占基因組全長的 89.19%.簡單重復序列共 59個,總長為 11017bp,占基因組全長的0.16%.tRNA 67個,rRNA 12個,其他ncRNA 126個.對預測出的基因蛋白序列,通過 blastp與 GO、KEGG、Swiss-Prot、NR、COG等通用的數據庫進行注釋.

表2 基因組組分分析Table 2 Genomic component analysis
2.2 疑似目的基因的查找與確定
在通用的數據庫中未發現相關的基因注釋,分析菌株WYT降解VB4的代謝途徑可以確定,該催化過程為氧化還原反應,結合前人已經報道的脫色酶及其特異性底物[29],推測是在水解酶、單加氧酶或過氧化物酶的共同作用下,使蒽醌環開環從而降解脫色,因此關注主要基因組中所有過氧化物酶的基因注釋.過氧化物酶是氧化還原酶的一種,且大多是血紅素過氧化物酶,其在生命合成以及污染物降解中發揮重要的作用[30].血紅素過氧化物酶可分為 3類:原核起源的過氧化物酶;真菌分泌的過氧化物酶;植物起源的過氧化物酶[31].近年來,隨著數據的不斷更新,在 PeroxiBase數據庫中將血紅素過氧化物酶分為 5個家族,分別為:過氧化氫酶超家族、環氧酶超家族、鹵素過氧化物酶超家族、雙鐵色素過氧化物酶超家族以及染料過氧化物酶.DyP-type過氧化物酶最早是在真菌的水稻紋枯病菌(Thanatephorus cucumeris Dec1)中首次發現[32].
分析全基因數據發現,6個CDS區已經注釋為過氧化酶基因序列,將這 6個片段與各類型的目的基因比對,發現在CDS區中的1713643~1714542有900bp的疑似染料脫色相關基因,用 MEGA(7.0版)軟進行比對,發現其屬于染料過氧化物酶基因中的B型,命名為DyP,其系統發育樹如圖1所示.

圖1 DyP的系統進化分析Fig.1 Phylogenetic analysis of DyP gene
2.3 菌株的抗生素抗性
抗生素抗性測試可以得出菌株對不同抗生素的耐藥性[33].在LB固體平板上測試8種常用抗生素的抗性,生長狀態如圖2.

圖2 8種抗生素抗性測試Fig.2 Resistance test of 8antibiotic
由圖2可知,菌株與多粘菌素、四環素、慶大霉素等沒有抗性.在后續實驗中需多次使用LB進行活化培養,且菌株在不同培養條件下抗性程度存在差異,因此需驗證菌株在 LB液體中的生長情況,結果表明,WYT菌株對GM和Tc抗生素不具抗性,因此在后續實驗中使用GM和Tc抗生素進行突變株的篩選實驗.
2.4 DyP基因敲除
本研究利用高保真酶,從菌株中擴增待敲除基因(DyP)的上下同源臂,并在 pBBR1McS5中擴增GM 的抗性基因,其中上下游同源臂各 1000bp,GM為 900bp左右,對其進行 1%瓊脂糖凝膠電泳分析,結果如圖3.

圖3 凝膠電泳圖及構建的PEX18TcSacB-GM載體Fig.3 Gel-electrophoresis diagram and constructed PEX18TCSACB-GM vector
由圖3中a可知,由于擴增條帶中存在較多雜質,需要割膠純化,將3個片段與線性化的PEX18Tc連接,隨后擴增,結果如圖3中b,待敲除基因(DyP)的上下同源臂和 GM 抗性基因擴增成功.測序驗證堿基無突變,構載成功.
載體構建成功后,利用同源重組法對目的基因進行敲除.通過同源重組法對目的基因進行敲除是一種經典的基因編輯技術,在動物、植物、真菌、細菌等各類生物的遺傳操作研究中被廣泛應用[34].林丹楓等[35]以自殺型質粒 pSVP202為載體,成功敲除類球紅細菌的八氫番茄素合成基因.韓武洋等[36]利用自殺載體 pKB18mobsacB,采用無抗性標記的同源重組法,成功敲除了野生型菌株谷氨酸棒桿菌中關鍵轉運蛋白基因和葡萄糖轉運系統關鍵轉運蛋白基因.圖4(a)為將所構的PEX18TcSacB-GM質粒導入到 DH5α中,轉導效率較高,隔夜可明顯的觀察到單克隆.然后將測序正確的樣品提質粒,導入到自殺質粒 WM3064中,凝膠電泳驗證結果圖 4(b)所示.WYT菌株與構建的敲除載體發生了雙交換,凝膠電泳如圖 4(f)所示,測序驗證正確,敲除成功.第 3個樣品為用擴增 DyP基因序列的引物進行擴增,并沒有條帶,再次驗證敲除成功.敲除的一段DyP基因組所在的基因簇如圖4(e)所示.

圖4 同源重組法進行基因敲除Fig.4 Homologous recombination was used for gene knockout
將敲除成功的 WYT△DyP轉接至降解脫色培養液中進行表型驗證,具體結果如圖5所示.
由圖5可知,在24h后,在敲除株的作用下VB4濃度從50mg/L下降到34.24mg/L.對比前期的研究發現,加熱致死菌體在24h后的濃度為39.753mg/L,所以推測敲除株WYT△DyP幾乎失去了降解VB4染料的功能.在野生株WYT降解脫色VB4染料的實驗組中,24h后染料的濃度僅為 1.65mg/L,脫色率率達 96.7%,野生株 WYT可高效降解 VB4,敲除株WYT△DyP失去了降解VB4染料的功能.可見DyP基因是降解脫色VB4染料的關鍵基因.

圖5 WYT△DyP表型驗證Fig.5 Phenotype verification of WYT△DyP
2.5 DyP基因回補實驗
將敲除的關鍵基因回補,驗證基因敲除是否成功.從WYT菌株基因組中擴增 DyP基因序列,跑凝膠電泳圖并測序,結果如圖6.
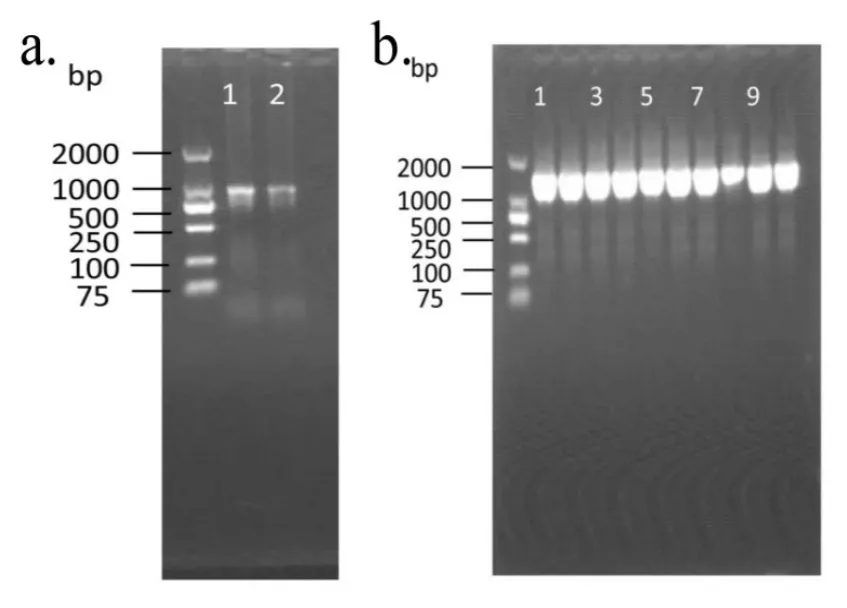
圖6 基因回補Fig.6 Genes to cover
由圖6a可知,回補質粒并未發生突變,跑膠條帶大小為1000bp左右.隨后用無縫克隆進行連接后導入E.coli.DH5α中,驗證是否連接成功,凝膠電泳結果如圖6b示,跑膠條帶大小均為1000~2000bp,測序后與模擬序列對比,無突變點,提質粒導入 E.coli.WM3064并構建載體.
載體構建成功后,將 WYT ΔDyP與 E.coli.pRK415-DyP以1:2的菌體量滴在含有0.3mmol/L DAP 的 LB平板上(圖 7a),直到菌落周圍有明顯的暈圈(圖 7b).由于結合的效率較低,所以在結合篩選時,LB 平板中添加較高濃度的 Tc(50μg/mL)進行篩選,3d后長出明顯的單克隆(7c).挑取結合成功的單克隆,并進行凝膠電泳驗證(圖 7d)后測序無突變點,獲得了WYTΔDyP::DyP回補株.

圖7 WYT△DyP::DyP回補株Fig.7 WYTΔDyP::DyP complementary strain
2.6 野生株、敲除株、回補株表型驗證
VB4的降解脫色是由于蒽醌基團的開環,導致發色基團裂解.在相同條件下測試野生株、敲除株及回補株對 VB4染料的降解效果,記錄菌株降解過程VB4濃度的變化,得到菌株的脫色率,如圖8所示.

圖8 野生菌株WYT、突變株WYT△DyP及回補株WYT△DyP::DyP對VB4的脫色率Fig.8 Growth and degradation curves of VB4 by DyP strains WYT△DyP and WYT△DyP
由圖8可知,敲除株24h后對VB4的脫色率為22.17%,而在前期實驗中,通過活細胞和加熱至死細胞對VB降解研究中對比發現,加熱致死菌24h后染料脫色率為20.49%,與敲除株相似,推測敲除株的少量脫色效果是由菌體的生物吸附引起的.Walker等[37]將菌株Bacillus gordonae,Bacillus benzeovorans和Pseudomonas putida在110℃高溫下加熱15min,測試對酸性藍277的脫色性能,結果3株菌分別可去除 13%、19%和 18%的染料.基因回補后,回補株的脫色率為96%,與野生株相近,基因回補成功.
3 結論
3.1 通過全基因組測序分析推測了關鍵基因,WYT菌株的關鍵基因屬于染料過氧化物酶基因中的B型.
3.2 通過基因敲除和回補驗證推測的基因是 VB4降解脫色的關鍵基因.
3.3 測試野生株、敲除株、回補株降解VB染料的效果,發現敲除株幾乎失去降解染料的功能,而回補株恢復了降解能力.因此,DyP基因是VB4降解脫色的關鍵基因.
致謝:感謝論文完成過程中給予我意見的安鳳秋老師和李海紅老師,同時感謝課題組的同學,謝謝你們!

