人參皂苷Rg1下調NOX2-NLRP1減輕PC12細胞缺氧再復氧損傷的作用
黃茸茸,陸松俠,孫玲玲,張 晗,丁世欣,李維祖
(1. 安徽新華學院藥學院藥理學教研室,安徽 合肥 230088;2. 安徽醫科大學藥理學教研室,抗炎免疫藥理學教育部重點實驗室,國家中醫藥管理局中藥藥理三級實驗室,安徽 合肥 230032)
近年來,受人口老齡化、飲食習慣改變等多因素影響,卒中類疾病的發病率、致殘致死率逐年升高。其中缺血性腦卒中主要由腦部血液供應不足導致,治療策略常通過溶栓治療以恢復血流灌注,再灌注過程雖可挽救缺血半暗帶內的瀕死腦神經細胞,但同時也可加重腦神經細胞損傷,甚至致死。導致腦缺血/再灌注損傷的機制較為復雜,且互為因果,已有實驗研究發現其可能與自由基生成增多、炎性損傷、興奮性氨基酸毒性、細胞鈣超載及神經細胞凋亡等多種機制有關[1],但尚未完全闡明,仍需進一步探究。近年有研究表明,氧化應激和炎癥反應與腦缺血/再灌注損傷的關系較為密切。NADPH氧化酶2(nicotinamide adenine dinucleotide phosphate oxidase 2,NOX2)是腦中活性氧(reactive oxygen species,ROS)生成的主要來源,而ROS的大量生成是激活炎癥小體的主要途徑。核苷酸結合寡聚化結構域NOD樣受體蛋白1(nucleotide-binding oligomerization domain-like receptor protein 1,NLRP1)炎癥小體的活化能調控炎癥因子前體pro-IL-1β和pro-IL-18的成熟和分泌,從而導致腦組織出現炎性損傷[2]。因此,NOX2-NLRP1信號通路可為篩選治療腦缺血/再灌注損傷(cerebral ischemia/reperfusion injury,CIRI)藥物的重要靶點。
目前臨床尚無有效防治CIRI的藥物,這使得從中藥材資源中尋找有效的天然活性成分成為研究熱點。人參(ginseng)為五加科草本植物,是我國傳統中藥材之一,因對中樞神經系統、心血管系統、免疫系統等具備較為廣泛的雙向調節作用,其保健及藥用價值較高。人參皂苷Rg1(ginsenoside Rg1)為四環三萜類衍生物,是人參中的主要生物活性成分,有最新研究報道[3-6],人參皂苷Rg1對中樞神經退行性疾病如阿爾茨海默病、抑郁癥、癲癇及酒精性肝病等疾病均有一定治療保護作用,但其對腦缺血/再灌注損傷的保護作用及機制未明,有待進一步研究。因此,本實驗通過體外研究NOX2-NLRP1信號通路在PC12細胞氧糖剝奪/再復氧(oxygen glucose deprivation/reoxygenation,OGD/R)損傷中的作用及Rg1的干預作用,以尋證防治腦缺血/再灌注損傷的新靶點及有效防治藥物,并為人參藥材的開發提供實驗基礎。
1 材料
1.1 實驗細胞PC12細胞株,安徽醫科大學藥理教研室細胞庫凍存惠贈。
1.2 藥品和試劑人參皂苷Rg1(≥98%),成都德斯特生物技術有限公司,DR0009;Apocynin,德國Merck Millipore公司,178385-1GM;Tempol,德國Merck Millipore公司,581500-500MG;RIPA細胞裂解液,江蘇碧云天生物技術有限公司,P0013B;DMEM高糖培養液,美國Hyclone公司,SH30022.01B;胎牛血清,杭州天杭生物科技有限公司,11011-8611;乳酸脫氫酶(LDH)檢測試劑盒,江蘇凱基生物技術有限公司,KGT02448;活性氧(ROS)檢測試劑盒,江蘇凱基生物技術有限公司,KGAF018;白介素-1β(IL-1β)檢測試劑盒,江蘇酶免實業有限公司,3748;Annexin V-FITC/PI凋亡檢測試劑盒,北京四正柏生物科技有限公司,FXP018-050;無血清細胞凍存液,蘇州新賽美生物科技有限公司,C40100。
1.3 實驗儀器5% CO2恒溫培養箱(香港Heal Force公司);無菌超凈工作臺(蘇州凈化設備有限公司);三氣培養箱(美國Thermo Fisher公司);IX-71 熒光倒置顯微鏡(日本Olympus有限公司);全波長酶標儀(美國Thermo Fisher公司);PowerPac 200 Western blotting電泳儀(美國Bio-Rad公司);Mini-PROTEAN Tetra電泳槽(美國Bio-Rad公司);Countstar自動細胞計數儀(上海睿鈺生物技術有限公司);高內涵細胞成像分析系統(美國MD公司)。
2 方法
2.1 PC12細胞OGD/R模型的建立PC12細胞在DMEM高糖培養基中長至約70%時,將其接種至培養板。取對數生長期PC12細胞,除去DMEM高糖培養基,用PBS清洗3次,更換為無糖Earle平衡鹽溶液后置于三氣培養箱(含1% O2+5% CO2+94% N2)中,37 ℃培養6 h,即缺氧缺糖6 h,之后再換回DMEM高糖無血清培養基于常氧培養箱中復氧24 h建立OGD/R模型。
2.2 實驗分組與給藥實驗分為6組,即空白對照組、OGD/R模型組、OGD/R+Tempol(50 μmol·L-1)組、OGD/R+Apocynin(50 μmol·L-1)組、OGD/R+Rg1(5 μmol·L-1)組、OGD/R+Rg1(10 μmol·L-1)組。空白對照組不做處理正常培養,其余各組細胞均缺氧缺糖處理6 h,再復氧復糖24 h制作OGD/R細胞模型。各給藥組均需在造模前分別加藥孵育2 h。
2.3 DCFH-DA法檢測活性氧ROS生成各組PC12細胞再復氧復糖24 h后,吸取細胞上清于-20 ℃存放備用。用PBS清洗細胞3次,然后將DCFH-DA儲存液和PBS緩沖液以1 ∶1 000混合配制成工作液,每個培養孔加1 mL,搖床上搖晃20 min,再將培養板中的工作液吸出,用PBS清洗培養板3次,5 min/次,將培養板置于細胞高內涵成像系統內進行拍攝并分析ROS的生成量。
2.4 Annexin V-FITC/PI雙染法檢測細胞凋亡情況各組PC12細胞再復氧復糖24 h后棄去培養基。用預冷的PBS洗滌細胞2次,加入10 μL/孔Annexin V-FITC試劑混勻后,于室溫避光孵育15 min,再加入5 μL碘化丙錠溶液(PI)后混勻避光孵育5 min,再用PBS洗滌細胞2次,在熒光顯微鏡下觀察各組細胞的凋亡情況并拍照,綠色熒光顯示早期凋亡細胞,紅色熒光顯示晚期凋亡細胞。
2.5 細胞上清中LDH活力與IL-1β的含量檢測各組PC12細胞再復氧復糖24 h后取上清,于4 ℃離心10 min后,用LDH檢測試劑盒按說明書操作,使用酶標儀在440 nm檢測各組上清吸光度值,計算LDH活力;采用ELISA法按試劑盒的操作說明書操作,使用酶標儀在450 nm波長下測定各組上清吸光度,根據標準品線性回歸曲線,按曲線方程計算各組細胞上清中IL-1β的濃度值。
2.6 Western blot法檢測NOX2、p22phox、p47phox、NLRP1、ASC、Caspase-1、PSD95、Tau、p-Tau的蛋白表達水平取給藥預處理后缺氧缺糖6 h,再復氧24 h后的各組PC12細胞,吸出培養基,PBS緩沖液清洗3次后加入1 mL PBS緩沖液,用細胞刮刮取細胞,然后將各組細胞懸浮液分別置于離心管中,4 ℃預冷的冰凍離心機1 200 r·min-1離心15 min,棄去上清,每管加入細胞裂解液200 μL,每10 min于渦旋儀上震蕩10 s,共3次。然后放入冰凍離心機中1 200 r·min-1,離心15 min,取上清作為細胞總蛋白。采用BCA法測定各組蛋白濃度,再加入loading buffer煮沸變性,SDS-PAGE凝膠電泳并轉PVDF膜,轉膜完成后于5%脫脂奶粉封閉液中室溫下孵育1 h,再加一抗:NOX2(Abcam公司,ab80508,1 ∶1 000)、p22phox(Bioworld公司,BS60290,1 ∶1 000)、p47phox(Bioworld公司,BS6181,1 ∶1 000)、NLRP-1(Abcam公司,ab98181,1 ∶1 000)、Caspase-1(Bioworld公司,BS5641,1 ∶500)、ASC(Bioss公司,bs-6741R,1 ∶1 000)、PSD95 (Servicebio公司,GB11277,1 ∶1 000)、Tau(Servicebio公司,GB111609,1 ∶1 000)、p-Tau(Abcam公司,ab92676,1 ∶1 000)和β-actin(Servicebio公司,GB12001,1 ∶1 000)于4 ℃下孵育過夜后,將PVDF膜用TBST緩沖液洗滌3次,10 min/次,加入HRP標記的二抗(1 ∶10 000),室溫孵育1 h,再用TBST緩沖液洗滌3次,10 min/次。最后將PVDF膜浸泡于ECL化學發光液中3 min,用化學發光成像系統進行顯影。使用ImageJ軟件分析各目的蛋白的灰度值,并以β-actin的表達作為參照,計算各目標蛋白的相對表達量。
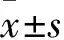
3 實驗結果
3.1 人參皂苷Rg1對OGD/R后PC12細胞上清中LDH活性的影響細胞上清中LDH的活性(即釋放量)與細胞損傷密切相關。由Fig 1結果顯示,與空白對照組比較,模型組PC12細胞上清的LDH釋放量顯著增加(P<0.01);而與模型組相比,Tempol、Apocynin、Rg1(5、10 μmol·L-1)藥物組細胞上清的LDH釋放均明顯降低(P<0.05或P<0.01)。提示人參皂苷Rg1可明顯減輕OGD/R處理對PC12細胞的損傷。
3.2 人參皂苷Rg1對OGD/R后PC12細胞凋亡的影響細胞凋亡是腦缺血/再灌注損傷的重要形式,因此本實驗通過Annexin V-FITC/PI雙染法觀察人參皂苷Rg1對OGD/R處理PC12細胞凋亡的影響。Fig 2結果顯示,空白對照組細胞生長良好,早期凋亡和晚期凋亡細胞少見;但與其相比,OGD/R模型組早期凋亡和晚期凋亡的細胞數明顯增加(P<0.01);而與模型組比較,Tempol、Apocynin和Rg1(5、10 μmol·L-1)藥物預處理均能明顯減少OGD/R后早期凋亡和晚期凋亡細胞(P<0.05或P<0.01)。表明人參皂苷Rg1可通過抑制凋亡減輕OGD/R處理對PC12細胞的損傷。
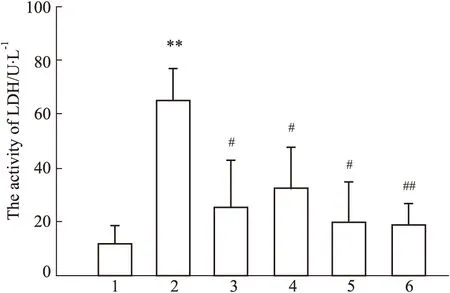
Fig 1 Effect of ginsenoside Rg1 on activity of LDH after OGD/R in PC12 cells n=4)
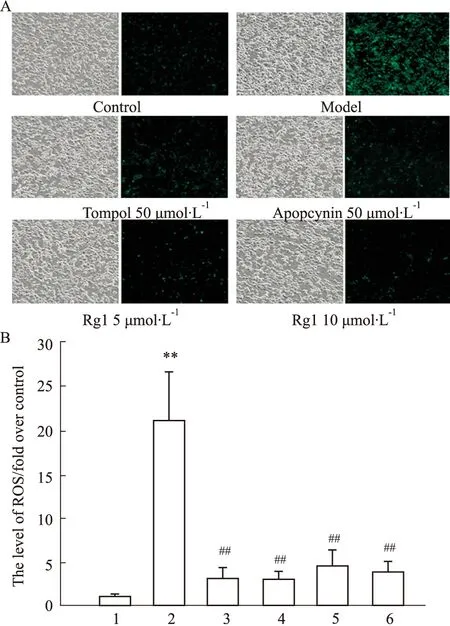
Fig 3 Effect of ginsenoside Rg1 on ROS production after OGD/R in PC12 cells n=3)
3.3 人參皂苷Rg1對OGD/R后PC12細胞ROS生成的影響ROS大量生成導致的氧化應激損傷是腦缺血/再灌注損傷的重要機制之一。因此本研究使用DCFH-DA熒光染色法檢測OGD/R后PC12細胞的ROS水平。如Fig 3結果顯示,空白對照組細胞生長狀態良好,有少量ROS生成;但模型組細胞則出現形態變圓,大小不一,ROS生成明顯增加(P<0.01);而與模型組相比,Tempol、Apocynin和Rg1(5、10 μmol·L-1)藥物處理組的細胞狀態有明顯改善,ROS的水平明顯降低(P<0.01)。結果提示人參皂苷Rg1可通過抑制ROS生成減輕OGD/R對PC12細胞的氧化應激損傷。
3.4 人參皂苷Rg1對OGD/R后PC12細胞中NADPH氧化酶2相關蛋白NOX2、p22phox和p47phox表達的影響NADPH氧化酶2是神經元中生成ROS的重要酶系統,因此實驗進一步檢測OGD/R后PC12細胞中ROS生成是否與此有關。Fig 4所示,空白對照組中NOX2、p22phox和p47phox蛋白表達水平較低,但與對照組比較,模型組細胞的NOX2、p22phox和p47phox蛋白表達明顯增多(P<0.05或P<0.01);而與模型組比較,Tempol處理對p22phox與p47phox蛋白的表達有抑制作用(P<0.05),而對NOX2的蛋白表達無顯著影響;但Apocynin和Rg1(5、10 μmol·L-1)處理均可明顯降低OGD/R后PC12細胞中NOX2、p22phox和p47phox的蛋白表達(P<0.05或P<0.01)。實驗結果表明,人參皂苷Rg1可通過下調NADPH氧化酶2表達抑制OGD/R后PC12細胞中ROS生成。
Fig 4 Effect of Rg1 on expressions of NOX2, p22phox and p47phox after OGD/R in PC12 cells n=3)
3.5 人參皂苷Rg1對OGD/R后PC12細胞及上清中IL-1β含量的影響Fig 5結果顯示,空白對照組細胞中及上清中IL-1β的水平均較低,但與對照組比較,模型組細胞中及上清中IL-1β的水平明顯升高(P<0.05);而與模型組相比,Tempol、Apocynin、Rg1(5, 10 μmol·L-1)組細胞及上清中IL-1β的含量水平明顯降低(P<0.05或P<0.01)。結果提示,人參皂苷Rg1可通過抑制炎癥因子IL-1β生成減輕OGD/R對PC12細胞的炎性損傷。
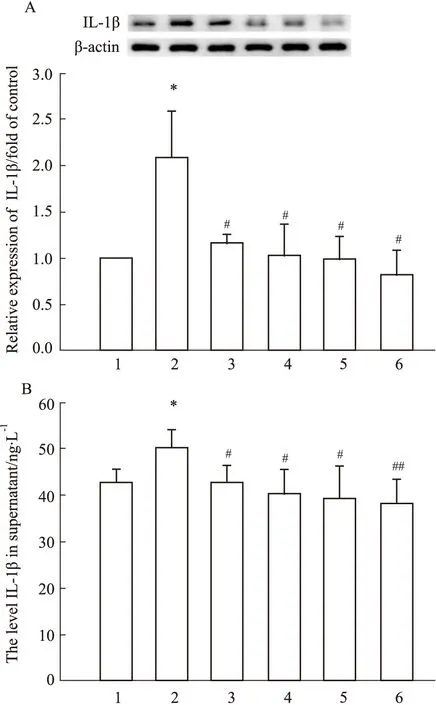
Fig 5 Effect of ginsenoside Rg1 on IL-1β level after OGD/R in PC12 cells and in supernatant n=3)
3.6 人參皂苷Rg1對OGD/R后PC12細胞中NLRP1炎癥小體相關蛋白NLRP1、ASC及Caspase-1表達的影響Fig 6結果顯示,空白對照組PC12細胞中NLRP1、ASC及Caspase-1表達水平較低,但與對照組相比,模型組細胞的NLRP1、ASC及Caspase-1的蛋白表達均明顯增加(P<0.05或P<0.01);而與模型組相比,Tempol、Apocynin和Rg1(5、10 μmol·L-1)處理均可使NLRP1炎癥小體相關蛋白表達明顯下降(P<0.05或P<0.01)。該實驗結果表明,人參皂苷Rg1可通過抑制NLRP1炎癥小體激活減輕OGD/R處理后PC12細胞的炎癥損傷。
3.7 人參皂苷Rg1對OGD/R后PC12細胞中PSD95、Tau及p-Tau蛋白表達的影響PSD95是突觸后致密區的支架蛋白,p-Tau水平與神經纖維纏結密切相關,本研究進一步檢測了OGD/R對PC12細胞PSD95和p-Tau水平的影響。如Fig 7結果顯示,與空白對照組相比,模型組細胞中的PSD95蛋白表達明顯降低(P<0.01),p-Tau蛋白表達明顯升高(P<0.01),而Tau蛋白的表達則差異無統計學意義;但與模型組相比,Tempol、Apocynin和Rg1(5、10 μmol·L-1)處理組均可使PSD95蛋白表達明顯升高(P<0.05或P<0.01),使p-Tau蛋白的表達明顯降低(P<0.05或P<0.01)。該實驗結果表明,人參皂苷Rg1可明顯減輕OGD/R所致的神經突觸結構性損傷;而其能明顯抑制磷酸化Tau蛋白水平,表明人參皂苷Rg1還可減輕OGD/R處理PC12細胞所致的神經毒性反應。
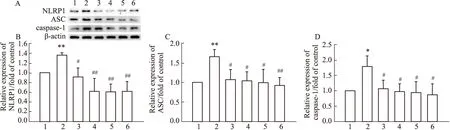
Fig 6 Effect of Rg1 on expressions of NLRP1, ASC and Caspase-1 after OGD/R in PC12 cells n=3)
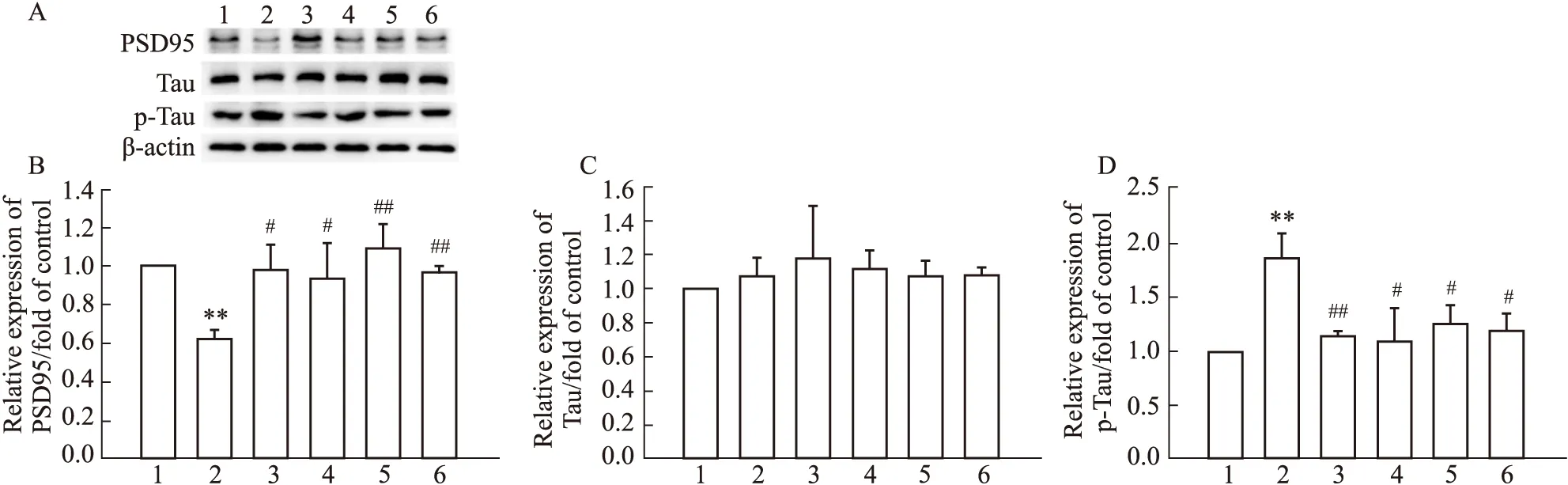
Fig 7 Effect of Rg1 on expression of PSD95, Tau and p-Tau after OGD/R in PC12 cells n=3)
4 討論
腦缺血是中老年群體中常見的疾病之一,大量研究發現[7],腦缺血/再灌注后可能會引發更加嚴重的神經功能障礙及腦組織損傷,被稱為“腦缺血/再灌注損傷”,因其與臨床多種腦血管病密切相關,已成為當前研究熱點之一。CIRI損傷機制十分復雜,可導致蛋白質分子及其調節發生變化,且多種因素參與了缺血/再灌注引起的神經元細胞損傷,如氧化應激、炎癥反應、血腦屏障破壞等,最終導致不可逆的神經元死亡。
OGD/R模型是一種體外中風模型,與腦缺血/再灌注的體內病理模型相似。PC12細胞來源于大鼠腎上腺嗜鉻細胞瘤髓質,是研究神經元功能、信號轉導和評價藥物功效的常用細胞類型,本實驗研究即是采用PC12細胞建立體外OGD/R模型。實驗結果顯示,OGD/R模型組細胞變圓,且大小不一,并出現變性壞死及凋亡等損傷;而Tempol、Apocynin和Rg1(5、10 μmol·L-1)藥物組均可不同程度的改善OGD/R導致的細胞損傷。
腦缺血會導致大量活性氧(ROS)生成,且腦組織復氧復糖也會刺激ROS的過度釋放來參與腦缺血/再灌注性損傷。ROS生成過多會破壞生物膜導致乳酸脫氫酶(LDH)釋放增加,因此,LDH釋放是評價神經元損傷程度的重要指標之一[8]。本實驗結果顯示,與模型組比較,Tempol、Apocynin和Rg1(5、10 μmol·L-1)藥物組能明顯減少ROS生成及上清中LDH活性,說明經藥物干預可明顯減輕OGD/R后PC12細胞的氧化應激損傷。細胞凋亡是由基因控制的自主有序的死亡,腦缺血過程中腫瘤壞死因子和自由基的產生,生長因子和神經營養因子的缺乏,DNA損傷等多種誘因可能觸發細胞凋亡[9];且另有研究表明,強效抗氧化劑對大腦I/R導致的神經凋亡具有顯著抑制作用[10]。本實驗結果顯示,OGD/R刺激可促進細胞凋亡的發生,而抗氧劑Tempol、NADPH氧化酶2抑制劑Apocynin及人參皂苷Rg1均可有效逆轉OGD/R導致的神經元凋亡。實驗數據均表明,Rg1對OGD/R導致的PC12細胞氧化應激損傷具有較好的保護作用。
有研究顯示,廣泛分布于腦神經元細胞、星形膠質細胞及小膠質細胞等的NADPH氧化酶是腦缺血/再灌注時ROS的重要來源,在CIRI損傷中發揮關鍵作用。NADPH氧化酶催化亞基gp91phox/NOX2及其同源物統稱為NOX家族蛋白。有研究發現[11],NOX家族中的NOX2與中風后腦內ROS的生成密切相關,且敲除NADPH氧化酶基因或使用NADPH氧化酶抑制劑均可明顯減輕氧化損傷。另有實驗研究顯示[12],NOX2抑制劑(gp91ds-tat)可明顯抑制I/R誘導的ROS的釋放,并減少腦梗死體積,減輕神經凋亡和血腦屏障損傷,因此,NADPH氧化酶成為治療缺血性腦血管病的重要靶點。Apocynin又稱為羅布麻寧、茶葉花寧、夾竹桃麻素等,已有研究報道,Apocynin能夠降低腦缺血大鼠的神經功能缺陷及細胞凋亡率,從而減輕CIRI損傷,其機制可能與抑制NADPH酶的活化有關[13]。Tempol (4-Hydroxy-TEMPO)是一種超氧化物清除劑,具有較好的神經保護、抗炎和鎮痛效果。有研究報道,其可有效清除自由基,抑制脂質過氧化和腦神經細胞發生氧化性損傷,對改善腦內細胞炎癥反應有較明顯的作用[14]。本實驗結果顯示,Tempol、Apocynin和Rg1(5、10 μmol·L-1)組可明顯降低OGD/R后PC12細胞的NOX2、p22phox和p47phox蛋白表達,同時降低OGD/R后細胞ROS的釋放,提示人參皂苷Rg1可能是通過抑制NOX2的活性來減少OGD/R誘導的ROS生成,同時提示抑制NOX2的活性可能是抑制細胞凋亡和改善CIRI損傷的有效策略之一。
在腦缺血/再灌注損傷的眾多機制中,炎癥機制已得到公認。已有大量實驗證明,IL-1β是最重要的細胞因子,其參與腦缺血/再灌注性損傷,且可能與炎癥小體NLRP-1密切相關[15]。炎癥小體NLRP-1主要在大腦、血液和胸腺等組織中表達,其主要由NLRP-1、ASC、Caspase-1三種蛋白構成。NLRP-1通過接頭蛋白ASC招募Pro-caspase-1,Caspase-1激活后可對pro-IL-1β等細胞因子前體進行加工,使其成熟并釋放到胞外,誘發神經炎性反應而導致中樞神經系統病變。另有研究報道顯示,NLRP-1可能介導了腦缺血后細胞損傷的相關炎癥反應,而ROS是觸發缺血性中風后NLRP-1炎癥小體通路激活的主要信號[16]。因此,抑制NLRP-1炎癥小體活化也成為防治腦缺血/再灌注性損傷的重要策略之一。本實驗結果顯示,OGD/R后可明顯增加PC12細胞中NLRP-1,ASC,Caspase-1和IL-1β相關蛋白表達,提示NLRP-1介導了OGD/R細胞的炎癥反應,這與文獻報道結果一致。本實驗數據則進一步顯示,Tempol,Apocynin和Rg1(5、10 μmol·L-1)均能降低OGD/R后PC12細胞的NLRP1,ASC,Caspase-1和 IL-1β 蛋白表達水平,同時降低細胞上清中IL-1β的含量。這說明Rg1可能是通過下調NOX2-NLRP1通路來減輕OGD/R導致的神經元損傷。
腦缺血/再灌注損傷所導致的神經功能障礙是腦卒中治療中亟待解決的難點問題,而突觸可塑性是構成學習記憶等功能的重要神經化學基礎。突觸后致密蛋白95(postsynaptic density protein 95,PSD95)是突觸后致密區的支架蛋白,有研究表明,PSD95表達異常與學習記憶功能障礙密切相關,當腦缺血/再灌注引發腦組織神經功能障礙時,PSD95的表達被明顯抑制[17]。Tau蛋白是一種相對分子量較小的微管相關蛋白,在正常生理條件下可促進微管蛋白聚集成微管并增強其穩定性,在維持神經細胞生長發育及軸突信息傳遞中發揮重要作用。近年研究發現,腦缺血后Tau蛋白異常磷酸化明顯增加,p-Tau蛋白已成為神經元缺血性損傷較為敏感的標志之一。而Tau蛋白的過度磷酸化,是加速神經元死亡的主要原因[18]。本實驗研究發現,Tempol、Apocynin和Rg1(5、10 μmol·L-1)組可使PSD95蛋白表達明顯升高,使p-Tau蛋白的表達明顯降低,說明人參皂苷Rg1能夠減輕腦缺血/再灌注所致的突觸結構性損傷和抑制tau蛋白磷酸化水平。
綜上所述,PC12細胞在缺氧復氧處理后細胞活性降低,氧化應激與細胞凋亡明顯,炎癥小體相關蛋白表達上調,最終造成細胞病理性損傷。而Tempol、Apocynin和Rg1(5,10 μmol·L-1)各藥物組均能減輕OGD/R導致的細胞損傷從而抑制細胞凋亡,說明人參皂苷Rg1可能是通過抑制NOX2-NLRP1信號通路來減輕PC12細胞缺氧復氧性損傷。

