右美托咪定通過調控SIGIRR/NF-κB信號對脂多糖誘導的大鼠急性肺損傷的影響
王鵬程,王 震,代彥文,王 濤
(1. 黃淮學院直屬附屬駐馬店市中心醫(yī)院麻醉科,河南 駐馬店 463003;2.鄭州大學藥學院藥理學系,河南 鄭州 450001)
急性肺損傷(acute lung injury,ALI)是臨床上常見的急危重癥之一,其死亡率一直居高不下。研究證實ALI危害主要是由于機體炎癥反應失衡引起肺組織破壞,主要表現為各組炎癥細胞因子(如IL-1β、IL-6和TNF-α等)的釋放增多,炎癥細胞因子過量釋放誘導的炎癥級聯反應進而加重肺組織損傷[1]。因此,通過有效的處理措施降低并抑制炎癥風暴可能是預防和治療ALI的有效措施,但是目前有關其特異性炎癥治療仍然缺乏。Toll樣受體(Toll-like receptors,TLRs)被認為是固有免疫系統(tǒng)中炎癥反應的主要受體之一,TLR信號通路的過度激活是誘發(fā)機體炎癥失衡的重要機制[2-3]。
單免疫球蛋白白細胞介素1受體相關蛋白(single immunoglobulin interleukin-1 receptor related protein,SIGIRR)是近期新發(fā)現的TLR超家族成員之一,是TLR信號傳導中的負性調控分子[4]。既往研究發(fā)現,SIGIRR主要在肺泡及氣道上皮細胞中高表達,LPS誘導的小鼠ALI肺組織SIGIRR表達下調[5]。過表達SIGIRR可以抑制LPS誘發(fā)的肺泡上皮細胞TLR4信號傳導,繼而減輕炎癥反應,發(fā)揮肺泡上皮細胞的保護作用[6]。以上研究均表明,SIGIRR在ALI的炎癥級聯反應中發(fā)揮重要調控作用。因此,通過調節(jié)SIGIRR的表達對改善LPS誘導的ALI具有重要意義。右美托咪定(dexmedetomidine,DEX)是臨床上常用的一種催眠、鎮(zhèn)靜以及鎮(zhèn)痛的麻醉藥物,其作為腎上腺素能受體的選擇性激動劑,有文獻研究證實DEX能夠減輕LPS誘導的大鼠急性肺和腎損傷[7]。另外,DEX能夠通過降低TLR4表達,抑制NF-κB信號通路的活化,進而減輕LPS誘導的ALI肺損傷和炎癥反應[8]。但是有關DEX對大鼠ALI肺損傷的分子作用機制尚不完全清楚。因此,該研究擬通過建立LPS誘導大鼠ALI模型,初步揭示DEX對LPS誘導大鼠ALI肺損傷的影響及其保護作用機制。
1 材料與方法
1.1 材料
1.1.1實驗動物 SPF級,♂,4-6周齡,SD大鼠,體質量(200±20)g,購買于中國科學院實驗動物研究所,許可證號:SCXK(京)2019-0010,適應性喂養(yǎng)1周,自由飲水,晝夜交替光照,溫度維持在(20-25)℃,相對濕度60%-70%。
1.1.2實驗試劑與儀器 胎牛血清和細胞培養(yǎng)基購買于Gibco公司,SIGIRR小鼠單克隆抗體(Cell Signaling Technology公司,貨號:8242),NF-κB兔單克隆抗體(Cell Signaling Technology公司,貨號:59674);p-NF-κB兔單克隆抗體(Abcam公司,貨號:3786),β-actin小鼠單克隆抗體(碧云天生物技術公司,貨號:AF5001),山羊抗兔二抗(碧云天生物技術公司,貨號:A0409),山羊抗小鼠二抗(碧云天生物技術公司,貨號:A0413),Western blot一抗稀釋液(江蘇碧云天生物技術公司,貨號:P0256),BCA蛋白濃度測定試劑盒(江蘇碧云天生物技術公司,貨號:P0011),ECL發(fā)光液(江蘇碧云天生物技術公司,貨號:P0018FS),酶聯免疫吸附實驗(enzyme linked immunosorbent assay,ELISA)檢測試劑盒(北京中杉金橋公司),蛋白質凝膠成像系統(tǒng)(美國Bio-Rad公司,型號:ND11-GIS-300),多功能酶標儀(美國 Bio-Tek公司,型號:SuPerMax 3100),熒光顯微鏡(日本Olympus公司,型號:BX53),高速冷凍離心機(湖南湘儀公司,型號:H2500R2)。
1.2 方法
1.2.1動物模型構建與分組 實驗前大鼠禁食12 h,期間自由飲水。實驗選取40只SD大鼠,每組各10只,并隨機分為正常對照組(Control)、DEX對照組(DEX)、LPS誘導的大鼠ALI模型組(LPS)以及LPS+DEX處理組(LPS+DEX)。其中對于LPS組和LPS+DEX組大鼠采用腹腔注射LPS(5 mg·kg-1)構建ALI大鼠損傷模型,Control組和DEX組大鼠給予等量的0.9%的氯化鈉注射。在DEX預處理實驗中(DEX組和LPS+DEX組),應在LPS大鼠腹腔注射前1 h均給予DEX(25 μg·kg-1)大鼠腹腔注射。實驗各組大鼠在確證LPS誘導ALI大鼠損傷模型構建成功后,采用戊巴比妥鈉麻醉大鼠并對各組大鼠肺組織進行病理學取材,檢測。
1.2.2各組大鼠肺濕/干質量比(W/D)檢測 大鼠麻醉后,取出右肺中葉組織,快速利用PBS緩沖溶液沖洗組織表面的血液之后采用濾紙吸干組織表面的水分,稱取肺組織濕質量(W),之后將各組濕肺組織放置于75 ℃的恒溫烤箱中進行時長12 h的烘烤,待烘干至質量不變后測定肺組織干質量(D)。
1.2.3蘇木精-伊紅(hematoxylin and eosin,HE)染色觀察肺組織形態(tài)學改變 采用4%的多聚甲醛固定大鼠右肺組織,石蠟包埋、病理學切片(5 μm),按照HE染色規(guī)范操作步驟進行HE病理學染色。
1.2.4ELISA檢測各組大鼠肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中IL-1β、IL-6和TNF-α含量 分離大鼠氣管并夾閉右側肺支氣管,結扎肺門,將事先預冷的PBS從大鼠左側支氣管中進行肺泡灌洗,收集左支氣管肺泡灌洗液,于4 ℃條件下,12 000 r·min-1,離心10 min,取上清液,之后按照對應的ELISA檢測試劑盒說明書進行測定。
1.2.5免疫組化檢測各組大鼠右肺組織SIGIRR表達、NF-κB活化情況 將大鼠右肺組織的石蠟切片置于60 ℃烤箱內脫蠟,然后二甲苯浸洗,梯度乙醇溶液脫水。將右肺組織切片置于10 nmol·L-1的檸檬酸鹽緩沖溶液中,90 ℃抗原修復30 min。室溫條件下,自然冷卻并用去離子水緩慢沖洗。采用3%的H2O2溶液孵育10 min后,加入10%的BSA溶液封閉20 min。加入SIGIRR小鼠單克隆抗體和p-NF-κB兔單克隆抗體(工作液體積稀釋比例為1 ∶200),4 ℃條件下孵育過夜。加入對應山羊抗小鼠二抗或者山羊抗兔二抗,室溫條件下孵育30 min。滴加DAB顯色液,顯色后拍照,觀察右肺組織中SIGIRR表達和NF-κB磷酸化水平。
1.2.6Western blot 檢測各組大鼠右肺組織中SIGIRR、NF-κB表達 取各組大鼠右肺組織,PBS潤洗1-2次,離心,加入細胞組織裂解液(體積比為1 ∶5),冰上裂解1 h;4 ℃、12 000×g離心15 min,收集上清液,采用BCA法進行蛋白質濃度定量檢測;然后取各組大鼠右肺組織總蛋白30 μg,上樣至聚丙烯酰胺80 V凝膠電泳,80 V電泳30 min后,轉120 V、電泳60 min。選取目的膠條,采用濕轉轉膜法將目的蛋白轉移至PVDF膜上,轉膜時長2 h,用5%脫脂牛奶室溫封閉2 h,孵育SIGIRR小鼠單克隆抗體(1 ∶1 000),NF-κB兔單克隆抗體(1 ∶1 000),p-NF-κB兔單克隆抗體(1 ∶1 000)以及β-actin小鼠單克隆抗體(1 ∶2 000),4 ℃過夜,孵育對應的山羊抗小鼠二抗或者山羊抗兔二抗(1 ∶5 000)1-2 h;搖床搖晃上加TPBS洗滌3次,5 min/次,然后加入顯影液,顯影并拍照。
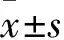
2 結果
2.1 各組大鼠肺組織W/D、IL-1β、IL-6和TNF-α比較與Control組相比,LPS處理組大鼠肺組織W/D以及BALF中IL-1β、IL-6和TNF-α含量均明顯增加(P<0.01),DEX組大鼠肺組織W/D以及BALF中IL-1β、IL-6和TNF-α含量差異差異無統(tǒng)計學意義(P>0.05)。與LPS處理組相比,LPS+DEX組肺組織W/D以及BALF中IL-1β、IL-6和TNF-α含量均明顯降低(P<0.05或P<0.01)(Tab 1)。

Tab 1 Comparison of W/D in lung tissues and contents of IL-1β, IL-6 and TNF-α in BALF of rats in each group n=6)
2.2 各組大鼠肺組織病理學變化Control組和DEX組大鼠肺組織結構完整,肺泡腔輪廓光滑清晰,肺泡間隔無典型性的水腫現象,以及炎癥細胞過度浸潤等情況改變。LPS處理組大鼠肺組織出現明顯的病理性損傷,肺泡結構出現嚴重的破壞,肺泡壁明顯水腫,肺間質增厚并伴有大量的炎癥細胞浸潤。LPS+DEX組大鼠肺組織損傷程度減輕,但是肺泡結構有部分損壞,間質有少許炎癥細胞浸潤并伴有肺泡腔液體滲出等(Fig 1)。
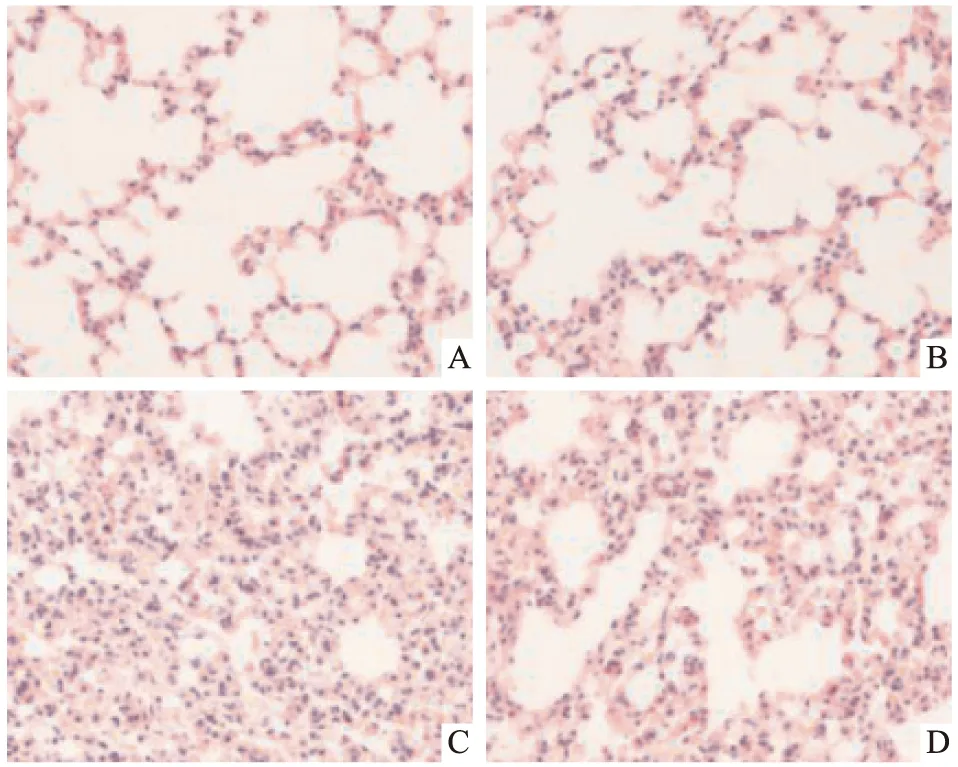
Fig 1 Effect of DEX on histopathological changes of lung tissues in LPS induced ALI rats (×400)A:Control;B:DEX;C:LPS;D: LPS+DEX
2.3 DEX降低LPS誘導大鼠肺組織SIGIRR蛋白降解與Control組相比,LPS處理組大鼠肺組織中SIGIRR表達明顯降低(P<0.01),DEX組大鼠肺組織SIGIRR表達差異無統(tǒng)計學意義(P>0.05)。與LPS組相比,LPS+DEX組大鼠肺組織SIGIRR表達顯著增加(P<0.01)(Fig 2)。
2.4 DEX抑制大鼠肺組織NF-κB磷酸化與Control組相比,LPS處理組大鼠肺組織NF-κB磷酸化活化增強(P<0.01),DEX處理組大鼠肺組織NF-κB磷酸化活化差異無統(tǒng)計學意義(P>0.05)。與LPS組相比,LPS+DEX組大鼠肺組織NF-κB磷酸化活化降低(P<0.05)(Fig 3)。
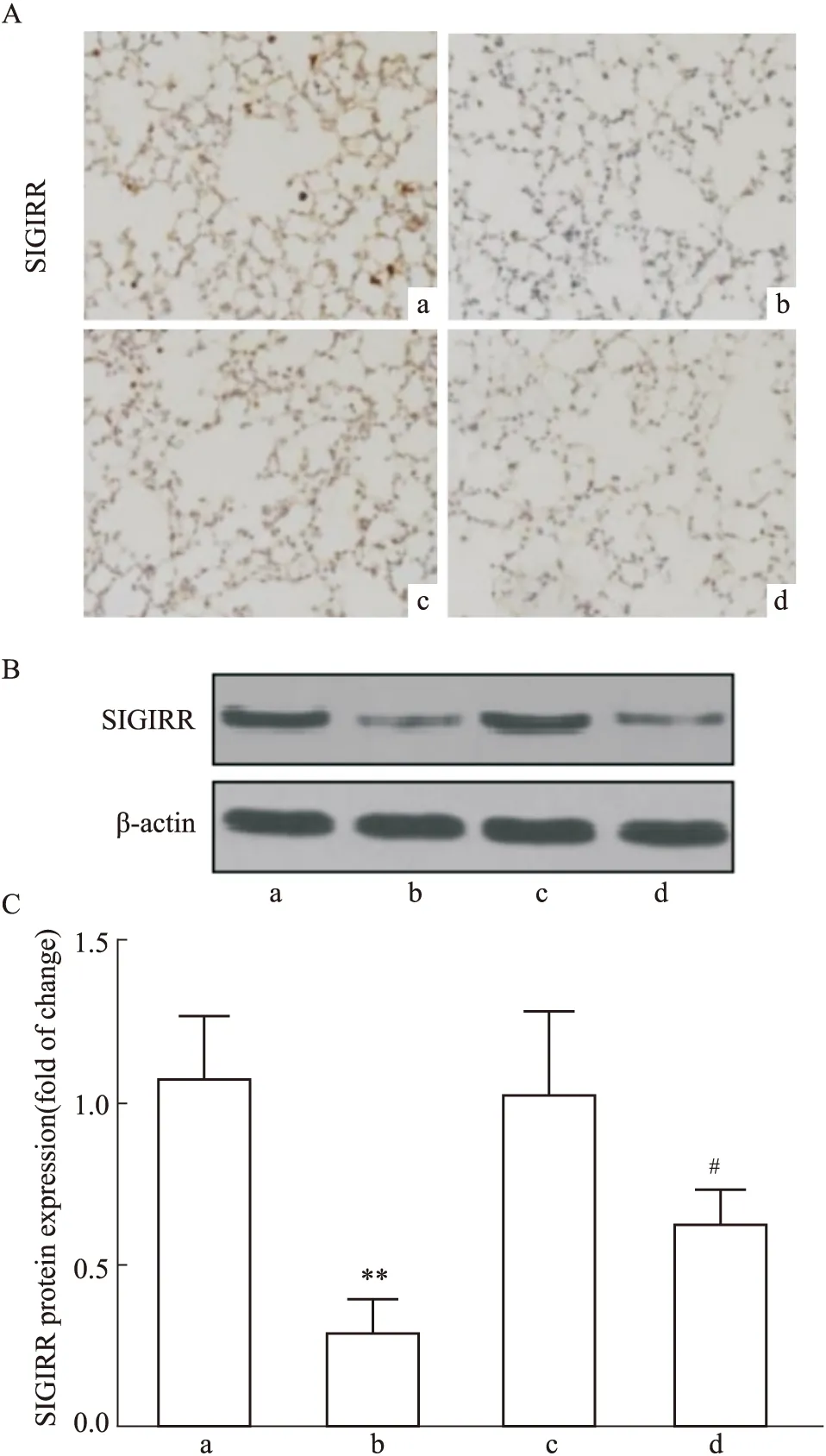
Fig 2 Effect of DEX on expression of SIGIRR of lung tissues in LPS induced ALI rats n=6)

Fig 3 Effect of DEX on expression of NF-κB of lung tissues in LPS induced ALI rats n=6)
3 討論
ALI具有高發(fā)病率和高死亡率,是一種常見的肺部疾病,也是急性呼吸衰竭重要危險因素。炎癥細胞因子過度激活以及促炎介質的過量產生是導致ALI發(fā)生發(fā)展的關鍵因素。其中炎癥性細胞因子IL-1β、IL-6和TNF-α在ALI中發(fā)揮重要作用[9]。研究發(fā)現,IL-1β能夠通過改變肺泡上皮細胞和血管的通透性,誘發(fā)肺部水腫并最終導致ALI[10]。以上研究均表明,炎癥反應的失衡是引發(fā)ALI的關鍵因素。因此,通過探尋藥物有效調控炎癥因子的釋放對于改善ALI誘發(fā)的肺損傷具有重要作用。DEX臨床上具有鎮(zhèn)靜、鎮(zhèn)痛、催眠,對呼吸作用幾乎無抑制作用等特點。新近研究發(fā)現,DEX能夠通過調節(jié)機體免疫功能、降低炎癥細胞因子表達,緩解炎癥反應等作用[11]。在膿毒癥患者中,DEX能夠降低患者血清中炎癥因子水平,緩解機體炎癥[12]。另外,有研究報道DEX能夠減輕膿毒癥大鼠肺水腫程度,其可能通過降低炎癥反應和氧化應激[13]。
SIGIRR基因是位于11號染色體,p15.5號條帶上,其編碼的蛋白質具有Ig細胞外結構域,跨膜結構域,細胞內TIR結構域以及胞內尾區(qū)組成[4]。既往文獻顯示SIGIRR在組織中廣泛表達,主要包括腎臟、消化道、肝臟以及肺組織等,廣泛參與了炎癥、腫瘤相關炎癥和自身免疫性疾病[14]。既往研究發(fā)現,在LPS刺激的肺泡上皮細胞中SIGIRR蛋白表達下調[5]。過表達SIGIRR能夠抑制HMGB1誘導的A549細胞炎癥因子TNF-α和IL-1β,緩解ALI大鼠肺部損傷[15]。本研究首先通過大鼠腹腔注射LPS構建ALI模型,探究DEX對ALI肺部損傷的作用機制。結果顯示,與Control組相比,LPS處理組大鼠肺組織W/D以及BALF中IL-1β、IL-6和TNF-α含量均明顯增加,DEX組大鼠肺組織W/D以及BALF中IL-1β、IL-6和TNF-α含量無明顯變化。病理學染色顯示Control組和DEX組大鼠肺組織結構無明顯改變,結構完整,肺泡腔輪廓清晰,肺泡間隔無明顯水腫以及炎癥細胞浸潤等情況改變。LPS處理組大鼠肺組織出典型的病理學改變,以上結果表明ALI模型構建成功。與LPS處理組相比,LPS+DEX組肺組織W/D以及BALF中IL-1β、IL-6和TNF-α含量均明顯降低,病理損傷減輕,表明DEX能夠通過降低肺部炎癥反應,緩解LPS誘導的ALI肺部損傷。為進一步探究DEX對LPS誘導ALI的作機制涉及SIGIRR基因。本研究通過免疫組化和Western blot檢測各組大鼠肺組織SIGIRR蛋白表達,結果顯示,與Control組相比,LPS處理組大鼠肺組織中SIGIRR表達明顯降低,DEX組大鼠肺組織SIGIRR表達差異無統(tǒng)計學意義。與LPS組相比,LPS+DEX組大鼠肺組織SIGIRR表達明顯增加,表明DEX可能通過降低LPS誘導SIGIRR降解,降低IL-1β、IL-6和TNF-α,進而緩解ALI肺損傷。NF-κB被研究證實作為炎癥反應中心成員之一,能夠激活炎癥細胞因子。既往研究過表達SIGIRR可以抑制LPS誘導的肺泡上皮細胞NF-κB活化,降低炎癥反應,從而誘發(fā)肺泡保護作用[16]。而在本實驗中我們發(fā)現LPS組大鼠肺組織NF-κB活化增加,LPS+DEX組肺組織NF-κB活化降低。TLR信號觸發(fā)后,可以通過MyD88依賴性途徑和MyD88肺依賴性途徑激活NF-κB。
綜上所述,DEX能夠降低IL-1β、IL-6和TNF-α表達,抑制炎癥反應,從而緩解ALI肺損傷,其機制可能與降低LPS誘導SIGIRR降解,從而抑制NF-κB轉錄活性有關。

