放射式沖擊波在軟組織中傳播特性的有限元分析
趙 徹, 劉慧力, 王照智, 馮 春
(1.常州工學院航空與機械工程學院, 常州 213032; 2.吉林大學工程仿生教育部重點實驗室, 長春 130025; 3.沈陽工業大學機械工程學院, 沈陽 110870)
隨著人口老齡化的深入,關節炎和肌腱炎等軟組織慢性損傷性疾病呈高發態勢,已成為康復醫學研究的重點課題[1]。與傳統的藥物和按摩治療相比,放射式體外沖擊波治療(radial shock wave therapy,rESWT)具有易于操作、安全和治療費用低等特點,在軟組織損傷性疾病的治療方面已得到廣泛認可[2]。大量的臨床研究已經證明,rESWT在足底筋膜炎[3]、肩鈣化肌腱炎[4]和慢性跟腱炎[5]等多種軟組織損傷性疾病的治療中療效顯著。
然而,rESWT修復軟組織損傷、緩解疼痛的具體機制尚不明確,治療方案的制定主要依靠臨床醫生的經驗和患者的主觀感受。Walewicz等[6]采用隨機和單盲試驗評估了rESWT對下腰痛患者的影響,表明與傳統的運動改善計劃相比,使用rESWT對減輕疼痛和改善總體功能狀態具有長期的重大影響。Zhang等[7]將rESWT與藥物在治療慢性盆腔疼痛綜合征的效果進行了對比,表明rESWT的治療效果更佳,癥狀復發率也更低。然而,要想制定更合理的治療方案,開發更先進的治療儀,仍需要對病患目標部位的生物學反應與特定治療劑量(壓強和能流密度等)間的關系進行量化分析[8-9]。
為解決上述問題,首先要了解放射式沖擊波的傳播特性。近年來,中外科研人員圍繞這一問題開展了研究工作。Perez等[10]使用光纖探頭水聽器對ESWT體外沖擊波治療(extracorporeal shock wave therapy,ESWT)設備在水中產生的聲場進行表征,得出焦點處的峰值正壓范圍為2~45 MPa。Payne等[11]使用聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膠墊模仿人體軟組織,對沖擊波在其中的傳播數據進行了測量,結果表明介質的力學性能對沖擊波的傳播特性具有顯著影響。Liu等[12]使用柔性膜傳感器分別對放射式沖擊波在金屬薄片、水和動物組織中的傳播數據進行了測量,結果表明不同的測量介質對沖擊波的傳播數據影響較大。
綜上所述,為降低測量難度和規避醫學倫理風險,科研人員主要應用水或硅膠等標準介質代替軟組織測量放射式沖擊波的傳播數據,其結果與體內的真實情況差距較大。此外,目前仍缺少量化沖擊波在非均勻介質中三維傳播數據的技術手段。因此,亟需新的理論與方法來解決這一難題。
有限元分析法已廣泛應用于軟組織的生物力學分析,尤其適合研究常規手段無法觀測到的微觀力學響應。李飛等[13]通過數值模擬接觸分析研究了髖臼周圍截骨術中動步態的軟骨層接觸壓力和接觸面積,表明髖臼周圍截骨術后能明顯的改善軟骨層接觸壓力分布,為髖臼周圍截骨術提供生物力學參考數據。楊得富等[14]基于有限元分析方法,建立耦合電磁場和生物傳熱過程的微波消融模型,研究了單縫同軸微波消融天線在多種腫瘤中的SAR值、消融區域溫度分布及消融灶形態,為提高腫瘤消融治療效果提供了理論支持。王方等[15]采用人體胸部有限元模型,基于胸腔骨骼和軟組織的多個材料參數,進行正面沖擊載荷下的胸部碰撞模擬,分別輸出主要的胸部響應參數值,并采用標準多項式擬合方法詳細對比分析了胸部材料參數發生變化時胸腔的不同響應。
為此,將有限元分析法應用于放射式沖擊波在軟組織中傳播特性的表征與分析中:建立包含皮膚、脂肪,肌肉和骨骼的數值計算模型,揭示放射式沖擊波在多層軟組織中的傳播特性,獲取不同目標位置的壓強和能流密度等關鍵信息,驅動氣壓、治療探頭與皮膚的耦合方式,以及治療探頭幾何形狀等因素對沖擊波作用效果的影響。相關成果將為解決放射式沖擊波在軟組織中傳播特性難以量化分析的難題提供新的解決方案,也將為患者提供針對性更強、更加安全有效的治療方案,以及新型rESWT設備的研發,提供了重要參考。
1 建模與仿真
1.1 仿真模型的建立
如圖1所示,rESWT的原理是子彈在壓縮空氣的推進下在彈道中以高速撞擊治療探頭并產生放射式沖擊波,進而傳入人體軟組織。根據這一原理,僅對子彈高速碰撞治療探頭的瞬間進行建模仿真。在CATIA V5中完成子彈、治療探頭(D20型)、保護殼,密封圈和阻尼器的建模,并組成裝配體,保持子彈和治療探頭同心。其中,子彈直徑為6 mm,高度為16 mm,治療探頭的最大直徑為20 mm,凸面高度為0.7 mm。之后,建立包含皮膚層、脂肪層,肌肉層和皮質骨的多層生物組織模型,作為放射式沖擊波治療儀的作用對象。由于模型具有對稱性,只取其1/2部分導入有限元分析軟件ABAQUS中。
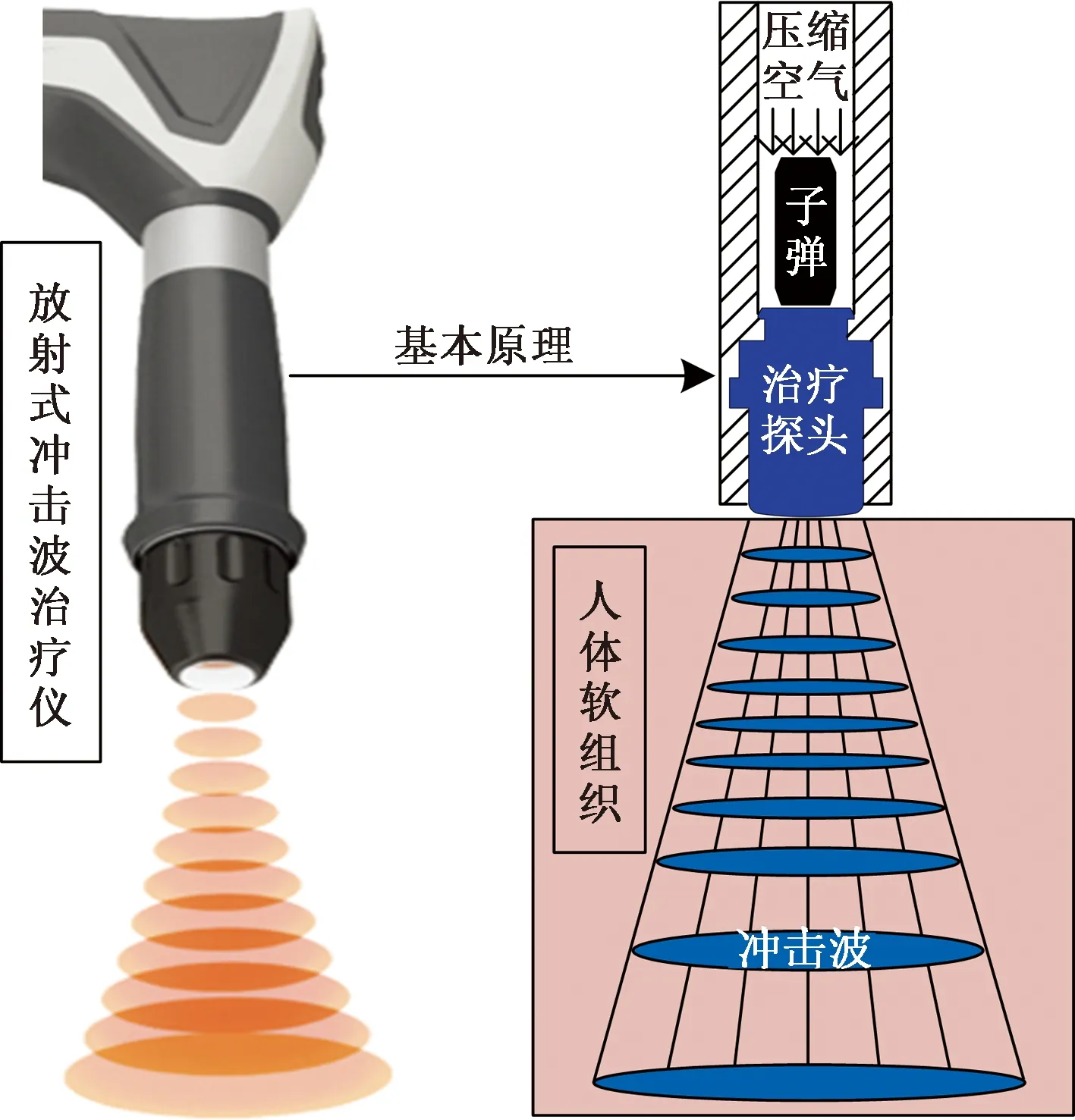
圖1 放射式體外沖擊波治療儀的基本原理
為提高計算效率,降低沙漏效應和體積自鎖效應的影響,采用8節點六面體網格、線性縮減積分、沙漏控制單元(C3D8R)對模型進行網格劃分。經過網格的收斂性檢驗,并綜合考慮計算效率和精度,除治療探頭與軟組織接觸的部位采用網格加密處理外,其余網格單元尺寸均設定為0.8 mm。有限元模型整體如圖2所示,共包含349 628個網格單元。

圖2 有限元模型
1.2 賦予材料屬性
在放射式沖擊波治療儀中,子彈和治療探頭均為304不銹鋼材料(楊氏模量2.1×1011Pa,泊松比0.3)。密封圈和阻尼器由硅橡膠材料制成,其力學性能可用超彈性材料模型Mooney-Rivlin中的3個常量C10(1.933×106Pa)、C01(0.483×106Pa)和D1(1.0×10-9Pa-1)表征。為節約計算資源,將保護殼的材料屬性設置為剛體。根據生物軟組織力學性能的相關研究結果[16-17],皮膚、脂肪和肌肉可用一階Ogden橡膠材料模型表征,特征常量為μ和α,具體參數如表1所示。相對剛性的皮質骨簡化為線彈性模型(楊氏模量1.2×1010Pa,泊松比0.3)。

表1 軟組織的力學性能參數
1.3 邊界條件設置與數值計算方法
在ABAQUS軟件中對有限元模型施加載荷和邊界條件。根據流體動力學試驗結果[18],在預定義場中設定不同驅動氣壓作用下子彈的初速度。子彈與治療探頭,治療探頭與密封圈和阻尼器之間均采用表面-表面法向硬接觸。為研究耦合方式對放射式沖擊波的影響,采用兩種方式設置治療探頭與皮膚層間的接觸類型;一種是綁定約束,用來模擬皮膚表面涂有超聲波耦合劑,與治療探頭完全貼合的情況。一種是表面-表面法向硬接觸,用來模擬治療探頭直接作用與干燥的皮膚表面。用綁定約束模擬皮膚、脂肪、肌肉和皮質骨間的粘連狀態。最后,在ABAQUS的Dynamic/Explicit求解器中進行數值計算,最小分析步設定為1.0×10-8s。
2 仿真結果與分析
2.1 放射式沖擊波在軟組織中的傳播規律
圖3為驅動氣壓為0.3 MPa時D20型治療探頭產生的沖擊波在多層組織模型中的傳播信息,t為碰撞開始后的時間。當t=2 μs時,沖擊波仍在治療探頭內傳播。當t=10 μs時,隨著子彈與治療探頭的分離,駐波開始傳入皮膚層。當t=20 μs時,首個包含正壓(紅色)和負壓(藍色)的沖擊波在軟組織中產生,波長為18 mm,且波前已到達脂肪層。當t=40 μs時,沖擊波呈明顯的放射式傳播,且影響范圍逐漸擴大,波前到達肌肉層。
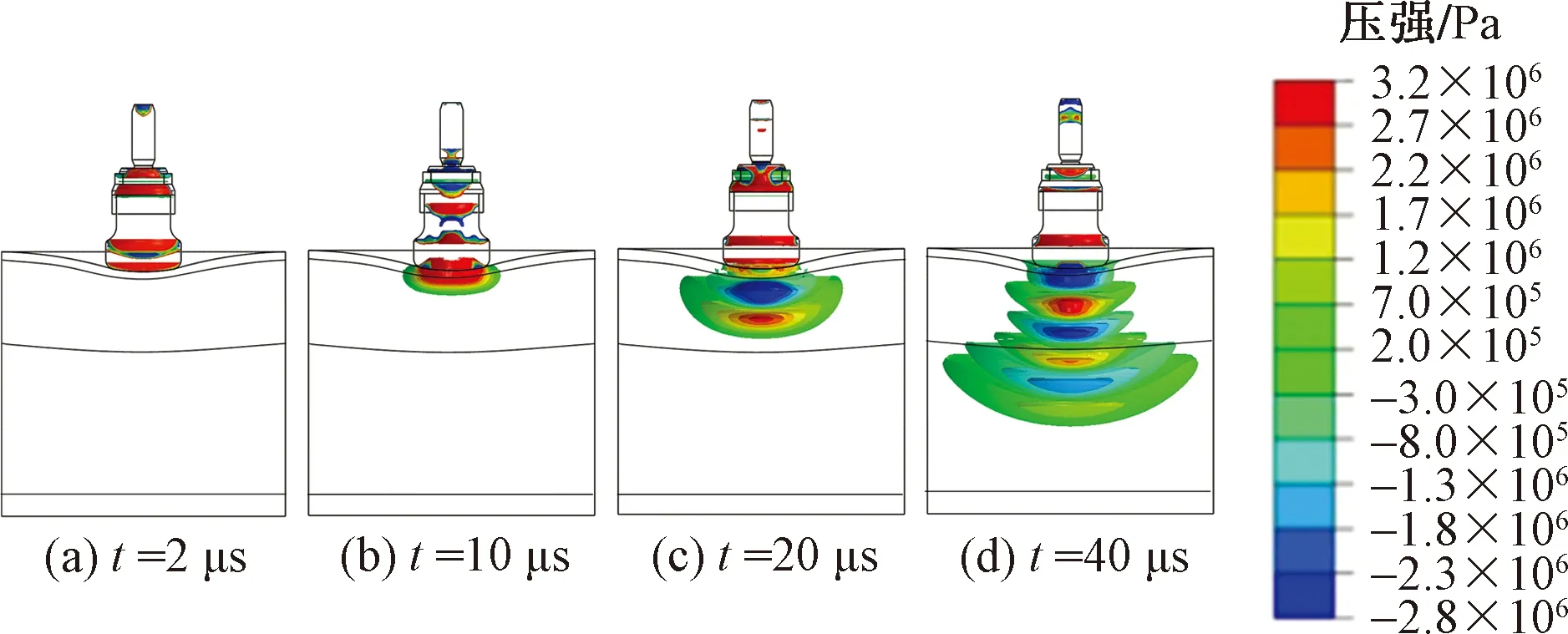
圖3 放射式沖擊波在軟組織模型中的傳播信息
應用有限元分析法可展示多層軟組織模型中任意單元格內沖擊波的波形數據。圖4為沖擊波在皮膚層與治療探頭接觸處網格單元中的波形,由于皮膚的聲阻抗要遠小于不銹鋼材料,所以沖擊波的振幅值縮小了一個數量級,但皮膚層中的最大正壓強(P+)仍達到6.22 MPa。皮膚中密布大量的感覺神經末梢,所以在使用放射式沖擊波體外治療儀進行治療時,患者普遍會感到刺痛。
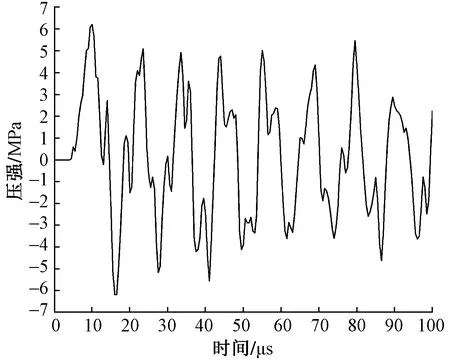
圖4 放射式沖擊波在皮膚層中的波形圖
圖5為放射式沖擊波傳播至肌肉層時網格單元中的波形圖。從圖5可以看出,由于皮膚、脂肪和肌肉組織的阻抗效應,在深度為50 mm時,P+急劇下降,僅為1.26 MPa。由圖5中的數據還可計算出放射式沖擊波在軟組織中傳播的平均速度為1 500 m/s。將放射式沖擊波的壓強隨傳播深度變化如圖6所示,可以看出,沖擊波的P+和P-(最大負壓強)受軟組織阻抗效應的影響隨傳播深度的增加呈現梯度減小的趨勢。
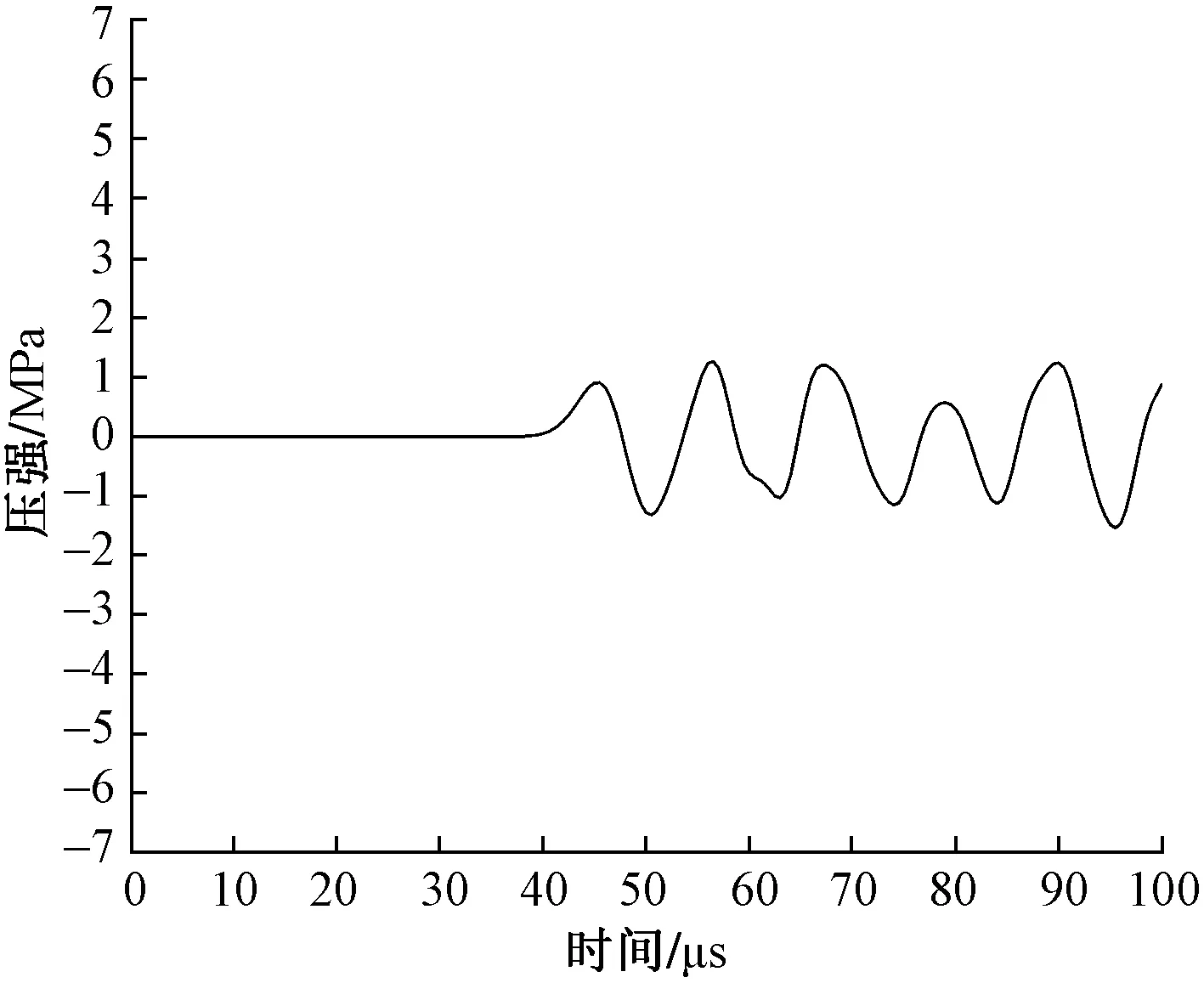
圖5 放射式沖擊波在深度為50 mm的肌肉層中的波形圖

圖6 放射式沖擊波的壓強隨傳播深度變化的規律
能流密度(EFD)是衡量放射式沖擊波治療效果的重要量化指標之一,其計算公式為
(1)
式(1)中:ρ為傳播介質的密度;CL為沖擊波在介質中的傳播速度(CL=1 500 m/s);P為沖擊波的壓強。根據有限元仿真結果并結合式(1)計算得到的能流密度如圖7所示。從圖7可以看出,與壓強相比,放射式沖擊波的能流密度受生物軟組織阻抗效應的影響更加顯著,從皮膚表層傳播至深度50 mm處時,EFD從最高時的0.47 mJ/mm2逐漸降低至0.024 mJ/mm2,且受多層軟組織內材料密度變化的影響,曲線的斜率也呈現逐漸降低的趨勢。
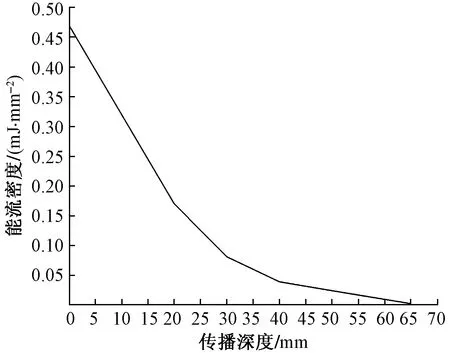
圖7 放射式沖擊波的能流密度隨傳播深度變化的規律
2.2 耦合方式對沖擊波傳播特性的影響
在臨床實踐中,需要先在患處皮膚表面涂抹超聲波耦合劑,使治療探頭與皮膚完全貼合后再啟動儀器。然而,一些患者在家庭中使用治療儀時往往省略這一步驟。因此,有必要研究治療探頭與皮膚間的耦合方式對治療效果的具體影響。
圖8為治療探頭在兩種耦合方式下皮膚層產生的沖擊波波形。如圖8中紅色曲線所示,子彈的高速碰撞會使治療探頭產生振動(周期為500 μs),在缺少耦合劑黏合的情況下會與干燥的皮膚表面產生短暫分離,導致后續的沖擊波無法連續傳入組織。雖然最大正壓強P+仍可達6.22 MPa,但由式(1)計算得到的能流密度值僅為0.016 mJ/mm2,幾乎不會產生治療效果。
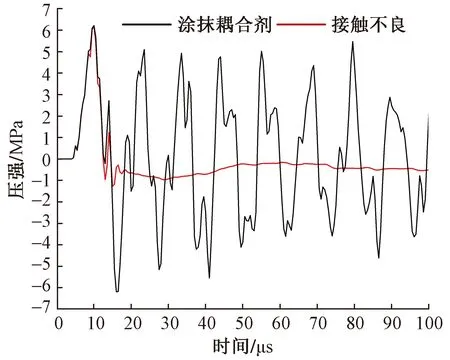
圖8 耦合方式對放射式沖擊波波形的影響
結果表明,在治療探頭與皮膚表面接觸不良的情況下,雖然患者會感受到刺痛,但放射式沖擊波產生的能量無法傳入組織內部,導致治療失敗。因此,在皮膚表面涂抹耦合劑,是放射式體外沖擊波治療儀發揮治療效果的必要條件。
2.3 驅動氣壓對沖擊波傳播特性的影響
通過改變壓縮空氣的氣壓來改變子彈的初速度,進而對沖擊波進行調制,可以更好地針對不同部位的軟組織損傷進行治療。然而,目前仍沒有有效的方法來評估這種調制方式的有效性和準確性。因此,本文利用有限元仿真法針對這一問題進行研究。參照流體動力學的試驗結果[18],在ABAQUS軟件的LOAD模塊中將子彈的初速度設置為9、12.3、14.9、17.81 m/s,對應的驅動氣壓分別為0.1、0.2、0.3、0.4 MPa。
圖9為在同一時刻(50 μs)4種驅動氣壓下的rESWT產生的放射式沖擊波的仿真結果。從中可以發現,雖然rESWT產生的沖擊波在三維形態上未發生顯著變化,但隨著驅動氣壓的增加,其影響范圍逐漸擴大,同一位置處的強度也隨之增大。圖10為4種驅動氣壓下放射式沖擊波在皮膚層中的波形,雖然波形在整體形態上具有相似性,但其壓強隨驅動氣壓的增加而明顯增強,P+從驅動氣壓為0.1 MPa時的3.02 MPa提高至驅動氣壓為0.4 MPa時的8.74 MPa,即驅動氣壓越高,患者感受到的刺痛感越強。

圖9 驅動氣壓為0.1~0.4 MPa的治療儀輸出的放射式沖擊波
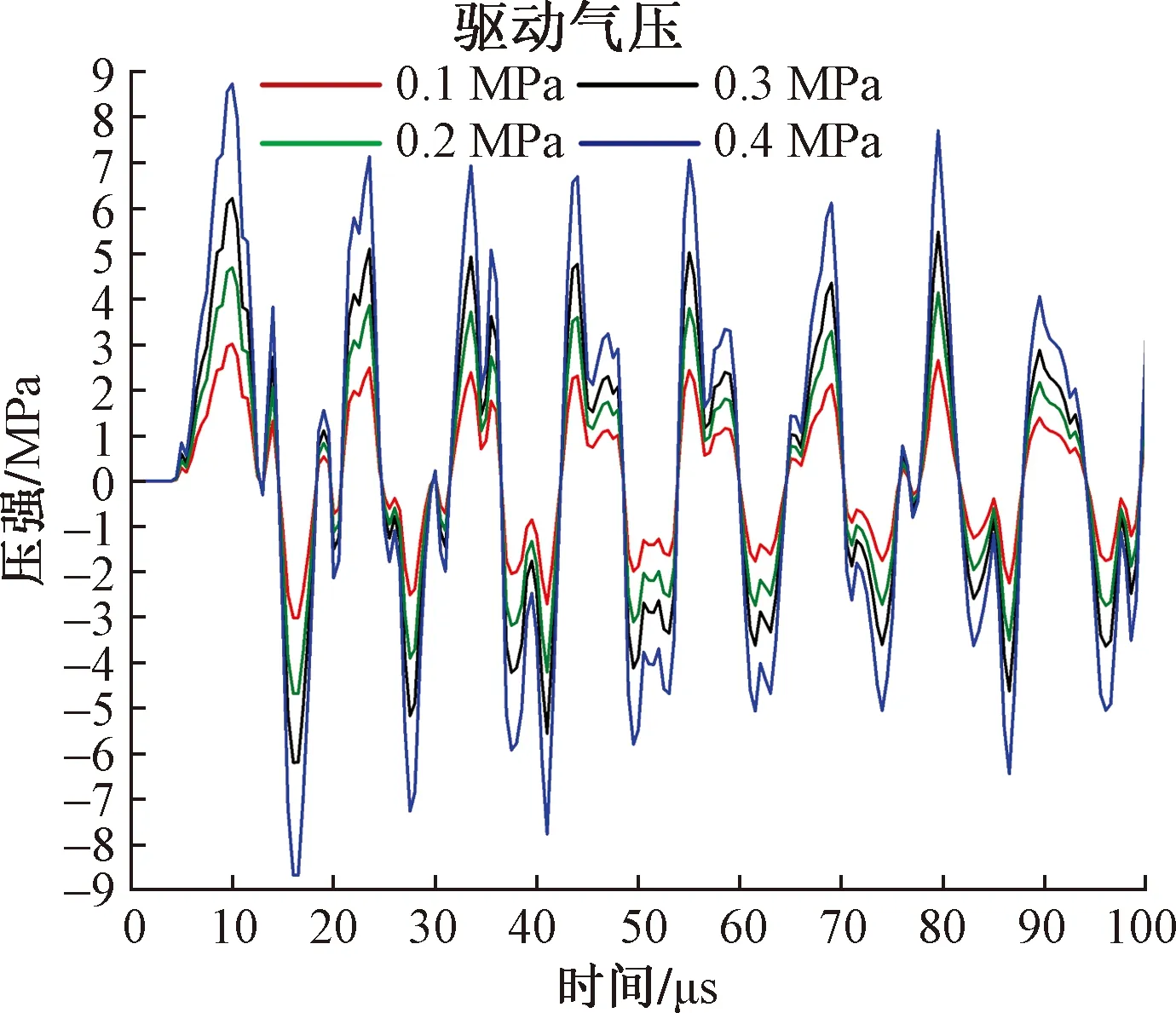
圖10 不同驅動氣壓作用下沖擊波的波形圖
圖11為4種驅動氣壓下下放射式沖擊波的能流密度(EFD)隨傳播深度變化的規律。可見,驅動氣壓的提高可顯著增加放射式沖擊波的傳播深度。Rompe等[19]將體外沖擊波治療儀產生的能流密度劃分為3級:高能量區大于0.60 mJ/mm2、中等能量區在0.28~0.60 mJ/mm2范圍、低能量區在0.08~
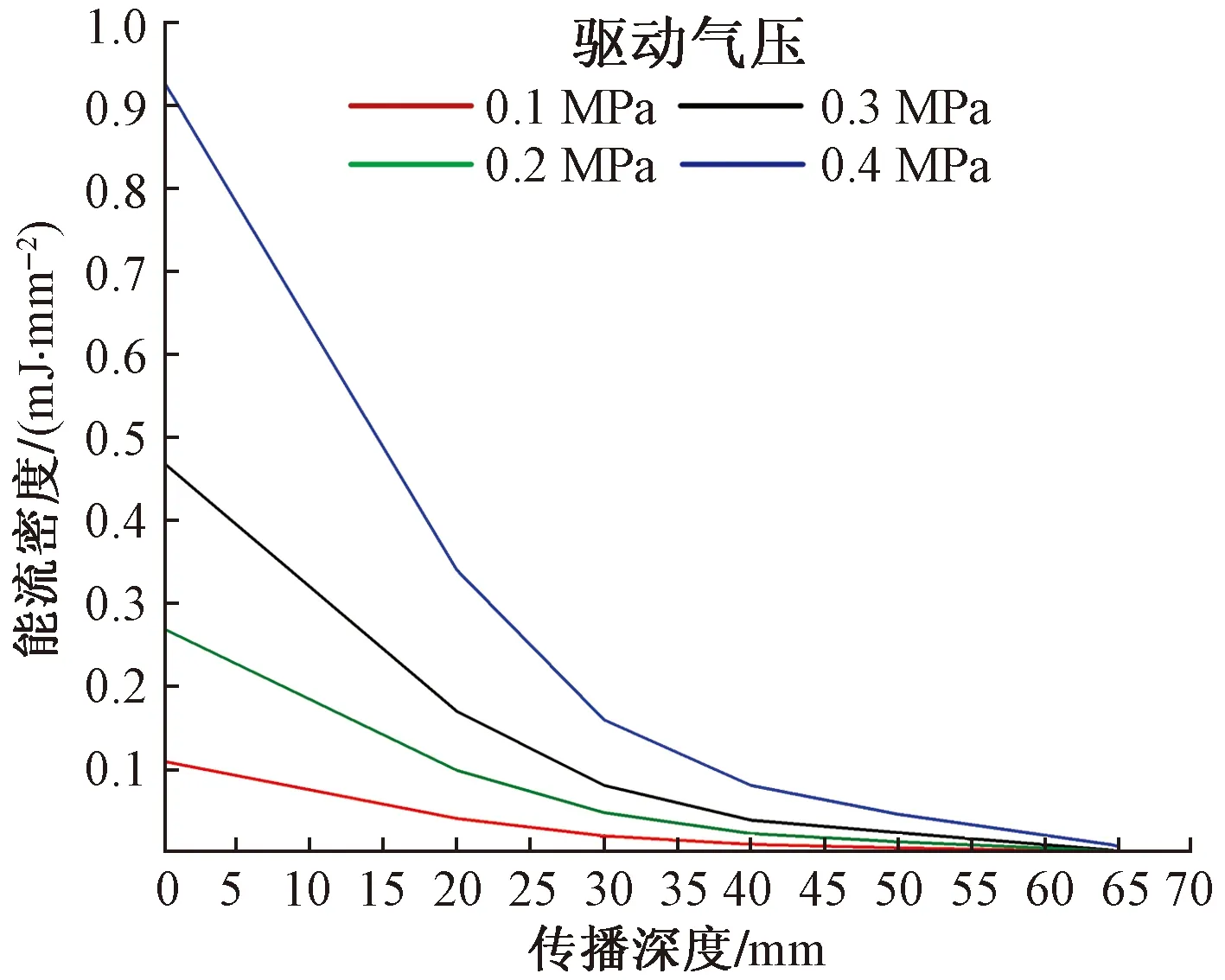
圖11 不同驅動氣壓作用下沖擊波的能流密度隨傳播深度變化的規律
0.28 mJ/mm2范圍。如能流密度小于0.08 mJ/mm2則幾乎不會產生治療效果。根據這一標準,當驅動氣壓較低時(0.1 MPa),即使是皮膚層產生的沖擊波仍屬于低能量區。而將驅動氣壓提高至0.4 MPa時,軟組織模型中11~25 mm深的部位仍為中等能量區,低能量區更是可以深入41 mm處。
仿真結果在rESWT的臨床實踐中具有一定的指導意義。對于跟腱炎和網球肘等淺層的軟組織損傷,以及病患為兒童或老人的情況,可以采用低驅動氣壓(0.1~0.2 MPa)進行治療,在達到治療效果的同時還能盡量減少病患的痛苦。而對于肩膀和大腿肌肉深層的軟組織損傷,以及病患為肌肉發達的運動員或肥胖人群的情況,應采用高驅動氣壓(0.3~0.4 MPa),使放射式沖擊波產生的能量能夠傳達患處,以保證治療效果。
2.4 治療探頭幾何結構對沖擊波傳播特性的影響
除調節驅動氣壓外,改變rESWT治療探頭的幾何結構也可以對放射式沖擊波的傳播特性起到調制作用,從而提高針對不同部位軟組織損傷的治療效果。然而,由于缺少對沖擊波在人體內傳播數據的直接測量方法,新型治療探頭的研發仍主要依靠患者的主觀反饋和醫生的臨床經驗,其效率和有效性都難以保證。
所提出的有限元分析法可以為解決這一難題提供新思路,即通過對具有不同幾何結構的治療探頭產生的放射式沖擊波進行模擬仿真,研究其傳播特性。作為對比,將R15即(即頭部直徑為15 mm)型和D35型(即頭部直徑為35 mm)治療探頭的幾何信息導入ABAQUS軟件中進行有限元仿真,當驅動氣壓為0.3 MPa時,其結果如圖12所示。
從圖12(a)可以看出,與頭部直徑為20 mm的D20型治療探頭[圖12(b)]相比,在相同條件下,R15型治療探頭產生的放射式沖擊波形態更加規整,能量更為集中,但影響范圍有所減少。由式(1)的計算結果可知,R15型產生的能流密度(EFD)最大值為0.38 mJ/mm2,有效傳播深度為28 mm,均小于D20型(0.48 mJ/mm2,38 mm)。因此,R15型探頭更適合治療肌腱炎和跟骨骨刺等深度較淺且范圍較小的軟組織損傷。
從圖12(b)可以看出,與D20型和R15型相比,在相同條件下,D35型治療探頭產生的放射式沖擊波的影響范圍更廣,且由于結構中存在較大的幾何突變,沖擊波在探頭內部反射、疊加,造成其在組織中的傳播形態更為復雜。由式(1)的計算結果可知,D35型產生的能流密度(EFD)最大值為0.46 mJ/mm2,有效傳播深度為37 mm,與D20型十分接近。因此,D35型探頭更適用于面積較大的深層肌肉痛點。

圖12 R15型、D35型治療探頭產生的放射式沖擊波的傳播信息
仿真結果證明,應用有限元分析法可直觀的展示治療探頭的幾何結構對放射式沖擊波傳播特性的影響,并對其治療效果進行初步評估,為新型治療探頭的研發提供重要參考。
3 結論
通過對放射式沖擊波在軟組織中傳播特性的有限元分析得到以下結論。
(1)應用有限元分析法可以有效地模擬放射式沖擊波在生物軟組織中的傳播特性,其在軟組織中產生的最大正壓、負壓強在10 MPa以內,波長約為18 mm,傳播速度為1 500 m/s,且由于軟組織的阻抗效應,其壓強和能流密度隨傳播深度的增加而逐漸降低。
(2)在皮膚與治療探頭的接觸表面涂抹超聲波耦合劑,是放射式體外沖擊波治療儀發揮療效的必要條件,如治療探頭與皮膚表面接觸不良,則放射式沖擊波的能流密度將會大大減小,且無法傳入深層組織。
(3)通過調節rESWT的驅動氣壓可以有效調控放射式沖擊波的強度與傳播深度。驅動氣壓較低時,沖擊波僅會對淺層的軟組織損傷產生治療效果,而提高驅動氣壓則有助于沖擊波傳入更適深層組織。
(4)應用限元分析法可以針對具有不同幾何結構的治療頭產生的放射式沖擊波進行模擬仿真,直觀的展示幾何結構對放射式沖擊波傳播特性的影響,并對其治療效果進行初步評估,為新型治療探頭的研發提供重要參考。

