糖酵解調控雞體外PGCLC形成的功能研究
張晨 左其生 鄒藝琛 趙娟娟 張亞妮 李碧春
(揚州大學農業科技發展研究院 教育部農業與農產品安全國際合作聯合實驗室 揚州大學動物科學與技術學院,揚州 225009)
原始生殖細胞(primordial germ cell,PGC)的形成需要多種因素的參與,從遺傳的角度來說,基因表達、信號傳導、表觀遺傳修飾等都對PGC的形成具有調控作用。不僅如此,Brinster等[1]提出PGC (小鼠)具有特別的能量代謝方式——偏愛丙酮酸氧化而不能氧化葡萄糖。因此代謝變化也可能參與PGC的形成。
相比遺傳和表觀遺傳因素的調控,代謝方式的變化對表型變化的影響更為直接和明顯。研究發現能量代謝方式在不同細胞中并不相同,大多的癌細胞中[2]能量代謝方式主要以糖酵解途徑為主,氧化磷酸化途徑不參與癌癥發生過程;而正常細胞通常以線粒體氧化磷酸化產能,而不依賴糖酵解途徑[3]。在PGC細胞中也同樣表現為氧化磷酸化為主的能量代謝模式[4];在精原干細胞(spermatogonial stem cell,SSC)中,為了維持其自我更新能力,細胞通常利用糖酵解途徑進行產能[5]。這種現象提示我們能量代謝模式的改變可能影響細胞的命運決定。重編程過程印證了這一猜想,體細胞的氧化磷酸化代謝轉變為iPS的糖酵解依賴代謝模式是多能性獲得的基礎[6]。因此代謝組的重組可能是引起細胞分化的原因。然而代謝途徑的變化在PGC形成中的調控研究尚不明確。
甲萘醌VK3可通過單電子還原反應,產生半醌基團;或通過雙電子還原得到氫醌。通過醌的氧化還原循環可產生活性氧簇等,增加氧化還原反應[7]。研究表明,VK3可作為丙酮酸激酶PKM2的專一性抑制劑,而不抑制PKL和PKM1,有效抑制糖酵解途徑[8]。然而對VK3功能的研究主要集中在對癌癥的抑制效果上[9-10],在細胞分化中的調控作用還未有研究。相反,研究表明[11-12]DASA58可靶向激活PKM2,PKM2是參與糖酵解過程的糖酵解酶,可催化合成丙酮酸和ATP,因此DASA58被認為是糖酵解途徑的激活劑,在癌癥發生和免疫過程的研究中較為常見,其在細胞分化中的功能還不得而知。
為了研究PGC形成機制,本研究前期建立了BMP4體外誘導模型[13],BMP4能夠通過BMP4信號促進體外雞胚胎干細胞(embryonic stem cells,ESC)向原始生殖細胞樣細胞(primordial germ cell,PGCLC)的分化,而BMP4信號抑制糖酵解途徑關鍵激活劑 GSK的功能[14],因此推測糖酵解可能參與PGC的形成。本研究對體外誘導過程中糖酵解相關基因的表達進行檢測;在添加糖酵解激活劑和抑制劑后,qRT-PCR檢測了相關基因的表達及類胚體/PGC-like的形成,以期為深入研究代謝系統在PGC形成中的調控機制奠定研究基礎和提供理論依據。
1 材料與方法
1.1 材料
細胞及主要試劑 新鮮受精蛋來自中國農業科學院家禽研究所試驗禽場如皋黃雞。ESCs由實驗室分離所得。高糖DMEM、Knockout培養基、胎牛血清、雞血清、丙酮酸鈉購自Gibco公司(美國);β-巰基乙醇、L-谷氨酰胺、非必需氨基酸、bFGF、hSCF購自Sigma(美國);mLIF 購自millipore(德國);BMP4購自ProSpec(以色列)、VK3購自Macklin(中國)、DASA58購自MCE(美國)。
青鏈霉素購自(北京)索萊寶科技有限公司;TRNzol Universal 總 RNA 提取試劑、反轉錄試劑盒、定量試劑盒購自天根生化科技(北京)有限公司;DDX4購自Abcam。
ESC因子培養基:Knockout DMEM+10%胎牛血清+0.1 mmol/L β-巰基乙醇+1 mmol/L丙酮酸鈉+2 mmol/L的L-谷氨酰胺+1%非必需氨基酸+1 000 IU/mL LIF+10 ng/mL bFGF+5 ng/mL SCF+1×青鏈霉素+2%雞血清。
BMP4誘導培養基:高糖DMEM+1×非必需氨基酸+0.1 mmol/L β-巰基乙醇+1×青鏈霉素+1 mmol/L丙酮酸鈉+ 10 ng/mL LIF+40 ng/mL BMP4+50 ng/mL EGF。
1.2 方法
1.2.1 ESC細胞誘導 收集0 d的種蛋,藥匙法獲得雞胚胚盤,ESC因子培養基吹散成細胞懸液,經400目濾布過濾后收集細胞,接種至60 mm培養皿,差速培養12 h,收集上清,接種至24孔板,體外擴增、傳代、備用[15-16]。將傳至第2代的ESCs以2×105個/孔接種于24孔板中,更換培養基為BMP4誘導培養基,接種至24孔板中,培養6 d,每隔2 d添加200 μL培養基。實驗分組為:BMP4組,BMP4+VK3組,BMP4+DASA58組。
1.2.2 細胞形態觀察 在細胞誘導的第6天觀察細胞形態,分別記錄20×10和40×10倍鏡下的細胞形態變化并進行拍照。利用Image J對20×10倍鏡下的類胚體數量進行統計。
1.2.3 RNA提取 將收集的細胞置于1.5 mL無酶管中,加入1 mL Trizol進行裂解,用移液器吹勻細胞,在室溫靜置5 min。加入200 mL氯仿,蓋緊蓋子后,劇烈振蕩15 s,室溫靜置2 min。冷凍離心機中4℃ 12 000×g離心15 min。小心打開管蓋,緩慢吸取400 μL上清,加入等體積異丙醇,輕輕混勻,在室溫靜置10 min。冷凍離心機中4℃ 12 000×g離心10 min,棄去上清。加入1 mL 75%的乙醇,輕輕混勻,此時可見白色RNA沉淀。冷凍離心機中4℃ 7 500×g離心5 min,棄去上清。晾干RNA,加入20 μL無酶水溶解。置于60℃促溶10 min,獲 得RNA。
1.2.4 qRT-PCR 分別收集誘導2 d、4 d和6 d的細胞,Trizol裂解后提取RNA。利用天根反轉錄試劑盒將RNA反轉錄為cDNA,參照天根實時熒光定量PCR試劑說明書進行定量檢測目的基因的表達。引物序列參照表1。
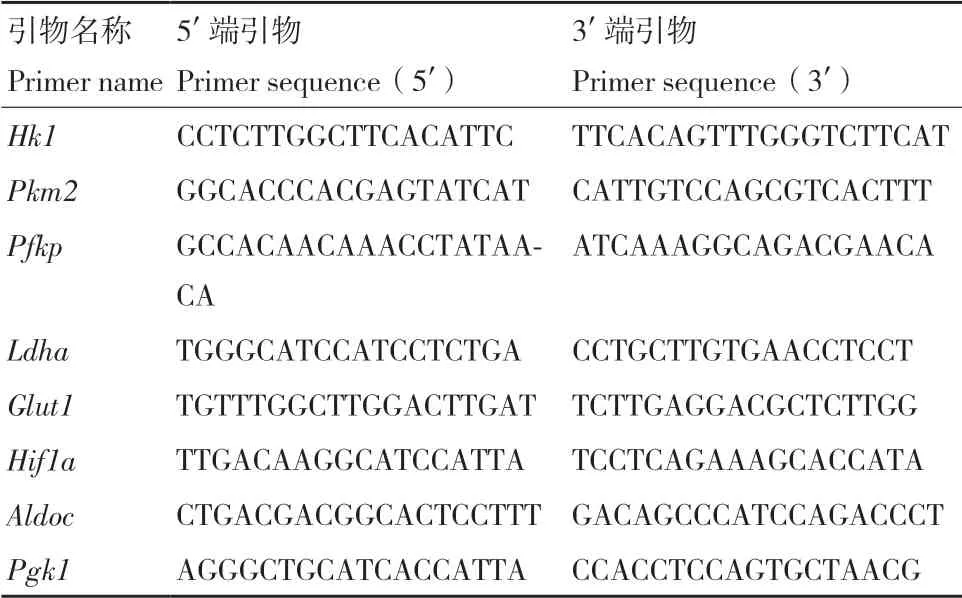
表1 qRT-PCR引物Table 1 Primers used for qRT-PCR
1.2.5 流式細胞分析 收集誘導至6 d細胞,PBS清洗后,加入10%FBS的PBS 37℃封閉2 h,PBS清洗3次后,用一抗進行孵育,37℃孵育2 h或4℃過夜。PBS清洗3次后,用對應的二抗進行孵育,37℃孵育2 h。PBS清洗3次后,上機檢測。
1.2.6 數據分析 利用SPSS統計軟件建立數據庫并處理數據,數據組間差異用單因素方差分析,采用LSD法進行多重比較,試驗數據以P<0.05為差異顯著,P<0.01為差異極顯著。結果以平均值形式表示。
2 結果
2.1 雞PGC-like細胞形成中糖酵解相關基因低 表達
在體外雞ESC誘導形成PGC-like的不同時間點對糖酵解過程相關基因的表達進行檢測,qRTPCR檢測結果顯示,誘導第6天時,糖酵解相關基因Pgk1的表達顯著降低(P<0.05),Hk1、Pkm2、Ldha、Glut1、Pfkp和Aldoc的表達極顯著降低(P<0.01)(圖1)。以上結果說明在PGC-like形成過程中糖酵解過程被抑制。
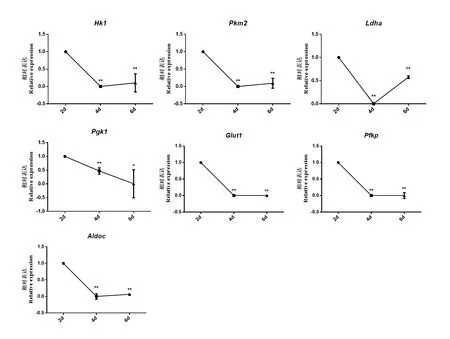
圖1 PGC-like形成中糖酵解相關基因的表達Fig. 1 Expression of glycolysis-related genes in the formation of PGC-like
2.2 糖酵解激活劑/抑制劑調控糖酵解過程
為研究糖酵解過程在PGC-like形成中發揮的作用,本研究將糖酵解抑制劑VK3和糖酵解激活劑DASA58加入PGC-like誘導體系中,分別在不同誘導時間點檢測糖酵解相關基因的表達。qRT-PCR檢測結果顯示在誘導第2天時,添加VK3后,糖酵解相關基因Hk1、Pkm2、Glut1、Pfkp、Aldoc表達極顯著降低(P<0.01),而添加DASA58后,Ldha和Pfkp表達顯著升高(P<0.05),Hk1和Pgk1表達極顯著升高(P<0.01)。而在誘導第4天時,添加VK3后,Hk1、Pkm2、Ldha、Glut1、Pfkp、Aldoc和Pgk1表達極顯著降低(P<0.01)。誘導第6天時,添加DASA58后,Glut1、Pfkp和Pgk1表達極顯著升高(P<0.01)(圖2)。以上結果說明糖酵解抑制劑VK3和激活劑DASA58可調控糖酵解過程。
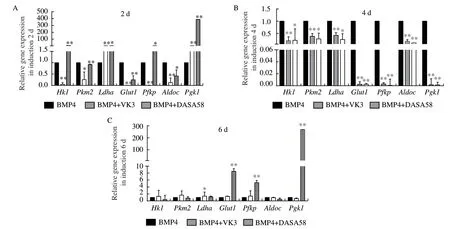
圖2 體外誘導過程中糖酵解抑制劑/激活劑對糖酵解相關基因的影響Fig. 2 Effects of glycolysis inhibitors/activators on glycolysis-related genes during the induction in vitro
2.3 糖酵解途徑抑制類胚體形成
本研究在BMP4誘導體系中添加VK3和DASA58,并在第6天觀察其對類胚體形成的影響。細胞形態學觀察顯示BMP4誘導后,出現帶有囊腔形態的典型類胚體特征細胞,且細胞發生聚團生長的現象;在此基礎上,添加VK3后,帶有囊腔形態的類胚體數量增加并大量聚團(P<0.01);而添加DASA58后,無典型的類胚體樣細胞形成(圖3)。以上結果說明抑制糖酵解途徑促進類胚體的形成。
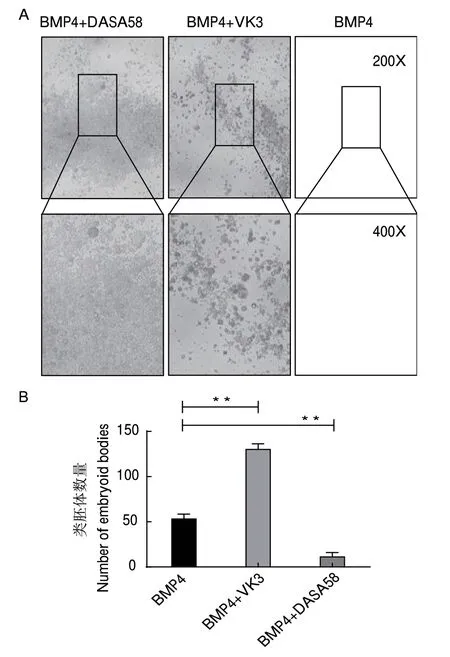
圖3 體外誘導過程中糖酵解抑制劑/激活劑對類胚體形成的影響Fig.3 Effect of glycolysis inhibitor/activator on embryoid body formation during the induction in vitro
2.4 糖酵解途徑抑制PGC-like形成
研究表明PGC-like形成經歷類胚體過程,類胚體中能表達PGC標記基因的細胞可稱為PGC-like。本研究前期已證明DDX4能夠作為標記PGC的特異蛋白進行流式分析。因此,在BMP4誘導過程中添加VK3和DASA58后第6天收集細胞,流式分析檢測PGC-like的陽性比例,結果顯示當添加VK3后,PGC-like的陽性數量顯著升高(P<0.05),而添加DASA58后,陽性細胞數量顯著降低(P<0.05)(圖4)。以上結果說明糖酵解途徑抑制體外PGC-like 的形成。
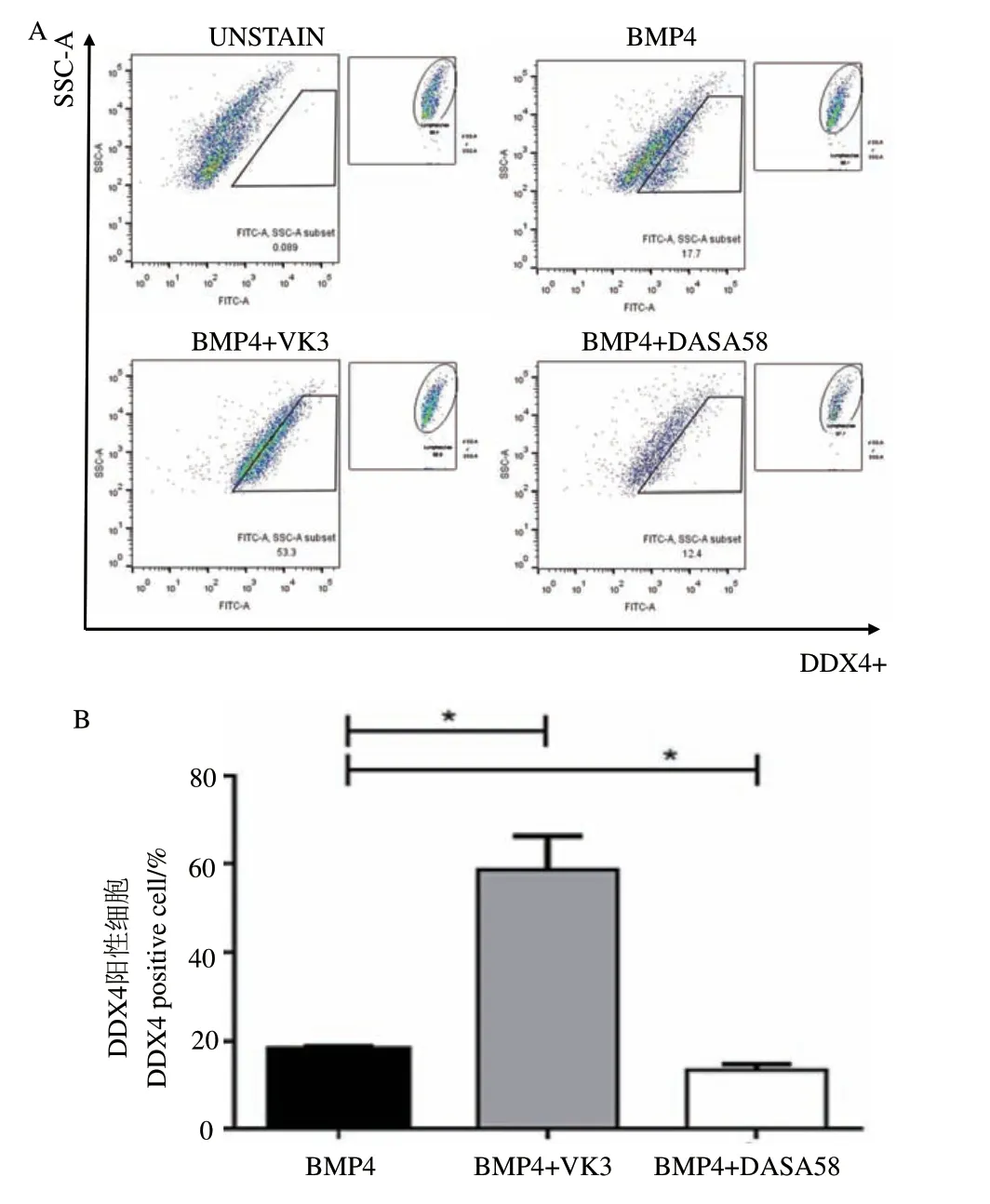
圖4 體外誘導過程中糖酵解抑制劑/激活劑對PGC-like形成的影響Fig. 4 Effect of glycolysis inhibitor/activator on PGC-like formation during the induction in vitro
3 討論
糖酵解關鍵酶的表達影響糖酵解效率參與生物學過程,常見的糖酵解關鍵酶包括HK1/2、5-甘油醛-3-磷酸脫氫酶(GAPDH)、6-磷酸果糖-1/2-激酶(PFK1/2)、GLUT-1和LDH-A等,這些關鍵酶的上調往往造成較高的糖酵解率,在癌癥和重編程過程中較為常見[17-19]。糖酵解關鍵酶(如Pglym78/pgam2)功能的喪失對成肌細胞融合能力(果蠅和斑馬魚胚胎)也會有所影響。本研究發現與心臟發育過程中糖酵解系統的正面調控作用不同[20],在體外雞PGC-like形成中糖酵解基因的mRNA表達普遍下降,可能由于在干細胞中糖酵解系統具有不同的表達模式。結合Zhou等[21]發現的ES細胞的能量生產具有二價特征,會根據需要從糖酵解轉換為線粒體呼吸。本研究推測體外ESC向PGC-like誘導分化過程中,以糖酵解為主要能量代謝途徑的模式逐漸瓦解,細胞轉化為線粒體呼吸。這一推測還需要進一步對線粒體呼吸相關指標進行檢測。
研究報道,甲萘醌VK3通過激活氧化還原反應抑制糖酵解過程[22-31]。本研究發現添加VK3后,有效抑制糖酵解相關基因的表達,暗示其可能對氧化磷酸化過程起激活作用。而DASA58作為PKM2的激活劑,在本研究中未出現顯著激活PKM2的結果,可能是檢測時間點過晚或是40 μmol/L的工作濃度難以滿足激活PKM2的需要。同時,本研究還觀察到添加DASA58后,Glut1、Pfkp、Pgk1的表達有所上升,說明DASA58的加入確實影響糖酵解系統的穩態,對糖酵解途徑具有一定的激活作用。
能量代謝確實影響細胞的命運決定。ESC細胞往往以糖酵解途徑為主要代謝方式,因此培養液中高濃度的葡萄糖有利于ESC的增殖,而葡萄糖濃度的變化則會影響ESC的分化[32-34]。研究表明AMP激活的蛋白激酶(AMPK)激活劑AICAR能啟動ATP產生的分解代謝途徑,抑制小鼠類胚體的形成[35]。本研究發現體外雞PGC-like形成中糖酵解相關基因表達降低;抑制糖酵解過程促進類胚體形成,激活糖酵解后類胚體形成減少。類胚體是PGClike形成的必經階段,糖酵解途徑對類胚體形成的調控暗示其對PGC-like的形成也有相似的調控模式。本研究通過流式分析也證明了這一點。這種能量代謝的調控模式與小鼠體內PGC形成過程氧化磷酸化升高、糖酵解降低的模式不謀而合。說明糖酵解過程不是體內外PGC形成所必需的,相反,氧化磷酸化可能在體內外PGC形成中起主導作用。然而PGC形成過程涉及多種調控因素,其中能量代謝的調控機制仍需進行深入挖掘。
4 結論
本研究發現ESC向PGC-like誘導過程抑制了糖酵解相關基因的表達。在添加VK3后糖酵解基因表達降低,促進類胚體/PGC-like的形成;而添加DASA58后,Glut1、Pfkp、Pgk1的表達升高,抑制類胚體/PGC-like的形成。本研究可為后續研究體內外PGC形成中能量代謝調控模式提供參考和理論。

