植物液泡加工酶研究進展
蘇雨 李宗蕓 韓永華
(江蘇師范大學生命科學學院 江蘇省系統發育與比較基因組學重點實驗室,徐州221116)
植物液泡加工酶(vacuolar processing enzyme,VPE)是一種半胱氨酸蛋白酶,又稱天冬酰胺酰基 內 肽 酶(asparaginyl endopeptidase,AEP)或legumain[1],主要定位于植物液泡中,能夠調節植物液泡蛋白成熟和參與程序性細胞死亡(PCD)。1987年人們最早在成熟的南瓜種子中發現了一類蛋白酶[2],這類蛋白酶主要負責將蛋白前體加工成熟;隨后成功地從蓖麻[3]中分離純化出這種天冬酰胺特異性的半胱氨酸蛋白酶,因其參與不同液泡蛋白的水解和激活過程而被命名為液泡加工酶。VPE屬于Peptidase C13蛋白酶超家族,由于VPE具有類似caspase蛋白的α/β折疊[4],因此將它們歸類為Peptidase CD家族成員。
通過分析VPE的激活機制,發現VPE本身是一種具有長C末端自抑制域的前體蛋白[5],并且含有參與催化的二聯體半胱氨酸(Cys)和組氨酸(His)殘基,通過水解天冬氨酸殘基C末端的肽鍵[6],激活下游相關的底物蛋白,導致細胞結構和代謝的改變,最后引起細胞程序性死亡[7]。因此,VPE又被稱為植物細胞中的類caspase蛋白酶。雖然植物VPE的亞細胞定位與動物caspase完全不同,但具有caspase-1活性的VPE在誘導植物某些類型的PCD過程中發揮重要作用。
根據已有研究表明,VPE在植物生長發育、PCD、應答生物與非生物脅迫反應等很多方面都發揮著重要的作用[8]。例如,VPE在煙草(Nicotiana benthamiana)中的沉默可減少病毒感染后的PCD[9];煙葉中的VPE識別caspase-1底物(YVADMCA),而不識別caspase-3底物(DEVD-MCA),進一步分析表明VPE是PCD過程中液泡塌陷的重要參與者[10]。近年來,研究發現,VPE具有肽連接活性[11-17],能夠在植物中形成有毒環狀肽(Cyclotides),對于植物的防蟲具有重要作用。本文總結了植物VPE的現有知識、最新發展,以及對未來研究領域的展望,以便更好地了解VPE在植物中的功能和作用。
1 VPE的生化特性
1.1 VPE的成熟與活化
在植物中,VPE是液泡蛋白成熟和激活的關鍵酶[18],VPE的成熟和活化過程在擬南芥和蓖麻中已有深入研究。Kuroyanagi等[5]將擬南芥γ型VPE在昆蟲細胞中表達,發現VPE能夠進行自我催化。VPE首先在內質網上以較大的無活性前前體形式(preproprecursor VPE,ppVPE)合成,ppVPE由信號肽(signal peptide,sp)、N端前肽(N-terminal propeptide,NTPP)、成熟蛋白酶結構域和C端前肽(C-terminal propeptide,CTPP)構成(圖1)[19]。ppVPE在內質網上通過剪切信號肽和糖基化轉變成無活性的VPE前體(precursor VPE,pVPE),隨后被轉運到溶解型液泡中,經過自我催化轉化為有活性的VPE中間體(intermediate VPE,iVPE),然后再轉變為VPE成熟體(mature VPE,mVPE)[5]。剪切掉CTPP的iVPE與mVPE具有基本相同的酶活性,但從iVPE剪切掉NTPP對于該酶的激活卻不是必須的,由此可見CTPP對于VPE酶活性的調控具有非常重要的作用[20]。進一步研究表明,CTPP是一個自我抑制結構域,它遮蓋了VPE的催化位點,抑制VPE的活性。因此,C末端的“前結構域”又被稱為Legumain穩定和活性調節(legumain stabilization activity modulation,LSAM)結構域。
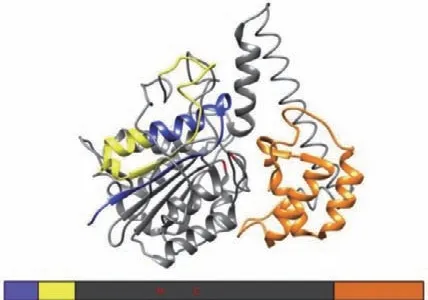
圖1 VPE的主要三維結構Fig. 1 Main three-dimensional structure of VPE
VPE的底物對Asn和Asp殘基具有特異性[20],它們具有與哺乳動物caspase-1相似的結構和酶性質,表現出與YVADase/caspase-1類似的切割活性[21]。這種嚴格的切割專一性意味著它們適合對蛋白質進行有限的蛋白質水解,然而,與其他蛋白酶的蛋白質水解引起的底物蛋白質構象的改變會暴露額外的Asn位點,導致VPE進一步降解[4]。
1.2 VPE具有肽連接活性,產生防御蛋白
植物VPE被認為是植物“免疫”系統的重要組成部分,因為它們可以參與環肽的生成,是抵御病原體的重要防御物。肽連接活性廣泛分布于植物中,VPE不僅催化肽綁定位點的裂解反應,同時也催化多肽片段連接和轉肽反應。來自向日葵種子的一個前體蛋白經過多肽片段連接和轉肽反應生成主鏈環化蛋白(kalata B1)[12],該環肽通過抑制生長而達到防御害蟲的目的。
多種具有抗生素活性的不同環肽[22]聚集在一些植物中,它們的產生需要肽連接步驟,其中,肽連接酶介導在前體蛋白的羧基和氨基末端之間形成新的肽鍵[23]。洋刀豆(Canavalia ensiformis)的刀豆蛋白A[11,24]的翻譯后處理和肽連接需要β型VPE[25-26];蝶 豆(Clitoria ternatea)的γ型VPE (Butelase 1)具有肽連接活性[13],可產生環肽;鏈球菌(O. affinis)的γ型VPE(OaAEP1)在前體蛋白的連接過程中介導了環氧化物的產生[15,27];向日葵γ型VPE(HaVPE1)處理前體多肽PawS1后產生充當胰蛋白酶抑制劑的環肽(SFTI-1),表明HaVPE1介導肽酶和肽連接反應[14,28]。VPE的肽連接活性差異很大,一些表現出高的連接活性,而另一些則沒有,說明在環肽的進化過程中,針對不同的VPE,肽連接活性水平已得到優化[17,29-31]。
2 VPE參與程序性細胞死亡的機制
PCD是一種高度調節的生理過程,對真核生物的發育至關重要。植物細胞與動物細胞不同,由于細胞壁的存在,植物細胞在PCD期間不會被相鄰細胞吞噬[32]。VPE負責液泡膜的裂解,使蛋白酶釋放到細胞質中并啟動蛋白水解級聯反應,導致細胞程序性死亡[33]。研究表明,VPE參與了許多不同類型的PCD(表1)。
2.1 VPE參與由病原體引起的生物應激誘導的PCD
植物一直在不斷與環境中各種各樣的病原體接觸,如病毒、細菌、真菌,雖然植物體內沒有特定的免疫細胞,但植物針對不同的病原體進化出了不同的防御策略[57],其中一種策略就是產生超敏反應(hypersensitive response,HR),能夠快速地導致局部的細胞超敏性死亡,它是PCD的一種形式。某些病原菌引起的超敏細胞死亡是由液泡介導的,通常有2種不同途徑,即非破壞性途徑和破壞性途徑[19](圖2)。
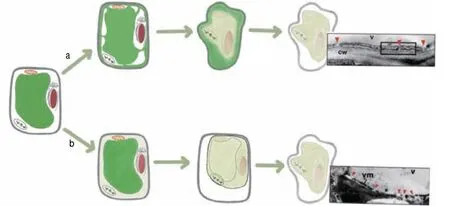
圖2 液泡介導細胞死亡的兩種不同途徑Fig. 2 Two different ways of vacuole-mediated cell death
非破壞性途徑是由于液泡膜和質膜融合使液泡與細胞質膜外部空間相互連接,導致液泡中的水解酶排到細胞外基質,導致細胞死亡,此過程不涉及液泡膜破裂。當植物受到細菌病原體感染后,液泡內的防御蛋白會發生聚集,由于液泡質膜的融合使得液泡防御蛋白被釋放到細菌增殖的細胞外空間,從而阻止細菌的生長。破壞性細胞死亡途徑是由液泡膜破裂直接導致液泡中的水解酶釋放到細胞質中,降解細胞質成分,進而引起快速直接的細胞死亡。當植物受到病毒感染后,由于大部分防御蛋白并不能阻止病毒繁殖,于是細胞采用液泡膜裂解機制,通過自殺行動抵制病毒的繁殖和擴散,保護其他部分以及整個植物體的存活。VPE依賴性細胞死亡通過破壞液泡膜有效地清除細胞內的病毒,因此,VPE在病毒誘導細胞死亡的早期階段顯然是必不可少的。
植物液泡內包含多種水解酶和防御蛋白,是植物體內的溶解細胞器,液泡蛋白在翻譯后被加工成成熟形式或在VPE的作用下被降解[58]。煙草葉片中VPE的失活導致煙草花葉病毒(tobacco mosaic virus,TMV)誘導的PCD水平降低[9],同時檢測到caspase-1活性降低,這是首次直接證明VPE所具有的caspase-1活性是導致細胞程序性死亡的基礎[59]。通過使用caspase抑制劑抑制VPE活性,從而能夠抑制植株被細菌或病原體侵染后引起的PCD[42]。類似地,通過沉默VPE基因,使得缺乏VPE的煙草植株中的病毒誘導的HR得到抑制[34]。近年來,在蘋果葉片中發現VPE與梨火疫病菌(Erwinia amylovora)誘導的超敏反應有關[51]。另外,VPE依賴性細胞死亡也參與了真菌毒素誘導擬南芥敏感細胞的死亡[46]。因此,VPE既作為植物防御策略介導了超敏細胞死亡,又作為一種病原策略介導了毒素誘導的細胞死亡。
2.2 VPE參與植物發育階段的PCD
PCD在不同發育階段包括種皮形成、側根出現、芽的發育與衰老、糊粉細胞降解、花粉自交不親和性、葉片和花瓣衰老中都有發生[60]。已經證明大麥的VPE參與大麥種子(包括核與果皮)中母體組織的降解,從而也影響種子顆粒的大小[61-63]。葡萄的(Vitis vinifera)VvβVPE在胚珠成熟和發芽過程中具有重要作用[64];在木質部發育過程中,馬鈴薯塊莖頂芽分生組織的分化及頂端優勢的出現[50],根瘤的發育和衰老[62,65],葉和花瓣衰老[46,61]和花粉發育[66]中也發現了VPE參與PCD的證據。野生煙草和轉基因煙草的異種間F1雜交系中幼苗階段出現了雜交致死現象,雜交幼苗死亡是由于液泡膜的破裂導致的[67],抑制VPE活性后PCD水平有所降低,由此發現液泡膜的破裂與VPE的活性有關。
2.3 VPE參與由非生物脅迫引起的PCD
VPE參與由非生物脅迫引起的PCD,一般來說,非生物脅迫(如干旱)可以誘導多種形式的半胱氨酸蛋白酶,這些蛋白酶在自然衰老期間可能不會表達[68]。擬南芥γVPE在保衛細胞中強烈表達并參與水脅迫反應[69],當γVPE突變時,γVPE敲除的突變株降低了氣孔開度,擬南芥植物更耐旱,表明該類型VPE對氣孔運動具有調控作用。水稻OsVPE2和OsVPE3可能與過氧化氫和鹽脅迫誘導的PCD有關,其中,H2O2脅迫導致OsVPE2和OsVPE3表達量上調;抑制OsVPE3的表達使得PCD期間液泡破裂減少以及葉寬和氣孔保衛細胞長度降低,增強了水稻的耐鹽性[70]。在重金屬鋁脅迫下,caspase抑制劑抑制番茄懸浮細胞中PCD,首次證實了類caspase活性與鋁誘導的PCD有關[71],近期研究發現液泡膜破裂早于細胞死亡,表明VPE介導的液泡破裂在鋁脅迫誘導的PCD中起關鍵作用。另外,一些植物激素(如乙烯、水楊酸和茉莉酸),以及一氧化氮等都能使VPE基因表達上調[21]。
3 VPE的分類
從苔蘚、蕨類植物到種子植物的進化過程中,VPE總是扮演著重要角色。植物VPE類似于哺乳動物caspase,都參與調控PCD途徑[72]。兩者的不同之處在于,在動物中編碼同一種型的蛋白,并且成熟的酶位于胞質溶膠中[73];然而,在高等植物液泡中,經常會發現幾種不同類型的VPE,例如擬南芥基因組包含4種類型VPE(αVPE、βVPE、γVPE和δVPE)。根據氨基酸序列和表達模式分析將其 劃 分 為3大 類[20]:營 養 類(α型VPE和γ型VPE)[74-76]、種子類(β型VPE)[76]和新型(δ型VPE)[48]。將VPE分為種子類和營養類的這種分類方式與將液泡分類為蛋白質儲存型液泡和裂解型液泡有關,蛋白質儲存型液泡含有大量種子萌發和生長過程中需要的防御和儲存蛋白,而裂解型液泡則含有大量水解酶。另外一種新型δ型VPE在種子發育早期種皮的2個細胞層中特異、短暫地表達。
隨著研究的進步,由于這些類型的VPE之間沒有實質的序列差異,不能為每個成員分配特定的功能與特點,而且也不能排除VPE在其他組織或發育階段具有的表達活性。例如,在擬南芥αVPE、βVPE和γVPE三重突變體中檢測到種子貯藏蛋白的前體,沒有成熟的貯藏蛋白,而在αVPE、γVPE單突變體以及αVPE、γVPE雙重突變體中檢測到成熟的貯藏蛋白,表明種子β型VPE在種子成熟期胚胎中發揮重要作用;βVPE、γVPE雙重突變體比βVPE單突變體積累了更多的存儲蛋白前體和較少的成熟形式,說明營養型VPE(α VPE和γ VPE)的表達也參與了種子貯藏蛋白的加工,并且在胚胎成熟過程中補充了β型VPE的活性[77-78]。在煙草中,NtVPE3是一種與δVPE高度同源的VPE基因,但在葉片和根部以及成熟的種子中也檢測到該基因的表達[79]。
Kenji等[80]從進化的角度分析不同植物不同類型VPE蛋白構建的系統發育樹(圖3),認為被子植物的VPE主要起源于γ型VPE和β型VPE[81]。由于在植物進化過程中薔薇亞綱出現了薔薇超目和菊超目的分離,因此,α型VPE逐漸從γ型VPE中分離出來,薔薇超目中十字花目的出現使得δ型VPE從γ VPE中分離出來,該研究推測造成這些類型VPE基因的差異可能是由于植物進化過程中的全基因組復制[80]。目前,雖然對于VPE的分類仍存在爭議,但在對VPE進行分類時仍然遵循將VPE分為營養型和種子型的分類方式。

圖3 植物液泡加工酶系統進化樹Fig. 3 Phylogenetic tree of vacuolase system in plants
4 不同類型VPE的生物學功能
4.1 β型VPE對種子貯藏蛋白成熟具有重要作用,且在胚胎、胚乳及花粉中特異表達
種子貯藏蛋白包括白蛋白和球蛋白,在種子成熟過程中積累。在液泡中,通過VPE裂解貯藏蛋白前體,從而使種子貯藏蛋白成熟[24]。在水稻和擬南芥中,βVPE突變導致種子貯藏蛋白前體部分積累[26-27,82-83],表明其參與了種子貯藏蛋白的成熟過程。并且除了β型VPE外,γ型VPE在蛋白質加工中也起作用,但β型VPE在這一過程中起主要作用。βVPE在種子成熟期廣泛表達,此時種子貯藏蛋白大量積累;αVPE和γVPE在種子發育早期表達,表達水平低于βVPE[24],這些差異表明β型VPE是種子貯藏蛋白加工的主要貢獻者。
β型VPE廣泛存在于被子植物中,在被子植物進化過程中,β型VPE最早與其他類型VPE分離,這種分離與雙受精系統(雙受精系統涉及胚乳的發育)的發展相一致[84]。最早發現的是蓖麻中的βVPE,它主要在種子中表達。擬南芥β型VPE直接參與半胱氨酸蛋白酶在空泡降解前的成熟,間接參與了氈層的降解和花粉的發育[66];番茄SlVPE4的啟動子在成熟胚中顯示出很高的活性水平[85];栽培煙草βVPE(NtVPE2)在胚胎發育后期和花粉中都有表達[79];葡萄VvβVPE在胚珠發育過程中有特異表達[64]。總之,βVPE在種子成熟過程中的胚胎和胚乳以及花粉中都有特異性表達。
4.2 δ VPE在種皮中特異表達
被子植物種子的種皮包裹著胚和胚乳,在種皮發育成完全的種皮前,胚和胚乳是由內外兩層細胞層(內種皮、外種皮)組成的,細胞層在受精后開始發育,形成了種皮的具體化結構。在種子發育的早期階段,具有caspase-1活性的δ型VPE在這些細胞層中表達導致PCD,從而減少細胞層的厚度并形成種皮。δ型VPE最初是從擬南芥種皮的外層中鑒定[48],由于δVPE缺失突變株中PCD過程顯示下降水平,并且擬南芥種子成熟過程中外層細胞層在整個胚胎形成期都保存著原有的厚度,證明δ型VPE在種皮的形成階段主要是通過PCD來控制細胞層的厚度。其他物種中的δ型VPE也扮演著重要角色,如番茄SlVPE2在種皮中特異表達[85];煙草NtTPE8在種子外皮絨氈層中表達,并且下調NtTPE8的表達,誘導胚胎流產[86];大麥HvVPE2a位于珠心的細胞壁,在谷物發育過程中降解細胞壁[87]等。
除此之外,δVPE在植物營養組織中還具有其他功能。例如,擬南芥δVPE在種子萌發胚根伸出期間瞬時表達,一旦幼苗建立,其表達水平就會下降[88]。與野生型擬南芥相比,δVPE缺失突變株表現出葉片卷曲和壞死、蚜蟲種群的快速聚集,表明δVPE功能喪失,對植物自身的基礎防御會造成一定影響[89]。雖然δVPE可能表現出特定的表達模式,但它們的一般功能與γVPE相似,因為它們參與了營養組織中液泡蛋白的加工或PCD的控制。
4.3 α VPE、γ VPE主要在衰老細胞中表達
VPE不僅在逆境脅迫下或細胞超敏反應中的表達量增加,而且在植物衰老過程中,VPE的表達量也會上調。擬南芥αVPE在新生側根、緊貼死亡細胞的內層細胞內表達,而γVPE在花粉發育末期的花粉囊中層衰老的細胞中表達,γVPE催化了植物液泡蛋白酶AtCPY的成熟,并且γVPE參與擬南芥衰老組織中液泡轉化酶AtFruct4的分解[90],表明γVPE在植物組織老化的PCD過程中具有降解蛋白質的作用[91]。無論是αVPE啟動子還是γVPE啟動子都不能在新生的且未受損傷的組織中起作用,只能在老化組織中啟動下游基因表達[24]。營養型VPE在高等植物中各種類型的PCD中發揮作用,乙烯、水楊酸處理和創傷都能使αVPE和γVPE表達上調,茉莉酸能使γVPE表達輕微上調[90],推測營養型VPE可能參與營養組織中各種溶解型液泡蛋白質成熟的過程,成熟的液泡蛋白質可能在植物細胞中液泡介導的病毒誘導細胞死亡、衰老等過程中發揮作用。
5 結論與展望
目前,關于VPE的研究仍然落后于其他半胱氨酸蛋白酶,盡管已在植物VPE基因組學、表觀遺傳學和生物信息學等[92]方面取得了一些進展,但在應激條件下闡明VPE的功能以及VPE在植物防御信號傳導中可能的作用方面仍鮮見報道。江蘇師范大學生命科學學院重點實驗室在近期研究中發現,在擬南芥中異源過表達甘薯VPE基因,對于擬南芥的發育、衰老、開花時間、葉片大小和數量以及衰老表型具有重要的調控作用[78]。因此,迫切需要開展更廣泛的VPE突變體工作以及沉默VPE工作,從而研究VPE基因在植物發育及對生物和非生物脅迫反應方面的作用。
研究表明,通過降低VPE基因表達,從而降低半胱氨酸蛋白酶誘導的蛋白質降解,導致葉子和種子中更高的蛋白質含量,半胱氨酸蛋白酶抑制劑的共表達可以增加煙草中重組蛋白的產生,這對提高一些農作物的蛋白含量提供了重要的理論依據。未來研究的一個方向是半胱氨酸蛋白酶抑制劑在2種蛋白酶(Caspase-1(木瓜蛋白酶樣)和Caspase-13(VPE))之間的相互作用中發揮特殊作用。關于抑制劑的表達時間、特異性及相互作用的類型仍然是一個尚未開發的研究領域。另外,VPE產生的環狀產品可能具有控制害蟲的潛力,這對某些食草動物的防治具有重要的指導作用。在未來關于VPE將有越來越多的新發現,有助于完善植物發育和防御的機制。

