禾谷炭疽菌CgRAB4的功能研究
齊堯堯,趙 耀,石曉玲
(1.臨沂職業學院,山東 臨沂 276017;2.臨沂大學農林科學學院,山東 臨沂 276000)
0 引言
【研究意義】炭疽菌屬(Colletotrichum)是世界植物致病真菌中分布最廣、種類最豐富的屬之一[1],該屬的典型代表禾谷炭疽菌(C.graminicola)是半活體營養病原菌,其引發的葉枯病和莖腐病造成玉米大幅減產,是制約玉米生產的主要因素,嚴重威脅世界糧食安全[2-3]。禾谷炭疽菌的侵染過程經歷了分生孢子的萌發、附著胞的形成、侵入栓的產生、初生侵染菌絲和次生侵染菌絲的形成及侵染過程[4-5]。盡管對禾谷炭疽菌致病的整個過程有了較清晰的認識,但是調控禾谷炭疽菌生長發育和侵染致病過程的具體機制尚不清楚。【前人研究進展】Rab 家族蛋白作為分子開關,能靶定到特異的細胞器上,通過與上游調控因子和下游特定效應子進行互相作用,實現GTP 活性態和GDP 失活態的循環,從而精確調控囊泡運輸的各個過程,進而參與真菌的侵染致病過程[6-8]。其成員Rab4 蛋白在哺乳動物和植物中研究較多,有Rab4A、Rab4B 和Rab4C 等3 個亞型,且不同亞型的功能不盡相同,但真菌中發現的Rab4 蛋白只有一個,例如,裂殖酵母中ypt4 主要維持細胞周期發育過程中液泡的大小和穩態[9],而玉米黑粉菌中Rab4 參與調控囊泡的移動和分裂[10]。禾谷炭疽菌中關于Rab4 的功能有待深入研究。【本研究切入點】前期通過生物信息學的方法鑒定到禾谷炭疽菌中有一個Rab4 蛋白(GLRG_08562),333 個氨基酸,含有Rab 蛋白保守的結構域[11],其在禾谷炭疽菌生長發育和侵染致病過程中的作用值得探究。【擬解決的關鍵問題】本研究利用同源重組的原理對CgRAB4 基因進行敲除,利用潮霉素作為篩選標記且經PCR 驗證后獲得缺失突變體菌株,進而分析缺失突變體菌株在禾谷炭疽菌菌絲生長、孢子產量、附著胞萌發及對玉米毒性等方面的作用,以期闡明CgRAB4 在禾谷炭疽菌的生長發育和侵染致病過程中的作用,為尋找炭疽病的防控策略提供理論指導。
1 材料與方法
1.1 材料
1.1.1 菌株和載體 禾谷炭疽菌株M2,pCX62 為本實驗室課題組保存。
1.1.2 試劑耗材 超保真酶和KOD 酶購自Vazyme公司;2 ×TaqPCR Master Mix、DNA Marker 和核酸染料購自天根公司;溶壁酶、潮霉素和熒光增白劑(Calcofluor White Stain,CFW)購自Sigma 公司;氨芐青霉素和硫酸鏈霉素購自上海生工生物工程有限公司;剛果紅(Congo,CR)和山梨醇(DSorbitol)購自索寶來公司;NaCl、KCl、SDS 購自國藥;瓊脂糖、TAE 緩沖液配置所需試劑、PCR 管和離心管購自博尚公司;培養皿購自廣州杰特公司;疏水載玻片(Gelbond film)購自BMA 公司。
引物合成由上海生工生物工程有限公司完成。
1.1.3 培養基 供試培養基如表1 所示。

表1 供試培養基Table 1 Culture media applied
1.2 方法
1.2.1 同源重組的基本原理 根據同源重組原理,利用潮霉素磷酸轉移酶基因(HPH)替代CgRAB4 基因進行敲除,其基本策略如圖1A 所示。首先以禾谷炭疽菌基因組DNA 為模板,利用CgRAB4 基因的上游和下游2 000 bp AF/AR 和BF/BR 為引物分別擴增A 片段和B 片段;然后以pCX62 質粒DNA 為模板,以潮霉素內部引物HYG/F 和YG/R、YG/F 和HY/R 為引物分別擴增NH 和HC 片段;最后利用重疊延伸PCR(Splicing by overlap extension,SOE-PCR)擴增AH和HB 片段,50 μL 反應體系包括A 片段和NH 片段(或B 片段和HC 片段)各1 μL、25 μL 2 × Phanta Max Buffer、1.0 μL 10 mmol·L-1dNTP Mix、Primer-AF 和Primer-HY/R(或YG/F 和BR)各2 μL、1.0 μL Phanta Max Super-Fidelity DNA Polymerase、17 μL ddH2O,反應體系如圖1-B 所示,將純化回收的AH和HB 共轉化到禾谷炭疽菌的原生質體后最終重組形成A+HPH+B 片段,從而成功敲除掉CgRAB4 基因。
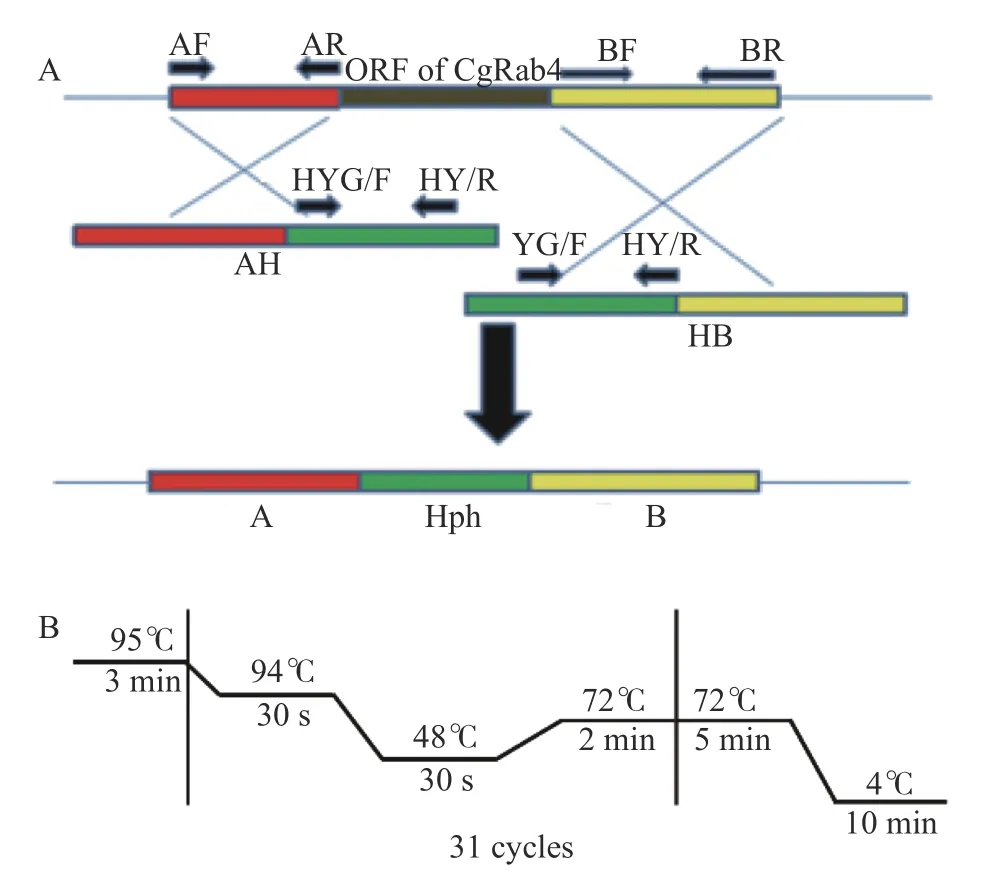
圖1 同源重組的敲除策略(A)和SOE-PCR 熱循環體系(B)Fig.1 Homologous recombination knockout (A) and SOC-PCR system (B)
1.2.2 禾谷炭疽菌原生質體的制備和轉化 原生質體的制備:首先將新活化的野生型菌株M2 切成40 小塊,放入200 mL PDB 中,置于28 ℃、150 r·min-1的氣浴恒溫振蕩器中振蕩培養36~48 h 后過濾、研磨后收集菌絲,用30 mL·個-1樣品的溶壁酶溶液進行 裂 解,30 ℃、90 r·min-1裂解3.5 h。然后利用STC 重懸沉淀和Sorbitol淋洗,最終調整濃度至5 × 107~5 × 108個·mL-1。最后混勻后用剪過尖端的槍頭吸取250 μL 原生質體分裝至無菌的離心管中。原生質體的轉化:通過聚乙二醇(Polyethylene glycol,PEG)介導的轉化技術進行轉化,即將CgRAB4 的AH 和HB 片段各10 μL 與上述250 μL 原生質體混勻后冰上靜置20 min,加入1.5 mL PTC 溶液(40% PTC 3350,50 mmol·L-1Tris-HCl pH8.0,50 mmol·L-1CaCl2)混勻冰上靜置20 min,4 000 r·min-1離心10 min 后倒掉上清液,加入5 mL 液體TB3 培養基,30 ℃,90 r·min-1孵育12 h 后與加入35 mL 含有100 mg·mL-1潮霉素的TB3 培養基混合倒下層板,靜置20 min 凝固,再在上層倒入50 mL 含有300 mg·mL-1潮霉素的TB3 培養基,于26 ℃的光照培養箱中培養7 d 左右長出轉化子。
1.2.3 轉化子DNA 的提取和驗證 轉化子DNA 的提取:首先將大板(15 cm)上長出來的轉化子挑取到PDA(6 cm)上培養4 d 左右,然后刮取轉化子的菌絲到含有適量石英砂和400 μL DNA 提取buffer(50 mmol·L-1Tris-HCl pH8.0、50 mmol·L-1EDTA pH8.0、2% SDS、0.5 mol·L-1NaCl)的1.5 mL 離心管中,200 r·min-1振蕩培養3~4 h;最后用氯仿抽提,70%酒精沖洗DNA,適量無菌水溶解DNA。轉化子DNA 的驗證:首先用1.0%的瓊脂糖凝膠電泳檢測提取的DNA,然后用OF/OR 和UAF/H853兩對引物從DNA 水平驗證轉化子。
1.2.4 禾谷炭疽菌菌絲生長相關試驗 生長速率測定:首先將新鮮活化的CgM2、△Cgrab4-2、△Cgrab4-7和△Cgrab4-Ect菌株用打孔器獲取大小相等的菌絲塊,然后分別接種于PDA、CMII 和MK 培養基(9 cm)的正中央,置于26 ℃ 2 000 lx 光照培養箱中培養5 d,最后測量直徑拍照。本試驗重復3 次,每次每個菌株至少3 個重復。菌絲形態觀察:首先分別將CMII 培養基上生長2 d 的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株切取2.0 cm × 0.5 cm菌絲塊,然后倒置于干凈無菌的載玻片上,最后顯微鏡下觀察菌絲的形態并拍照。生長脅迫試驗:首先將新鮮活化的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株用打孔器獲取大小相等的菌絲塊,然后分別轉接到含有0.7 mol·L-1NaCl、0.7 mol·L-1KCl、1 mol·L-1Sorbitol、200 μg·mL-1CFW、200 μg·mL-1CR、0.01% SDS的培養基上,置于26 ℃2 000 lx 光照培養箱中培養5 d,最后測量直徑拍照。本試驗重復3 次,每次每個菌株至少3 個重復。
抑制率=[(未加抑制劑的菌落直徑-添加抑制劑的菌落直徑)/未加抑制劑的菌落直徑]×100%
1.2.5 禾谷炭疽菌孢子產量統計和形態觀察 孢子產量測定:首先將新鮮活化的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株用打孔器獲取大小相等的菌絲塊,轉接3 塊到含有氨芐抗生素的50 mL PDB培養基里,于28 ℃ 110 r·min-1振蕩培養48 h,最后離心收集孢子,棄上清后加入5 mL無菌ddH2O,混勻后吸取10 μL 到血球計數板上計數,計數所得個數換算成單位面積的產孢量。試驗重復3 次,每次每個菌株至少3 個重復。孢子形態觀察:將上述計數后的分生孢子置于顯微鏡下觀察拍照。
1.2.6 禾谷炭疽菌附著胞的形成和形態觀察 首先將CgM2、△Cgrab4-2、△Cgrab4-7和△Cgrab4-Ect的分生孢子定量至5 × 105個,然后分別吸取15 μL·滴-1到Gelbond film 疏水表面上,置于26 ℃黑暗培養,最后分別于0、6、12、24、48 h 統計孢子和附著胞的萌發率,并于顯微鏡下觀察附著胞形態。其中每個載玻片3 滴,每個樣品重復3 次。
1.2.7 禾谷炭疽菌致病力的測定 玉米葉片造傷接種:將生長15 d 左右(三葉一心)的Mo13 玉米葉片取下粘貼于濾紙上,然后用無菌牙簽輕輕點擊玉米葉片(葉片不能穿透),然后接種大小相等的CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌絲塊,最后加水浸潤濾紙,覆蓋保鮮膜于26 ℃黑暗培養24 h后光照培養5 d,觀察玉米葉片的發病情況。孢子懸浮液噴霧接種玉米葉片:將定量好的分生孢子懸浮液(加吐溫)噴霧接種于三葉一心的玉米葉片上,黑暗處理24 h 后,26 ℃光照培養7 d,觀察玉米葉片的發病情況。
2 結果與分析
2.1 CgRAB4 缺失突變體相關引物的設計
本研究利用primer5 設計引物,具體的序列如表2 所示。

表2 供試引物序列Table 2 Sequence of primer employed
2.2 SOE-PCR 擴增獲得CgRAB4 缺失突變體的長片段
SOE-PCR 在設計引物時有兩條是常規的引物,另外兩條引物是特殊設計的,其序列上一端與自身的目的片段互補,另外一端卻是另外一段目的基因的序列(表2)。兩段基因的引物經過各自的PCR克隆后,在各自的產物其中的一端加上特別的接頭。利用接頭的特異互補進行PCR 擴增,從而將兩段PCR 產物連接到了一起,形成了不靠限制性內切酶連接的雜交基因片段。
利用PCR 擴增CgRAB4 的上游A 片段、下游B片段、潮霉素NH 片段和潮霉素HC 片段,然后將PCR產物用1.0%瓊脂糖凝膠電泳檢測,上樣3.0 μL,結果如圖2 所示,得到A 片段大小為783 bp,介于750~1 000 bp,B 片段大小為1 048 bp,略高于1 000 bp 的條帶,而NH 片段(768 bp)和HC 片段(918 bp)的片段也大小正確,條帶單一。然后將獲得的A 片段、NH 片段、B 片段和HC 片段,通過SOE-PCR 擴增AH片段和HB片段,擴增得到AH(1 582 bp)和HB(1 966 bp)條帶單一大小正確,可用于后續轉化試驗。
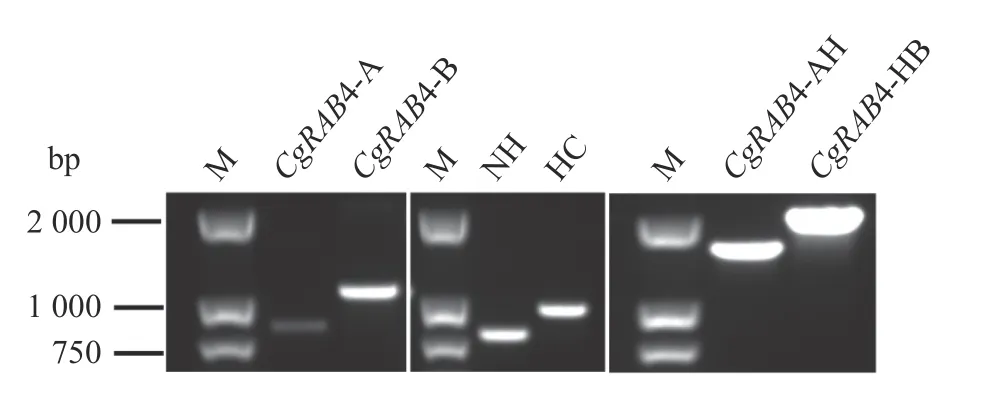
圖2 SOE-PCR 擴增AH 和HBFig.2 SOE-PCR amplifications of AH and HB
2.3 CgRAB4 敲除轉化子的篩選驗證
本試驗共轉化了2 批,共得到了11 個轉化子。提取DNA 后利用CgRAB4 基因ORF 內部一對引物OF/OR、AF 上游一條引物UAF 與潮霉素基因內部一條特異性引物H853(UA)對11 個候選轉化子進行DNA 水平的驗證。結果如圖3 所示,凡是ORF 無陽性擴增(503 bp)且UA 有陽性擴增(1 475 bp)的轉化子即為敲除突變體,共獲得Cgrab4-2、Cgrab4-6、Cgrab4-7 三個敲除突變體。而ORF 未被潮霉素基因替換,即ORF 有陽性擴增,且潮霉素基因隨機整合到基因組具備潮霉素抗性但UA 無陽性擴增的轉化子即為異位整合突變體,共獲得Cgrab4-1 一個異位整合突變體。本試驗取缺失突變體Cgrab4-2、Cgrab4-7 和異位整合突變體Cgrab4-1 用于后續的表型分析試驗。
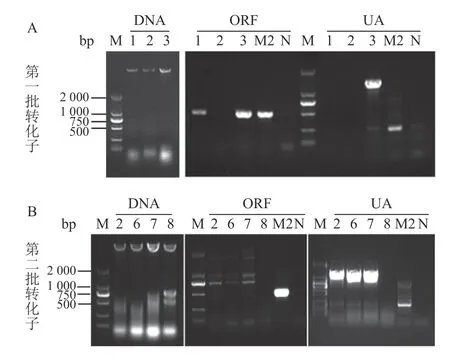
圖3 轉化子的DNA 提取與驗證Fig.3 DNA extraction and verification on transformants
2.4 CgRAB4 缺失對禾谷炭疽菌生長發育的影響
將CgM2、△Cgrab4-2、△Cgrab4-7 和△Cgrab4-Ect菌株分別于CMII、PDA 和MK 培養基上培養,6 d后測量直徑,結果發現與CgM2 相比,缺失突變體△Cgrab4-2、△Cgrab4-7 的生長速率略微加快(圖4-A和4-B);將培養基縱切,觀察到野生型和缺失突變體的氣生菌絲量沒有顯著變化(圖4-A);異位整合突變體△Cgrab4-Ect與野生型CgM2 的生長速率和氣生菌絲與野生型無明顯變化。進一步觀察菌絲的形態發現,與野生型CgM2 相比,CgRAB4 缺失突變體和異位整合突變體的菌絲形態沒有變化,都產生細長的菌絲(圖4-C)。以上結果表明CgRAB4 缺失后促進了菌絲的生長,但并不影響菌絲的形態發育。
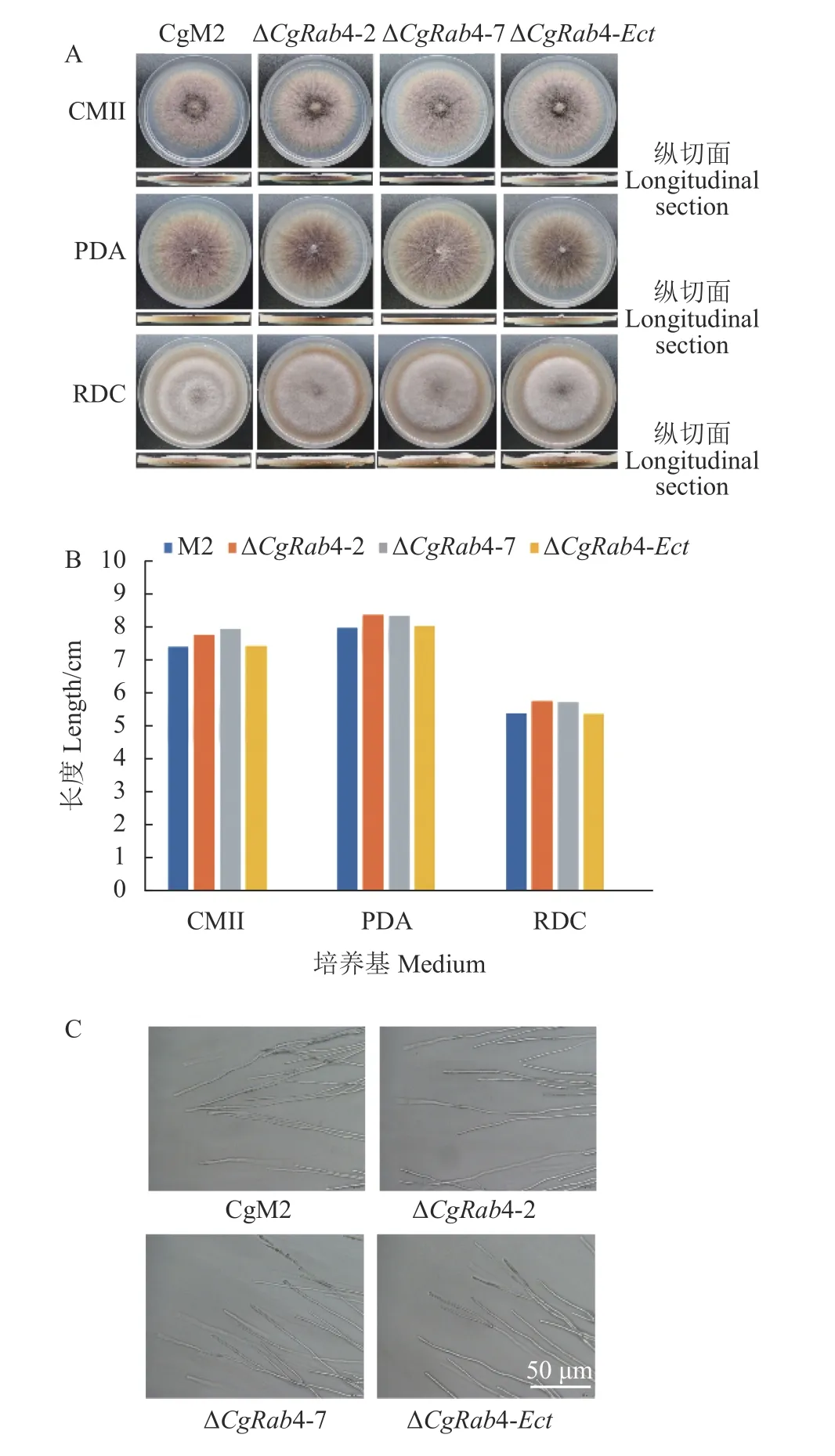
圖4 禾谷炭疽菌CgRAB4 缺失突變體的生長發育Fig.4 Development of CgRAB4-deleted mutants
2.5 CgRAB4 缺失對禾谷炭疽菌脅迫響應的影響
胞吞過程在真菌細胞應對各種環境刺激和脅迫的過程中發揮了至關重要的作用,而Rab 蛋白調控胞吞過程,因此本研究分析了CgRAB4 應對高滲脅迫和細胞壁抑制劑條件下的生長情況。結果發現,無論是在CMII培養基(圖5-A)還是PDA培養基(圖5-C)上,與野生型CgM2 相比,CgRAB4 缺失后菌落生長略有增長,抑制率都略有增加(圖5-B、D),表明CgRAB4不參與調控外界脅迫的響應過程。
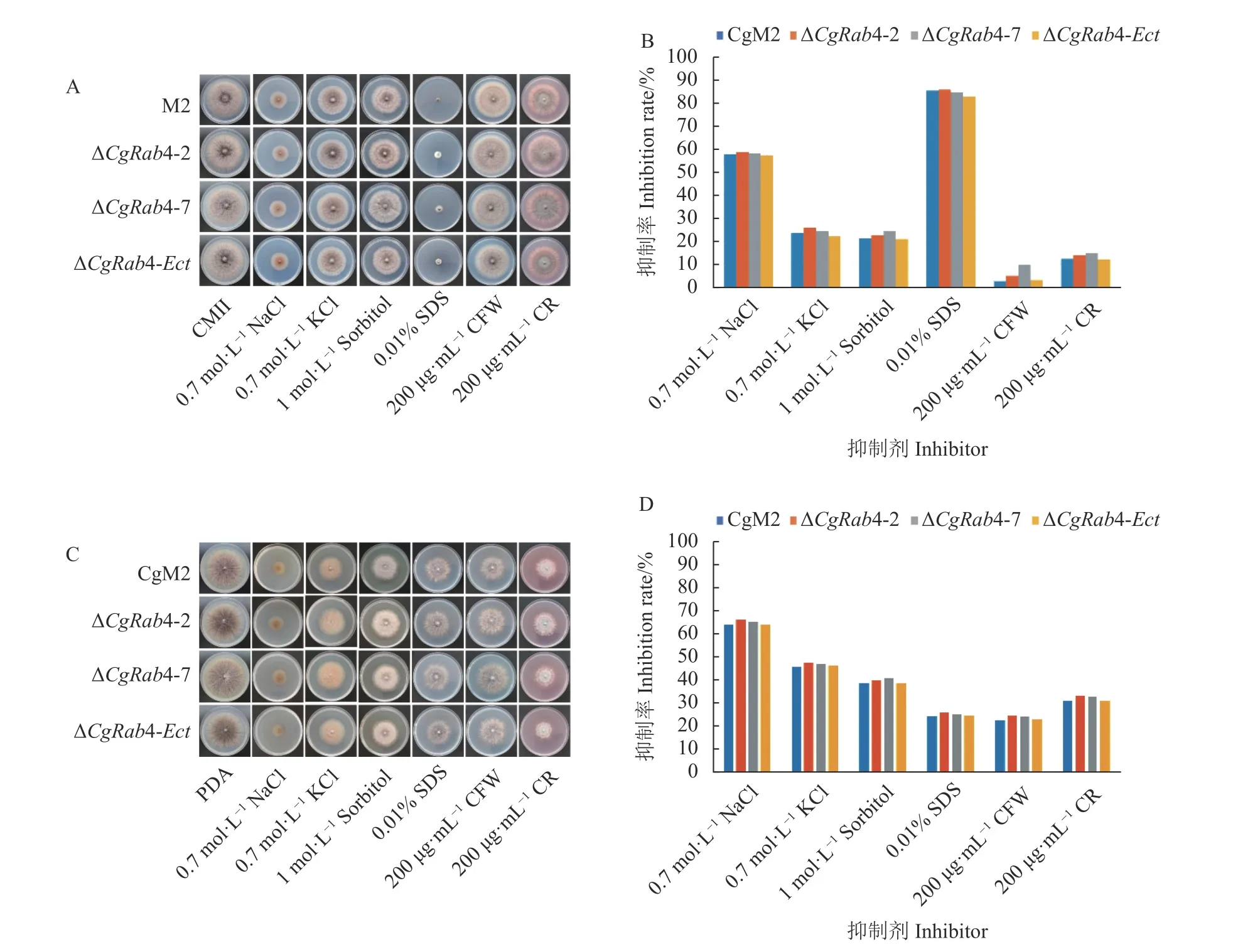
圖5 CgRAB4 缺失突變體脅迫響應試驗Fig.5 Stress responses of CgRAB4-deleted mutants
2.6 CgRAB4 缺失對禾谷炭疽菌孢子產量和形態的影響
進一步對CgRAB4 缺失突變體和異位整合突變體的產孢量進行統計,結果如圖6-A 所示,與野生型相比,CgRAB4 缺失突變體中孢子量沒有變化。觀察孢子形態發現,與野生型一樣,CgRAB4缺失突變體也會產生鐮刀型分生孢子,形狀和大小并無變化,表明CgRAB4 不參與調控禾谷炭疽菌分生孢子的產生和發育過程。
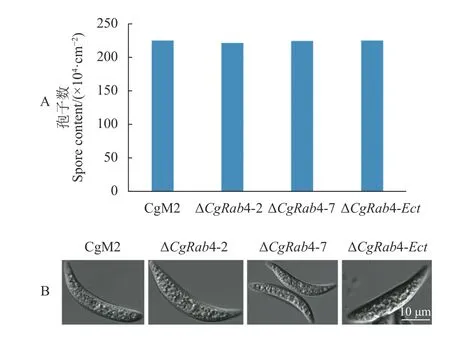
圖6 CgRAB4 缺失突變體產孢量和孢子形態Fig.6 Conidiations and spore morphology of CgRAB4-deleted mutants
2.7 CgRAB4 缺失對禾谷炭疽菌附著胞的影響
通過對分生孢子萌發形成附著胞的過程進行觀察,與野生型一樣,CgRAB4 缺失突變體在6 h 后分生孢子會在兩端或中間進行萌發,12 h 后產生近球狀的附著胞(圖7),48 h 幾乎全部萌發產生附著胞。此外,兩者的菌絲頂端都可以直接萌發產生多邊形不規則的附著胞,表明CgRAB4 不參與禾谷炭疽菌分生孢子和附著胞的發育過程。
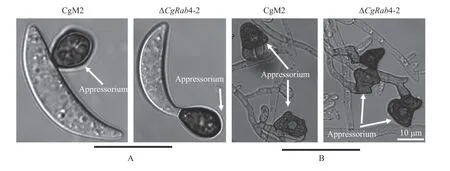
圖7 CgRAB4 缺失突變體的孢子萌發和附著胞形態Fig.7 Spore germination and appressorium morphology of CgRAB4-deleted mutants
2.8 CgRAB4 缺失對禾谷炭疽菌致病性的影響
為了明確CgRAB4 是否參與禾谷炭疽菌的致病過程,本試驗通過對玉米葉片進行造傷接種(圖8-A)和噴霧接種(圖8-B),結果發現,與野生型CgM2一樣,CgRAB4 缺失突變體能在玉米葉片上造傷口附近產生梭形的擴展斑(圖8-A),噴霧接種到玉米葉片上,病斑連接成片,玉米葉片發黃,表明CgRAB4并不參與調控禾谷炭疽菌的致病過程。

圖8 CgRAB4 缺失突變體對玉米的致病性Fig.8 Pathogenesis of CgRAB4-deleted mutants on corn
3 討論與結論
前期生物信息學鑒定出禾谷炭疽菌共有10 個Rab候選蛋白[11],其成員之一Rab4 在動物、植物和真菌中均有研究[12-14],主要定位于網格包被囊泡、早期內涵體和循環囊泡上,有Rab4A、Rab4B 和Rab4C等3 個亞型,Rab4A 的同源基因存在于人類、斑馬魚等生物中,Rab4B 在裂殖酵母等高等多生物中均存在同源基因,而目前Rab4C 的結構與功能尚不清楚[15],是貨物循環和內涵體分選的關鍵調控因子[16]。例如,在人類細胞中,Rab4 與效應蛋白Rabenosyn-5 相互作用參與貨物從早期內涵體到質膜的循環[17];Rab4 與Rab5 共同參與非洲爪蟾視覺系統中突觸的伸長過程[18];擬南芥中的Rab4b 極性定位于根毛細胞[19],其效應蛋白PI-4Kβ1 通過新同源結構域IIIβ PI-4Ks 與Rab4b 相互作用,并利用NH2 末端與AtCBL1 相互作用,從而將Ca2+通道和PI-4,5P2 信號通路建立聯系,進而調控根毛細胞頂端細胞壁成分的極性分泌[14]。到目前為止,真菌中僅報道了裂殖酵母和玉米黑粉菌中均只有一個Rab4 蛋白,分別維持細胞周期發育過程[9]和液泡的大小以及穩態[10],但在真菌的生長發育和侵染致病過程的作用尚有待深入研究。因此對不同真菌中Rab4 功能的研究有助于揭示Rab4 蛋白的保守型和功能差異性,對禾谷炭疽菌中CgRAB4的研究能豐富Rab4 在真菌中的研究,并為Rab 蛋白的功能研究提供理論支持。
為進一步分析Rab4 是否參與調控禾谷炭疽菌的生長發育和侵染致病過程,本研究首先根據同源重組的原理對CgRAB4 基因進行敲除,利用SOE-PCR擴增長片段AH 和HB,將其共同轉化至禾谷炭疽菌的原生質體中,經潮霉素抗性篩選和PCR 驗證,成功獲得3 個缺失突變體和1 個異位整合突變體。然后分析CgRAB4 缺失突變體在菌絲生長發育、產孢和孢子萌發、對玉米致病力等方面的作用,發現與野生型CgM2 相比,CgRAB4 缺失后促進了禾谷炭疽菌的生長,但不影響菌絲的形態,且不參與調控外界脅迫的響應過程,孢子產量和形態、附著胞的發育以及對玉米的致病力都沒有明顯變化,表明CgRAB4可能只參與調控禾谷炭疽菌的生長過程。
本研究中只進行了兩次禾谷炭疽菌原生質體的轉化,共獲得11 個候選轉化子,轉化效率不是很高,但經驗證后得到3 個缺失突變體,CgRAB4 基因敲除的效率卻較高。另外本研究對CgRAB4 基因進行回補,經過多次嘗試均未獲得互補突變體。本研究對CgRAB4 功能的初探有助于解析Rab4 調控禾谷炭疽菌的致病機理,也豐富了Rab4 蛋白在真菌中的研究,為尋找炭疽病的防控策略提供理論指導。

