車前草高效再生體系的建立
楊鴻淋,張欣鈺,何金玉,鄒利娟
(綿陽師范學院生命科學與技術學院,四川綿陽 621006)
0 引言
車前草(PlantagoasiaticaL.)為車前草屬多年生草本植物,又名車輪草、豬耳草、牛耳朵草等,具有極高的藥用價值和食用價值[1-2].車前草主要含有黃酮類、多糖類、三萜類等化學成分,具有抗菌消炎、消腫利尿、清熱明目、涼血解毒、鎮咳抗炎等功能,在臨床上常用于治療流行性腮腺炎、尿潴留、慢性活動性肝炎、痛風與細菌性痢疾等[3-4].隨著現代藥理研究的深入,人們發現車前草所含的多種成分都有抗腫瘤、抗突變、抗氧化和誘導癌細胞分化、增強細胞免疫力等作用[5-6].車前草具有多種化學成分類型和廣泛的藥理作用[7-8].同時車前草作為可食用性蔬菜,市場需求量極大,人們的過度采挖導致野生車前草資源量驟然下降.
對于車前草組織培養已有報道,李平等以大車前草子葉和葉片誘導再生芽[9];曾建軍等以車前草下胚軸和子葉為外植體誘導不定芽[10];王曉旭等以平車前草根頸、葉片和葉柄為外植體,建立了車前草再生體系[11-12],這些數據為本實驗提供了重要參考,但不同外植體在含有不同植物生長調節劑的培養基上誘導率和增殖效果也有很大差異.本實驗以車前草為對象,以規模化生產為目的,系統探討植物生長調節劑組合對幼芽和葉片愈傷組織誘導、不定芽分化、增殖及生根培養的影響,篩選出不同階段的最佳培養基,從而成功建立完整的車前草再生體系.本實驗對于保護車前草植物資源、實現可持續利用,研究次生代謝物質生物合成機制、實現工業化生產等,具有一定的參考價值.此外,為利用基因工程對車前草進行遺傳改造,培育高活性物質的轉基因植株提供了研究基礎.
1 材料與方法
1.1 材料準備
車前草種子,2020年9月采于綿陽市磨家鎮,經綿陽師范學院羅明華教授鑒定.將收集的車前草種子播種于實驗室營養土中,待植株長至4~6葉片時取其幼芽作為外植體,用75%酒精消毒30 s,再用10%NaClO滅菌6~8 min,無菌水洗滌3~5次,無菌濾紙瀝干水分后備用.
1.2 實驗方法
從生芽誘導:幼芽接種于含有生長素NAA(萘乙酸),細胞分裂素KT(激動素)和TDZ(噻苯隆)的培養基上進行培養.20 d后統計幼芽誘導叢生芽情況.
愈傷組織及不定芽誘導:待接種后的幼芽有新的葉片長出,將無菌葉片剪為0.5 cm×0.5 cm大小,進行葉片愈傷組織誘導,愈傷組織經過增殖培養后進行不定芽分化.葉片接種15 d后統計愈傷誘導率,第35天后統計不定芽誘導狀況.
再生芽增殖:將獲得的再生芽轉接至TDZ2.0 mg/L培養基上進行芽的生長增殖.
生根及移栽:獲得的再生芽轉移至添加IAA(吲哚乙酸)、NAA和ZT(玉米素)的培養基上誘導生根.生根培養3周后進行馴化移栽.
以上實驗重復3次.
1.3 基本培養基及培養條件
供試培養基均為MS培養基添加3%蔗糖和0.6%瓊脂,pH5.8±0.2并于121 ℃滅菌20 min.培養條件為:溫度(25±2)℃,光照時間12 h/d,光照強度3 000 lx.
2 結果與分析
2.1 叢生芽的誘導(幼芽)
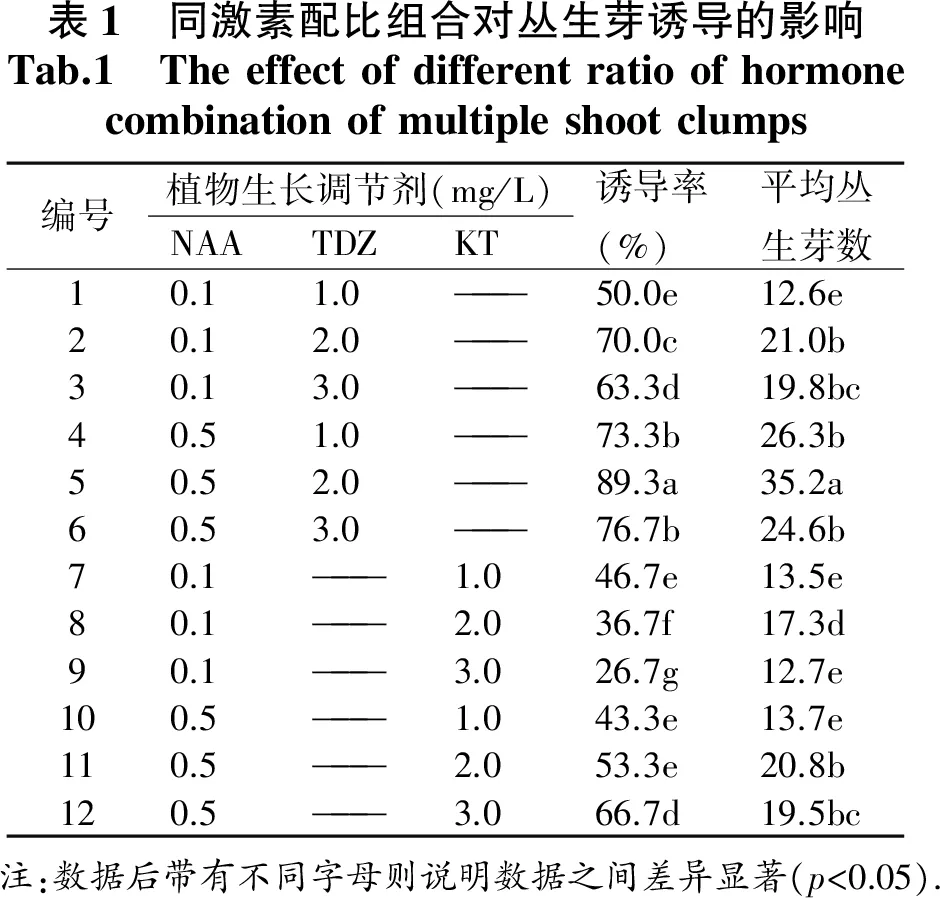
車前草幼芽(圖1)接種在供試的12種培養基上,統計結果見表1,供試的12種培養基均可誘導車前草叢生芽的產生,但誘導率和每個外植體產生的叢生芽個數存在很大的差異.幼芽誘導叢生芽生長過程記錄如下:接種15 d左右,幼芽基部開始膨大;約20 d,芽體基部產生大量綠色致密愈傷組織(圖1-B1),此時統計誘導率;在原培養基上繼續轉接,35 d左右愈傷組織分化出綠色小芽體(圖2-B2),基部愈傷部分褐化;45 d后芽體不斷分化增長(圖2-B3),此時由于愈傷團較大,吸收營養有限,可以切割成小團,分別接種在原培養基培養,60 d后發育成健壯的無菌苗(圖2-B4).

12種處理中,1-6號培養基使用生長素NAA和細胞分裂素TDZ,7-12號培養基使用生長素NAA和細胞分裂素KT,數據分析分析得出:無論是誘導率還是產生的叢生芽個數,NAA配比TDZ的使用效果要比NAA和KT組合的使用效果好.其中5號培養基誘導率達89.3%,誘導產生的叢生芽不僅數量多,而且長勢最好,葉片大而深綠,平均芽達到35.2個,和其他處理均存在顯著差異.因此,叢生芽的最佳培養基為MS+NAA0.5 mg/L+TDZ2.0 mg/L,TDZ作為細胞分裂素更適合車前草誘導叢生芽的產生.
2.2 不定芽的誘導和增殖培養(葉片)
車前草幼芽(圖1-B)接種于培養基MS+NAA0.5 mg/L+6-BA1.0 mg/L上,幼芽不斷伸長生長葉片伸展,15 d左右可獲得大量無菌葉片,將葉片切割成0.5 cm×0.5 cm大小,進行葉片愈傷組織及不定芽誘導.葉片誘導愈傷及分化過程記錄如下:接種7 d葉片卷曲膨大;15 d后葉片切口處出現少量愈傷組織(圖1-A1),切口處有褐化;約24 d,切口處愈傷組織分化不定芽(圖2-A2);不定芽增殖分化,將不定芽切割成芽從在原培養基上繼續培養32 d(圖2-A3);60 d后芽長成可見健壯芽從(圖2-A4).
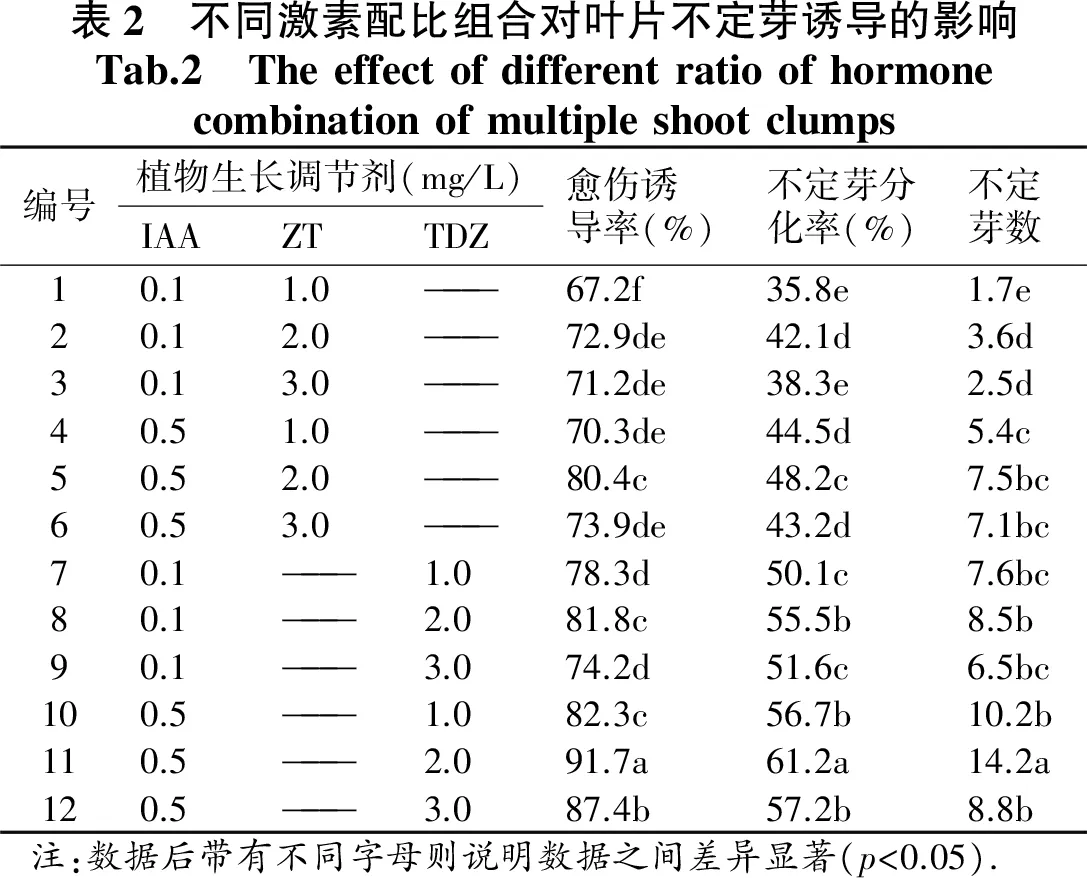
由表2可知,12種處理中,均可誘導葉片產生愈傷組織.IAA+ZT培養基與IAA+TDZ培養基的誘導效果(愈傷誘導率和不定芽平均個數)存在顯著差異.其中11號培養基愈傷組織誘導率達91.7%,不定芽分化率為61.2%,每個外植體產生的不定芽平均數為14.2個,與其他處理均存在顯著差異.因此,葉片愈傷組織及分化的最佳培養基為MS+IAA0.5 mg/L+TDZ2.0 mg/L,細胞分裂素TDZ更適合車前草葉片誘導及分化.葉片愈傷組織繼代可添加AgNO3500 mg/L,有效防止褐化和提高不定芽分化.
將獲得的不定芽切割成含2~4個芽的芽從,轉接到含有TDZ(1.0、2.0、3.0 mg/L)和AgNO3500 mg/L培養基上進行繼代增殖培養(表3),無菌苗長勢良好(圖3-ABC),褐化現象得到緩解.在2.0 mg/L的TDZ培養基上,再生芽的增殖系數達7.2,與其他處理存在顯著差異.


圖3 不定芽增殖及生根培養Fig.3 Adventitious bud proliferation and rooting cultureA-TDZ1.0 mg/L +AgNO3500 mg/L不定芽增殖;B-TDZ3.0 mg/L +AgNO3500 mg/L不定芽增殖;C-TDZ2.0 mg/L +AgNO3500 mg/L不定芽增殖;D-生根培養
2.3 生根培養
將生長健壯的叢生芽或不定芽切割成單芽接種到生根培養基中,每種處理接種15個單芽.培養28 d后的統計結果見表4.由表可見,車前草生根較容易,生根培養15 d后,各組培養基中的芽均開始有根長出,但由于各組培養基的激素組合和配比不同,生長狀況也各有差異.各培養基之間平均根長和誘導率差別不大,1號和2號僅添加了生長素NAA,但生根狀況不佳,不僅根少,而且苗生長狀況不好,部分泛黃;3號和4號僅添加了生長素IAA,雖然根較多,但主要為須根,主根不明顯,苗的長勢較好;5號添加了生長素IAA和細胞分裂素ZT,平均根長、生根條數及誘導率均高于其他處理,有生長粗壯明顯的綠色主根,且苗的長勢良好(圖3-D).綜合比較,車前草生根最佳培養基為MS+IAA1.0 mg/L+ZT2.0 mg/L,在此培養基上,生根誘導率100%,平均根長7.9 cm,平均根數30條.組培苗經馴化移栽后成活率可達100%.
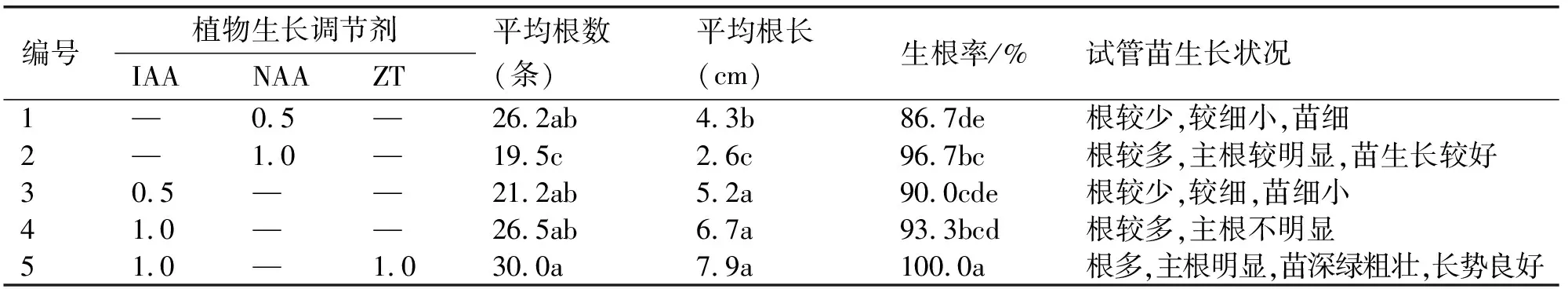
表4 不同激素配比組合對生根誘導的影響Tab.4 The effect of different assemblage with hormone concentration on rooting induction
3 討論
3.1 TDZ對不定芽、叢生芽誘導和增殖培養的影響
車前草屬的組織培養的文獻中,多以下胚軸直接誘導叢生芽,子葉、葉片、葉柄與根頸先經愈傷組織再分化不定芽,但愈傷組織分化率和分化成芽數較低,分化率為25%,平均每塊愈傷產生2.8個芽[9-12].本實驗中葉片經愈傷組織在MS+IAA0.5 mg/L+TDZ2.0 mg/L培養基上分化率可達61.2%,誘導產生的不定芽平均數為14.2個.這可能與使用的植物生長調節劑不同,TDZ作為類似細胞分裂素在芽的誘導和植株再生方面具有較強的活性,能夠誘導多種植物產生直接不定芽,并在眾多的工作中得到了證實[13-14].本研究在進行叢生芽、不定芽的誘導過程中,生長素IAA和細胞分裂素TDZ或KT的不同組合中,TDZ的效果比KT的效果更好.且較高濃度細胞分裂素利于芽的形成,但是細胞分裂素的濃度也不宜過高,在誘導不定芽、叢生芽的12種培養基組合中(表1和表2),4-6號隨編號的增大TDZ的濃度也逐漸增大,但對芽誘導效果卻并未逐漸增強,6號的效果反而比5號差.因此,本研究中誘導叢生芽的TDZ的最佳濃度為2.0 mg/L,即誘導產生叢生芽的最佳培養基為5號培養基MS+(IAA0.5+TDZ2.0)mg/L,誘導產生的叢生芽健壯,葉片碩大且顏色深綠;誘導不定芽的TDZ最佳濃度為2.0 mg/L,誘導不定芽的最佳培養基為MS+(IAA1.0+TDZ2.0)mg/L,誘導產生的不定芽長勢最好.本實驗建立的車前草再生體系,可以滿足大規模市場化的生產,并為利用基因工程對車前草進行遺傳改造及種質資源保護提供了理論參考.
3.2 實驗中玻璃化現象
玻璃化是指植物在組織培養過程中發生的一種形態和生理紊亂,由于水分攝入過多,導致葉片呈半透明、腫脹、卷曲、易碎的狀態.產生玻璃化現象與外植體狀態、通風條件、溫度、光照以及培養基成分等因素有關[15-16].本實驗在葉片分化不定芽培養過程中,出現了部分玻璃化現象(圖2-A3).研究證明,通過增加植物的抗氧化作用或消除過氧化物及活性氧自由基可有效減少組培苗的玻璃化[16].本實驗中在葉片愈傷組織繼代及芽從增殖培養基中分別加入500 mg/LAgNO3和500 mg/L抗壞血酸后,結果發現,在加入500 mg/LAgNO3的培養基中明顯緩解組培苗玻璃化現象.

