原發性胃癌患者血清中胃蛋白酶原、胃泌素含量檢測及其與腫瘤惡性程度的相關性分析
郭俊賢 李麗萍
(河南省濮陽市安陽地區醫院消化內科 安陽455000)
原發性胃癌是臨床最多見的消化系統惡性腫瘤性疾病之一,目前疾病早期確診率仍不高[1]。 胃蛋白酶原(PG)、胃泌素(G)均是正常胃黏膜細胞分泌的消化酶,可反映不同胃黏膜組織的形態與功能,檢測其含量對胃部疾病的早期篩查、診斷具有一定臨床意義,且檢測操作可重復進行、無侵入性損害[2]。 原發性胃癌患者是否存在PG、G 等消化酶含量的特殊改變,換言之,檢測PG、G 含量能否作為原發性胃癌診斷及病情判斷的輔助指標,仍存在爭議。 本研究對比胃部良惡性疾病患者血清中PG、G 含量的差異,并進一步探討其含量與胃癌細胞惡性生物學行為的內在聯系, 以期明確PG、G 在原發性胃癌診斷及治療指導中的價值。 現報道如下:
1 資料與方法
1.1 一般資料 選取 2017 年 8 月 ~2019 年 10 月在本院接受手術治療的原發性胃癌患者98 例作為胃癌組,均經病理確診,入院前未經其他保守治療、術前無新輔助化療。 同期在本院進行胃鏡檢查并切除息肉的胃息肉患者77 例作為胃息肉組。 胃癌組男 51 例,女 47 例;年齡 41~78 歲,平均(69.26±8.53)歲。 胃息肉組男 40 例,女 37 例;年齡 38~79歲,平均(68.71±9.62)歲。 兩組胃部疾病患者的性別、年齡比較,差異無統計學意義(P>0.05)。醫院醫學倫理委員會通過研究計劃書。
1.2 血清PG、G 含量檢測 入組即刻(未經任何治療),留取兩組患者外周血標本3 ml 并分離血清,采用全自動酶標儀檢測其中胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、胃泌素 -17(G-17)的含量,計算PGⅠ/PGⅡ比值。
1.3 胃部病灶組織中惡性分子表達量檢測 留取原發性胃癌患者術中胃癌病灶組織標本、 胃息肉患者的息肉組織標本,采用熒光定量PCR 法檢測其中胃癌相關增殖、侵襲基因表達量,按照試劑盒說明書進行操作并計算表達量。 具體胃癌相關增殖基因包括 Gli1、Septin2、Klotho, 胃癌相關侵襲基因包括FHL2、IGF1R、FMNL2、Exosomes、GKN2。
1.4 統計學方法 胃蛋白酶原及胃泌素含量,增殖、侵襲基因表達量均屬于計量資料,以()表示,由具備專業統計學資質的人員(同一人)將其錄入軟件SPSS24.0 中,經t檢驗計算得到統計值P,經Pearson 檢驗進行相關性分析。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組血清PG、G 含量比較 胃癌組患者血清PGⅠ、PGⅡ含量及PGⅠ/PGⅡ比值低于胃息肉組,G-17 含量高于胃息肉組, 差異有統計學意義(P<0.05)。 見表 1。
表1 兩組血清 PG、G 含量比較()

表1 兩組血清 PG、G 含量比較()
組別 n PGⅠ(μg/L) PGⅡ(μg/L) PGⅠ/PGⅡ G-17(pmol/L)胃息肉組胃癌組77 98 tP 109.46±13.26 63.21±10.18 26.105 0.000 9.32±1.27 8.07±0.95 7.448 0.000 11.46±1.94 7.29±0.81 19.260 0.000 11.37±1.98 17.60±2.97-15.843 0.000
2.2 兩組胃癌相關增殖基因表達量比較 胃癌組病灶組織中增殖基因Gli1、Septin2 mRNA 的表達量高于胃息肉組,Klotho mRNA 的表達量低于胃息肉組,差異有統計學意義(P<0.05)。 見表 2。
表2 兩組胃癌相關增殖基因表達量比較()
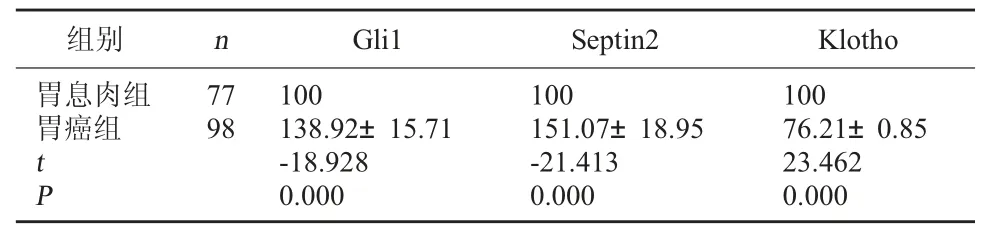
表2 兩組胃癌相關增殖基因表達量比較()
組別 n Gli1 Septin2 Klotho胃息肉組胃癌組tP 77 98 100 138.92±15.71-18.928 0.000 100 151.07±18.95-21.413 0.000 100 76.21±0.85 23.462 0.000
2.3 兩組胃癌相關侵襲基因表達量比較 胃癌組病灶中侵襲基因 FHL2、IGF1R、FMNL2、Exosomes mRNA 的表達量高于胃息肉組,GKN2 mRNA 的表達量低于胃息肉組,差異有統計學意義(P<0.05)。見表3。
表3 兩組胃癌相關侵襲基因表達量比較()

表3 兩組胃癌相關侵襲基因表達量比較()
?
2.4 相關性分析 Pearson 檢驗發現, 原發性胃癌患者血清中PGⅠ、PGⅡ含量及PGⅠ/PGⅡ比值與Gli1、Septin2、FHL2、IGF1R、FMNL2、Exosomes mRNA的表達量呈負相關(r=-0.314、-0.342、-0.294、-0.307、-0.318、-0.344,P<0.05),與 Klotho、GKN2 mRNA 的表達量呈正相關(r=0.351、0.389,P<0.05)。 原發性胃癌患者血清中 G-17 的含量與 Gli1、Septin2、FHL2、IGF1R、FMNL2、Exosomes mRNA 的表達量呈正相關(r=0.375、0.309、0.412、0.423、0.297、0.388,P<0.05),與 Klotho、GKN2 mRNA 的表達量呈負相關(r=-0.374、-0.291,P<0.05)。
3 討論
PG 是胃蛋白酶的前體, 包括PGⅠ、PGⅡ兩個亞型,PGⅠ/PGⅡ比值水平反映胃黏膜萎縮程度,隨黏膜萎縮加劇,PGⅠ/PGⅡ比值進行性下降[3]。 G 是由胃幽門部的G 細胞分泌, 哺乳類動物的G 均為17 個氨基酸的多肽、即G17[4]。本研究中胃癌組患者PGⅠ、PGⅡ含量及PGⅠ/PGⅡ比值均較良性病變患者大幅下降,血清G-17 含量高于胃息肉組患者。目前關于PGⅠ/PGⅡ及G17 含量能否反映胃癌細胞惡性生物學行為這一命題尚不清楚。
Gli1 是Hedgehog 信號通路的核心分子, 該通路激活已被證實與多種惡性腫瘤細胞的增殖侵襲相關[5]。Septin2 是一種細胞骨架成分,參與細胞內物質運輸、細胞周期及凋亡等生理過程調控,參與腫瘤惡性增殖過程[6]。 Klotho 是與抗衰老相關的基因,在多種惡性腫瘤組織中呈低表達,被認為是一種抑癌基因。 本研究胃癌組病灶中Gli1、Septin2 mRNA 的表達量較高,Klotho mRNA 的表達量較低, 與各個基因的病理學作用一致。 相關性分析進一步證實,原發性胃癌患者血清PGⅠ、PGⅡ含量及PGⅠ/PGⅡ比值與Gli1、Septin2 mRNA 的表達量呈負相關,與Klotho mRNA 的表達量呈正相關; 而G-17 含量與Gli1、Septin2 mRNA 的表達量呈正相關, 與 Klotho mRNA 的表達量呈負相關,說明PG、G 的含量異常可客觀反映胃癌細胞的增殖活力。
腫瘤細胞的侵襲也由多種分子介導。 FHL2、FMNL2 通過促進上皮-間質轉化使細胞獲得侵襲能力;IGF1R 通過PI3K/AKT 信號通路促進癌細胞增殖、侵襲、遷移;Exosomes 通過刺激血管新生、幫助細胞免疫逃逸等途徑加速癌細胞的侵襲轉移;GKN2 是GKNs 的亞型, 有助于維持胃上皮內環境并抑制腫瘤發生, 其異常低表達是胃癌發生的重要原因。 本研究胃癌組病灶中 FHL2、IGF1R、FMNL2、Exosomes mRNA 的表達量較高且與PGⅠ/PGⅡ比值呈負相關、與G-17 呈正相關,GKN2 mRNA 的表達量較低且與PGⅠ/PGⅡ比值呈正相關、 與G-17呈負相關, 說明原發性胃癌患者血清中PG、G 含量可客觀反映癌細胞的侵襲活力。
綜上所述, 原發性胃癌患者血清中PG、G 含量異于良性病變者, 且含量與癌細胞的增殖及侵襲活力直接相關。 早期檢測血清PG、G 含量可作為原發性胃癌篩查、輔助診斷、病情判斷等重要手段。

