α1-抗胰蛋白酶抑制高糖誘導大鼠視網膜Müller細胞凋亡實驗研究
田蘊霖,白淑瑋,邵 娟
(西安市人民醫院 西安市第四醫院眼科,陜西 西安 710004)
Müller細胞與感光細胞以及其它的神經元緊密相連,是一種損傷誘導的干細胞。其也為貫穿視網膜全層的放射狀膠質細胞,可通過降解谷氨酸等作用,發揮保護神經元的作用[1-2]。絕大多數活化的Müller細胞都停留在幼稚階段,但是周圍環境的變化可影響Müller細胞功能[3]。視網膜病變是臨床上比較常見的眼科疾病,多為高糖誘發而產生[4]。特別是高糖可破壞血-視網膜屏障,引起脈絡膜毛細血管與視網膜血管灌注不足,促使Müller細胞凋亡[5]。當前視網膜病變的治療方法比較多,其中手術治療具有比較好的效果,但是為有創性操作,可能對患者的預后產生負面影響。常規藥物治療在一定程度上能減緩視網膜病變病程進展,但是患者的復發率比較高[6]。α1-抗胰蛋白酶(α1-antitrypsin,AAT)屬于絲氨酸蛋白酶抑制劑家族,主要在肝細胞中合成,由394個氨基酸組成,具有絲氨酸蛋白酶抑制劑的作用[7-8]。信號轉導及轉錄活化因子3(Signal transducers and activators of transcription 3,STAT3)是一類DNA結合蛋白,可表達于眼上皮細胞中,也可參與細胞凋亡等過程[9-10]。本文具體探討了AAT抑制高糖誘導大鼠視網膜Müller細胞凋亡的效果與機制,希望為視網膜病變的治療提供更好的方法。
1 材料與方法
1.1 實驗材料 大鼠視網永生化膜Müller細胞系購自上海生命科學院,用含有10%胎牛血清的RPMI-1640培養基在37 ℃、5%CO2培養箱中進行培養。RPMI-1640高糖培養基、胎牛血清購自美國Gibco公司、MTT檢測試劑盒購于美國Promega公司,Annexin V-FITC PI檢測試劑盒購于美國Invitrogen公司,外源性AAT購自美國Corning公司,兔抗人一抗與二抗購自英國Abcam公司,青-鏈霉素購于美國Gbico公司。
1.2 細胞分組與處理 待Müller細胞密度達到80%時,用0.25%胰蛋白酶消化細胞,取對數期生長細胞進行試驗。將細胞分為三組:模型組、試驗A組、試驗B組,分別加入不同濃度的外源性AAT 100 μl(加藥濃度分別為0、10、100 pg/ml),處理不同時間點換回高糖培養基進行培養。
1.3 MTT法檢測細胞增殖 將細胞濃度調整至1×105個/ml,在96孔板培養,加入20 μl 0.5 mg/ml MTT,培養6 h后再向每孔加入150 μl DMSO,震蕩培養10 min后,使用酶標儀檢測細胞光密度(波長=540 nm),檢測與計算細胞增殖指數。
1.4 流式細胞儀檢測細胞凋亡 將細胞濃度調整至1×103個/ml,采用200 μl結合緩沖液重懸細胞,然后再加入5 μl PI與的10 μl Annexin V-FITC,暗室下室溫反應15 min,采用BD公司的流式細胞儀檢測凋亡指數。
1.5 Transwell小室法檢測細胞侵襲 在Transwell上室當中添加Müller細胞100 μl,在下室添加600 μl培養基,培養6 h固定并染色微孔膜下層細胞,在400倍光學顯微鏡下進行觀察,計算細胞侵襲指數。
1.6 Western blot法檢測蛋白表達 收取細胞后消化后提取細胞的總蛋白,上樣20 μg蛋白進行電泳,轉膜后進行4 ℃過夜封閉,在含有相應一抗溶液的抗體孵育盒中(稀釋比例為1∶1000)進行孵育,4 ℃過夜,洗滌3次后,再將膜孵育二抗中(稀釋比例為1∶5000),室溫孵育1 h,洗滌3次后進行暗室曝光,檢測GAPDH、STAT3蛋白相對表達水平。上述實驗都重復3次,取平均值作為最終值。
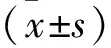
2 結 果
2.1 三組細胞增殖指數對比 處理3、6 h后,試驗A組、試驗B組的細胞增殖指數均高于對照組(均P<0.05),試驗B組高于試驗A組(P<0.05),見表1。

表1 三組不同時間點細胞增殖指數對比(%)
2.2 三組細胞凋亡指數對比 處理3、6 h后,試驗A組、試驗B組的細胞凋亡指數均低于對照組(均P<0.05),試驗B組低于試驗A組(P<0.05),見表2。

表2 三組不同時間點細胞凋亡指數對比(%)
2.3 三組細胞侵襲指數對比 處理3、6 h后,試驗A組、試驗B組的細胞侵襲指數均高于對照組(均P<0.05),試驗B組高于試驗A組(P<0.05),見表3。

表3 三組不同時間點細胞侵襲指數對比(%)
2.4 三組STAT3蛋白相對表達水平對比 處理3、6 h后,試驗A、B組的STAT3蛋白相對表達水平均低于對照組(均P<0.05),試驗B組低于試驗A組(P<0.05),見表4。

表4 三組不同時間點STAT3蛋白相對表達水平對比
3 討 論
Müller細胞對于維持視網膜的生長與發育具有重要的作用,在內外在各種因素的影響下,當機體視網膜受損時,比如高血糖可破壞血-視屏障功能,可損傷視網膜血管系統。不過此時環視網膜Müller細胞可大量活化和增殖,逆分化為視網膜干細胞,在一定程度下可替代損傷的細胞,促進恢復視網膜功能[11-12]。但是很多Müller細胞的功能受限,為此在高糖環境下提高Müller的增殖能力具有重要價值[13]。
AAT是機體血清中最豐富的蛋白酶抑制因子之一,主要由肝臟產生。AAT一般還具有較強的血管通透性,在Müller細胞中也有一定的表達,并且對視網膜組織具有一定的保護作用[14]。AAT也為一個急性反應蛋白,當人在處于感染或者炎癥發生時,血清中 AAT的濃度會出現明顯升高[15]。本研究顯示處理3、6 h后,試驗A組、試驗B組的細胞增殖指數、侵襲指數高于對照組,試驗B組高于試驗A組。從機制上分析,AAT可以激活 MAPK信號通路,從而促進纖維細胞的增殖,可緩解高血糖引發的視網膜屏障功能紊亂及血管異常新生,提高Müller的增殖與侵襲能力[16]。
高糖環境可導致視網膜外層細胞的破壞,促進Müller細胞凋亡,使得內層視網膜皺褶、萎縮,從而導致視網膜功能下降甚或喪失[17-18]。AAT是由內胚層上皮細胞產生和分泌的一種糖蛋白,突變型p53能夠上調AAT的表達,導致惡性腫瘤的發生發展,且與惡性腫瘤的不良預后有關[19]。AAT也能夠促進血管生成素樣蛋白4的表達,增強腫瘤的血管生成能力[20]。本研究顯示處理3、6 h后,試驗A組、試驗B組的細胞凋亡指數低于對照組,試驗B組低于試驗A組,表明AAT能高糖誘導大鼠視網膜Müller細胞的凋亡。當前也有研究顯示AAT可導組細胞可以通過調控 NF-κB信號通路,從而抑制上皮細胞炎癥因子的表達,改善患者的病情[21]。
STAT3可在多種細胞、組織、器官中進行表達,在人類定位于第12號染色體,STAT3蛋白分子量為84~113 kDa,由750~850個氨基酸組成[22]。STAT3蛋白結構域中包括亮氨酸拉鏈結構(bZIP),可以通過其bZIP結合其他含bZIP蛋白調控轉錄,從而發揮相關疾病的調控作用[23-24]。本研究顯示處理3、6 h后,試驗A組、試驗B組的STAT3蛋白相對表達水平低于對照組,試驗B組低于試驗A組,表明AAT的應用能抑制STAT3的表達,從而保護機體免除炎性因子的損壞,抑制炎癥反應。不過本研究沒有進行動物模型分析,且沒有設置空白對照組,將在后續研究中進行探討。
綜上所述,AAT可抑制高糖誘導大鼠視網膜Müller細胞的凋亡,促進細胞增殖與侵襲,其作用機制可能與抑制STAT3表達有關。

