三陰性乳腺癌臨床病理特征與基因分型研究
李秀華,唐冬梅,朱麗萍,董 楠,李 甡
(錦州醫科大學附屬第一醫院,遼寧 錦州 121001)
乳腺癌是一種全身性異質性疾病,是女性最常見、發病率最高的惡性腫瘤,包括多種類型,其中,免疫組織化學檢查中雌激素受體(ER)、孕激素受體(PR)及人表皮生長因子受體2(HER-2)表達均為陰性者稱為的三陰性乳腺癌(Triple negative breast cancer,TNBC)[1], TNBC患者基因突變大、異質性特殊、病情進展快,且缺乏分子治療靶點,因而治療效果極差,病死率高[2]。如何改善TNBC患者預后,提高其生存率是當前腫瘤學和臨床醫學研究關注的焦點[3]。治療方案的科學地制定和療效提高需要以精準評估病情為前提,近些年來,我們結合臨床實際,開展了對三陰性乳腺癌的臨床病理特征與生物學特性研究,以期從不同的臨床病理特征和基因表達亞型表現中探尋三陰性乳腺癌的發病原因及預后因素,為針對性地做好相關防治工作提供啟發與參考。
1 對象與方法
1.1 研究對象 選取2011年1月至2015年12月我院收治的157例乳腺癌患者作為研究對象,均為女性,年齡34~79歲,平均(48.5±15.7)歲;腫瘤直徑0.2~6.3 cm,平均(2.7±1.6)cm;淋巴結轉移0~22個,平均(5.2±3.7)個。病例納入標準:①經病理檢查確診患原發性乳腺癌;②具有完整的病理資料;③可以接受組織學檢測及MRI等影像學檢查。排除標準:①合并有其他腫瘤疾病的患者;②臨床資料不完整者;③不愿或不能接受相關項目檢測的患者。本研究入選患者和或家屬均知情同意,并經本院倫理委員會批準。
1.2 TNBC的判定 參照文獻[4],采用免疫組織化學法測定157例乳腺癌患者ER、PR和HER-2水平,腫瘤細胞核內激素受體表達標記陽性<1%均視為PR、ER呈陰性,HER-2值<1.8均視為HER-2呈陰性。凡ER、PR和HER-2均呈陰性者確診為TNBC列入觀察組,其余均為非三陰性乳腺癌(NTNBC),列為對照組。
1.3 基因分型 參照文獻[5],采用Taq Man檢測試劑盒(賽默飛世爾科技公司提供)檢測基因序列表達,操作嚴格按試劑盒說明進行:增殖相關基因、Ki-67和DAN損傷修復基因高表達、細胞周期檢測蛋白相關基因低表達者為基底細胞樣1型(Basal-like 1,BL1);以淋巴細胞浸潤、T細胞受體缺失者為基底細胞樣2型(Basal-like 2,BL2);分化和生長因子通路及上皮間質轉化相關基因均呈高表達為間質型(Mesenchymal,M);腫瘤干細胞基因和間質干細胞特異性標記物高表達、增殖相關基因、Claudin基因低表達為間質干細胞樣型(Mesenchymal stem-like,MSL);免疫細胞信號、抗原呈遞、細胞因子受體與配體高表達為免疫調節型(Immuno modulatory,IM);激素受體調節通路、雄激素受體、管腔型相關基因高表達為管腔雄激素受體型(Luminal androgen receptor,LAR)。
1.4 治療方案 所有病例均接受外科手術治療,手術方式包括根治術及保乳術,術后根據患者病理、臨床分期及基因分型輔助以化療、放療、內分泌治療及靶向治療等。輔助化療主要采用以蒽環類和紫杉類為基礎的方案,可采用聯合紫杉類化療方案。若腫瘤>5 cm、有淋巴結轉移,輔助以放射治療,放療劑量50 Gy/25 f。根據患者的月經狀態選擇內分泌藥物,靶向治療以曲妥珠單抗為主要藥物。
1.5 觀察指標 ①調查157例乳腺癌患者年齡、體重指數、產次、泌乳及使用避孕藥情況,并按年齡是否超過60歲、體重指數是否超過25 kg/m2、產次是否在2次以上、是否泌乳及是否長期使用避孕藥物分組進行統計比較。②記錄手術后的腫瘤大小、淋巴結個數,分組統計腫瘤大小和淋巴結狀態,采用美國癌癥聯合委員會的分期分級系統分組進行病理分類、臨床分期和組織學分級。
1.6 預后隨訪 以門診定期復查及電話、微信咨詢相結合的方式隨訪。術后第1天為隨訪起始時間,截止時間為2020年12月,隨訪5年,隨訪內容主要包括局部復發、遠處轉移的部位、死亡時間等。局部復發指臨床或病理顯示同側胸壁或區域淋巴結復發,遠處轉移指臨床及影像學檢查顯示有遠處轉移。
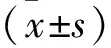
2 結 果
2.1 兩組患者一般資料比較 比較觀察組與對照組兩組患者的年齡、體重指數、產次、泌乳情況、使用避孕藥情況,除年齡因素外,其余均存在統計學差異(均P<0.05),見表1。

表1 兩組乳腺癌患者一般資料比較(例)
2.2 病理種類 經病理組織學檢測,157例乳腺癌患者中,ER、PR和HER-2均呈陰性者,共38例(占24.2%),經分子生物學技術檢測,38例TNBC患者包含六種亞型,其中,基底細胞樣1型(BL1)13例、基底細胞樣2型(BL2)11例、間質型(M)4例、間質干細胞樣型(MSL)5例、免疫調節型(IM)3例、管腔雄激素受體型(LAR)2例。
2.3 臨床病理特征 觀察組與對照組比較,在病理分型、TNM分期、乳頭浸潤和淋巴結狀態方面,差異具有統計學意義(均P<0.05);而發病部位、腫瘤大小方面對比,差異無統計學意義(均P>0.05)。見表2。

表2 TNBC與NTNBC主要臨床病理特征對比(例)
2.4 TNBC與NTNBC臨床病理多因素分析 以確診TNBC為應變量,將以上單因素分析結果中有統計學意義的自變量視為影響因素進行非條件logistic回歸分析,見表3。

表3 TNBC與NTNBC臨床病理多因素分析
2.5 復發轉移率與生存率 隨訪5年,觀察組與對照組在術后局部復發率、遠處轉移率與3、5年生存率方面均存在統計學差異(均P<0.005),見表4(圖1、2)。

表4 兩組患者復發轉移率與生存率比較[例(%)]

3 討 論
TNBC是乳腺癌的一種特殊類型,約占15%~20%[6],本研究中為24.2%,表明TNBC的發病率開始呈增高趨勢。TNBC雖不是乳腺癌占比最高主要類型,但卻是預后最差、病死率最高的一種類型[7]。目前TNBC的主要病因、病理特征和分子生物學特征尚未形成統一的定論,如何及時診斷、有效防治TNBC,增強療效、改善預后依然是研究熱點[8]。了解、掌握三陰乳腺癌病理特征首先需要分析臨床特征,揭示其發病的社會因素。有研究[9]表明,初潮年齡提前、肥胖、產次和流產次數增加、抑制泌乳,甚至使用避孕藥物都可能是導致三陰乳腺癌發病率增高的重要因素。本研究發現,觀察組與對照組年齡差異不大,但觀察組患者體重指數、產次、抑制泌乳及避孕藥使用例數顯著高于對照組,表明體重高、產次(含流產)多、經常抑制泌乳并使用避孕藥都是誘發TNBC的高危因素,需要做好相關預防工作。臨床研究[9]表明,TNBC存在壓迫臨近組織且中心壞死,導致間質淋巴細胞浸潤、有絲分裂指數高、核分級高等特殊的臨床病理學特性。本研究也進一步證實三陰乳腺癌患者病理類型以浸潤性導管癌和小葉癌為主,淋巴結遠處轉移率高,臨床分期和組織學分級更晚,整體惡性程度高。TNBC是乳腺癌的一個種類,分析其分子特性后發現,TNBC還可進一步作基因亞型分類,本研究中,我們將38例三陰性乳腺癌患者又分為了六種基因表達亞型,而細分亞型種類有助于發現腺癌基因表達和特定基因突變之間存的關聯,為尋找特異的治療靶點、加強個體化治療提供重要依據[10]。如基底細胞樣1型(BL1)表明基底角蛋白表達,基底細胞樣2型(BL2)表明基因PTEN突變/缺失,免疫調節型(IM)表明淋巴細胞浸潤、T細胞受體缺失,間充質干細胞樣型(MSL)表明克勞丁基因高表達、基礎角蛋白呈低表達[11]。因此,相應地,PARP抑制劑可用于治療BL1、BL2和MSL,PI3K抑制劑可用于治療BL2、IM和LAR型TNBC;IM要重點加強免疫治療,BL1還可用鉑類和蒽環或紫衫治療。可見,做好乳腺癌基因分型有助力于為針對性治療提供技術支持[12-13]。本研究中,雖然TNBC患者的復發轉移率高于NTNBC,3、5年生存率低于NTNBC,但5年生存率仍高達73.68%。這一方面說明TNBC惡性程度高、預后差、病死率遠高于NTNBC[14],也表明TNBC患者手術后分亞型做好化療、放療、內分泌治療及靶向治療等輔助治療,尤其是術前新輔助化療可進一步降低TNBC患者臨床病死率,提高患者生存質量[15]。
需要指出的是,分析三陰乳腺癌臨床病理特征,探討基因分型最終目的在于改進TNBC的治療手段,提高臨床療效[16]。但受條件所限,本研究依然存在樣本偏少,對病理特征分析仍不夠全面,尤其是沒有深入揭示TNBC病理特征和基因分型與改進治療手段、提高療效的辯證關系,有待于今后研究中進一步深入探討。組織學檢測是三陰性乳腺癌病理評價的金標準,分子學檢測是TNBC基因表達亞型分類的主要手段,但隨著醫學技術進步,使用影像的手段也可進行相關評價[17],尤其是磁共振彌散加權成像(DW-MRI)對軟組織及空間分辨率較高,且無輻射,對乳腺病變敏感性強,可系統性預測三陰性乳腺癌的某些病理特征,這對于如何快捷、無創評價三陰性乳腺癌病理特征提供了新的思路[18-19]。
綜上所述,三陰性乳腺癌具有特殊病理特征及生物學特性,全面分析病理特征有利于探尋TNBC高危因素的形成原因,加強相關預防工作;做好分子分型能從病變內部的血流動力學及組織細胞活性上客觀評價病變,有利于TNBC個體化治療[20-21],為三陰性乳腺癌治療以及預后判斷提供更多更有價值的臨床信息。

