青光安Ⅱ號方對誘導損傷的RGC-5細胞中NF-κB/HIF-1α通路相關細胞因子的影響
姚小磊 時健 劉倩宏 陳立浩 侯念婷
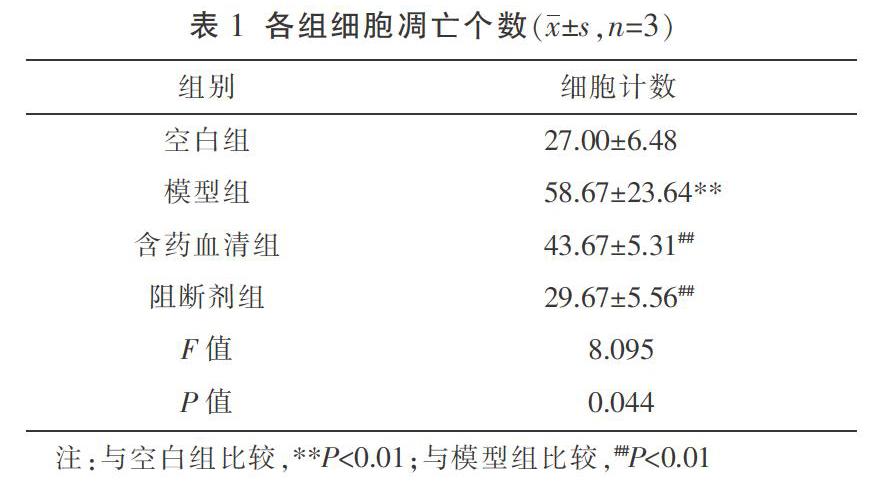
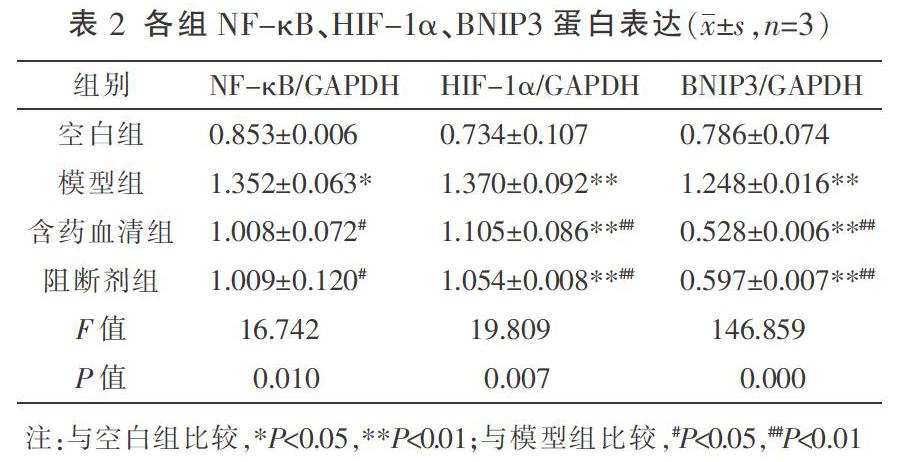
〔摘要〕 目的 觀察青光安Ⅱ號方對谷氨酸誘導損傷的RGC-5細胞中核因子κB(nuclear factor kappa-B, NF-κB)、低氧誘導因子-1α(hypoxia inducible factor-1,HIF-1α)、BCL2/腺病毒E1B相互作用蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3, BNIP3)、超氧化物歧化酶(superoxide dismutase, SOD)及丙二醛(malondialdehyde, MDA)的影響。方法 體外培養RGC-5細胞,分為4組:空白組、模型組、含藥血清組和阻斷劑組。模型組、含藥血清組和阻斷劑組予以谷氨酸誘導細胞損傷,模擬青光眼對神經節細胞的損傷,含藥血清組加入青光安Ⅱ號方含藥血清,阻斷劑組加入KC7F2進行HIF-1α通路的阻斷。以CCK-8法摸索含藥血漿以及谷氨酸的最佳干預濃度;采用Hoechst法檢測各組細胞的凋亡情況;Western blot檢測NF-κB、HIF-1α、BNIP3蛋白表達情況;比色法檢測SOD、MDA的表達情況。結果 CCK8法確定青光安Ⅱ號方5倍組含藥血清為實驗量,確定谷氨酸的最佳干預濃度為200 μM。與空白組比較,模型組NF-κB、HIF-1α、BNIP3、SOD、MDA表達顯著升高(P<0.05);與模型組比較,含藥血清組、阻斷劑組NF-κB、HIF-1α、BNIP3和SOD的表達顯著降低(P<0.05);含藥血清組與阻斷劑組的NF-κB、HIF-1α、BNIP3、SOD及MDA差異均無統計學意義(P>0.05)。結論 青光安Ⅱ號方對NF-κB具有抑制作用,進而抑制了HIF-1α相關通路的激活,減弱了由于氧化應激所致RGC-5細胞的凋亡,對RGC具有保護作用。
〔關鍵詞〕 青光眼;青光安Ⅱ號方;視網膜神經節細胞;核因子κB;低氧誘導因子-1α;BCL2/腺病毒E1B相互作用蛋白3;超氧化物歧化酶;丙二醛
〔中圖分類號〕R276.7 ? ? ? 〔文獻標志碼〕A ? ? ? 〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.07.004
〔Abstract〕 Objective To observe the effects of Qingguangan Ⅱ Formula on nuclear factor kappa-B (NF-κB), hypoxia inducible factor-1 (HIF-1α), BCL2/adenovirus E1B 19kDa interacting protein 3 (BNIP3), superoxide dismutase (SOD) and malondialdehyde (MDA) in RGC-5 cells injury induced by glutamate. Methods The RGC-5 cells cultured in vitro were divided into 4 groups: blank group, model group, drug-containing serum group and blocker group. Glutamic acid was added to model group, drug-containing serum group and blocker group to simulate retinal ganglion cell damage caused by glaucoma, and Qingguangan Ⅱ Formula serum was added to drug-containing serum group, and the blocker group was added with KC7F2 to block the HIF-1α pathway. The CCK-8 method was used to find optimal intervention concentration of drug-containing plasma and glutamate; Hoechst method was used to detect the apoptosis of cells in each group; Western blot was used to detect the expression of NF-κB, HIF-1α, BNIP3; colorimetry was used to detect the expression of SOD and MDA. Results CCK8 method determined 5 times serum content as the Qingguangan Ⅱ Formula experimental amount, and the optimal intervention concentration of glutamate was 200 μM. Compared with blank group, the expression of NF-κB, HIF-1α, BNIP3, SOD and MDA increased significantly in the model group (P<0.05); compared with the model group, the expression of NF-κB, HIF-1α, BNIP3 and SOD in the drug-containing serum group and blocker group significantly decreased (P<0.05) ; there was no statistically significant difference between NF-κB, HIF-1α, BNIP3, SOD and MDA in drug-containing serum group and blocker group (P>0.05). Conclusion Qingguangan II Formula has an inhibitory effect on NF-κB, thereby inhibiting the activation of HIF-1α related pathways, reducing the apoptosis of RGC-5 cells caused by oxidative stress, it also has a protective effect on RGC.
〔Keywords〕 Qingguangan Ⅱ Formula; retinal ganglion cell; nuclear factor kappa-B; hypoxia inducible factor-1; BCL2/adenovirus E1B 19 kDa interacting protein 3; superoxide dismutase; malondialdehyde
青光眼為導致人類失明的三大眼類疾病之一。調查顯示,2020年全球青光眼患病人數高達7 600萬,其中我國占2 100萬,位居世界之首[1],目前,超過40歲以上人群青光眼的總患病康復率僅有1.5%~3.6%[2],治療方案主要以控制眼壓來保存視力,但是青光眼導致的視神經損傷卻不可逆,且沒有較好的視神經保護方案。彭清華教授通過多年臨床經驗總結出“青光安Ⅱ號方”,研究表明其有較好的臨床療效,尤其對青光眼術后仍存在視力下降的患者,有較好的視神經保護效應[3],但其具體的機制并不清楚。動物實驗中發現青光安Ⅱ號方對于Caspase-3有影響,可減少視網膜神經細胞的凋亡[4]。有研究表明,青光眼的視神經損傷可能與氧化應激有關[5-6],活性氧的增加是小膠質細胞在高眼壓過程中死亡的主要原因[7]。因此,本研究通過實驗的方法探討青光安Ⅱ號方對RGC-5細胞模型[8]中核因子κB(nuclear factor kappa-B, NF-κB)/低氧誘導因子-1α(hypoxia inducible factor-1, HIF-1α)通路中相關因子的影響,以期明確其視神經保護的相關機制。
1 材料與方法
1.1 ?動物及細胞
取健康SPF級雄性和雌性SD大鼠各30只,由湖南省斯萊克景達實驗動物有限公司提供,許可證號:SCXK(湘)2019-2004,體質量0.17~0.28 kg。動物實驗倫理合格證號:LL2019121901。RGC-5細胞株(批號:CP-M122,武漢普諾賽生命科技有限公司)。
1.2 ?藥物
中藥配方:黃芪(批號:CK19111807)、枸杞子(批號:SL19112203)、燈盞細辛(批號:2019011616)、牛膝(批號:CK19101401)、川芎(批號:SL19111503)、女貞子(批號:2019011201)均購自湖南中醫藥大學第一附屬醫院。
1.3 ?試劑與儀器
CCK-8試劑盒(批號:CA1210)、30%制膠液(批號:A1010)均購自索萊寶公司;總超氧化物歧化酶(superoxide dismutase, SOD)測定試劑盒(批號:A001-3-2)、丙二醛(malondialdehyde, MDA)測定試劑盒(批號:A003-1)均購自南京建成公司;Tris(中國醫藥集團有限公司,批號:30188216);5×SDS-PAGE蛋白上樣緩沖液(批號:P0015L)、ECL發光液(批號:P0018S-2)均購自上海碧云天生物技術有限公司;蛋白Marker(賽默飛世爾科技公司,批號:26617);PVDF膜(美國密理博公司,批號:IPVH00010);膜再生液(北京普利萊基因技術有限公司,批號:P1650);HIF-1α(批號:ab1)、BCL2/腺病毒E1B相互作用蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3,BNIP3)(批號:ab109362)、NF-κB(批號:ab16502)均購自上海Abcam生物技術有限公司;GAPDH(美國proteintech公司,批號:10494-1-AP);羊抗兔-HRP(北京博奧森生物技術有限公司,批號:bs-0295G-HRP);KC7F2(上海浩洋生物科技有限公司,批號:S7946)。
酶標儀(上海碧云天生物技術有限公司,型號:Synergy H4);KHB洗板機(上海科華實驗系統有限公司,型號:ST-36WT);電泳儀(伯樂生命醫學產品有限公司,型號:1645070);電轉儀(伯樂生命醫學產品有限公司,型號:BE6085);全自動化學發光圖像分析系統(上海天能科技有限公司,型號:5200)。
1.4 ?含藥血清的獲取
將60只SD大鼠隨機分成青光安Ⅱ號方10倍組、青光安Ⅱ號方5倍組、青光安Ⅱ號方2.5倍組和空白組。按體表面積換算的方法計算出每只大鼠的灌藥量,灌藥大鼠均按照10倍成人等效劑量灌胃。適應性飼養1 d后開始灌胃,空白對照組灌同等劑量的生理鹽水,每日1次。灌胃7 d后,提取血清。取血方法:每只大鼠麻醉前1 h灌胃,大鼠麻醉、固定,頸總動脈采血,離心提取含藥血清和空白血清。青光安Ⅱ號方10倍組:所取血清即為高劑量血清;青光安Ⅱ號方5倍組:所取血清加入1倍體積DMEM低糖培養基,設為中劑量血清;青光安Ⅱ號方2.5倍組:所取血清加入3倍體積DMEM低糖培養基,設為低劑量血清。收集的血清56 ℃下滅活補體30 min,按組別混合后放-80 ℃冰箱保存。
1.5 ?含藥血清加入量及谷氨酸加入量的摸索
采用CCK-8法確定含藥血清及谷氨酸加入量。將細胞以2×104個/mL、200 μL/孔的密度接種在96孔板中,在37 ℃、5% CO2箱中培養24 h,移出孔板,分別加入0、25、100、200 μM的谷氨酸;繼續放回37 ℃、5% CO2箱進行培養;24 h干預后取出96孔板;向每個孔中添加10 μL CCK-8反應溶液;在37 ℃、5% CO2箱中繼續孵育2 h;用酶標儀測量450 nm處的吸光度(OD),并通過存活率判定各種濃度下的細胞增殖活性,由此選擇適當的谷氨酸濃度。同時按照上述方法分別加入3種不同濃度的24 μL含藥血清,通過存活率OD判定各種濃度下的細胞增殖活性。選擇適當的含藥血清濃度。
1.6 ?細胞模型建立及分組、干預
使用RGC-5細胞株,培養至狀態良好,體外培養的RGC-5細胞分為4組。空白組:10%胎牛血清的DMEM低糖培養基加空白血清進行培養。模型組:細胞培養基中加入谷氨酸,以此模擬RGC-5細胞損傷[8],10%胎牛血清的DMEM低糖培養基加空白血清進行培養。含藥血清組:細胞培養基中加入谷氨酸,以此模擬RGC-5細胞損傷[8],10%胎牛血清的DMEM低糖培養基加含藥血清進行培養。阻斷劑組:細胞培養基中加入谷氨酸,以此模擬RGC-5細胞損傷[8],10%胎牛血清的DMEM低糖培養基加含藥血清進行培養,合并使用阻斷劑KC7F2[9]2 μM處理。
1.7 ?Hoechst染色法檢測細胞凋亡
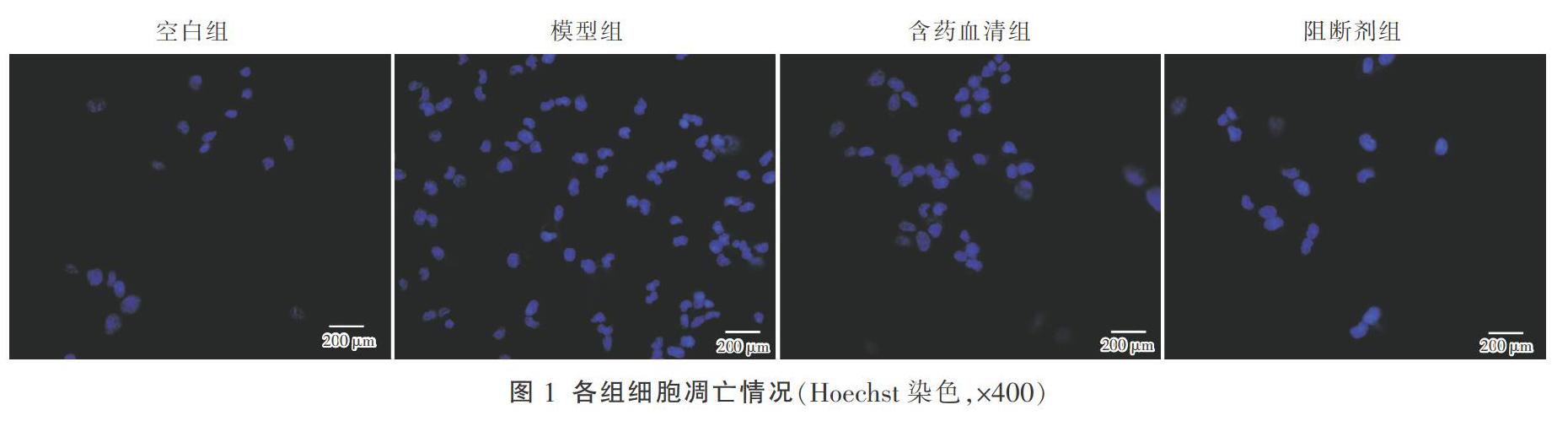
將細胞以2×104個/mL、2 mL/孔密度接種于6孔板爬片中,在37 ℃、5% CO2箱中培養24 h;取出孔板,按以上分組進行處理,先加入200 μM谷氨酸;繼續在37 ℃、5% CO2箱中培養24 h;取出孔板,按以上分組換入空白對照血清、5倍青光安血清、以及5倍青光安血清和KC7F2;繼續在37 ℃、5% CO2箱中培養24 h;取出孔板,吸去上清液,每孔加入1 mL Hochest染色劑,繼續在37 ℃、5% CO2箱中培養30 min;取出孔板,觀察是否出現熒光;如果出現熒光,首先吸去上清液,PBS清洗2次,封片。每組拍攝3次。
1.8 ?四氮唑藍(tetrazolium blue, NBT)核黃素比色法檢測SOD含量
樣品6倍稀釋后種于6孔板中培養至最佳狀態,加入底物、酶,測定孔、測定空白孔加樣品20 μL,對照孔、對照空白孔加超純水20 μL。對照孔、測定孔加酶工作液20 μL;對照空白孔、測定空白孔加酶稀釋液20 μL。每孔加底物應用液200 μL,混勻后37 ℃加熱20 min,450 nm處酶標儀讀數。結果計算公式:SOD抑制率=[(對照孔OD值-對照空白孔OD值)-(測定孔OD值-測定空白孔OD值)]/(對照孔OD值-對照空白孔OD值)×100%;SOD活力(U/mL)=SOD抑制率/50%×反應體系稀釋倍數×樣本測試前稀釋倍數。
1.9 ?硫代巴比妥酸(thiobarbituric acid,TBA)比色法檢測MDA含量
MDA試劑盒準備完畢后,配置相關試劑:(1)試劑一:37 ℃加熱溶解至透明;(2)試劑二:加170 mL超純水配制;(3)試劑三:加30 mL超純水后加熱95 ℃充分溶解,再加30 mL冰醋酸,混勻。空白管加無水乙醇20 μL,標準管加10 nmol/mL標準品20 μL,測定管加樣品20 μL。每管加試劑一20 μL,混勻。每管加試劑二3 mL,加試劑三1 mL。用針在離心管蓋上扎1個小孔,混勻后95 ℃加熱40 min,取出后流水冷卻,3 500 r/min離心10 min,離心半徑20 cm,取上清200 μL加入到酶標板中,532 nm處測各管吸光度值。結果計算公式:MDA含量(nmol/mL)=(測定管OD值-空白管OD值)/(標準管OD值-空白管OD值)×標準品濃度×稀釋倍數。
1.10 ?Western blot檢測NF-κB、HIF-1α、BNIP3蛋白的表達
RGC-5細胞長至90%鋪滿時再消化傳代。將細胞以5×104個/mL密度接種于6孔板中,2 mL/孔;按以上分組進行處理,37 ℃、5% CO2箱中繼續培養24 h;吸去上清液,PBS清洗1次;吸去PBS,每孔加入100 μL蛋白裂解液;細胞刮刀將細胞刮下后吸進1.5 mL離心管中,-80 ℃保存;從-80 ℃冰箱中取出樣本,置于冰上解凍,4 ℃下12 000 r/min離心20 min,離心半徑20 cm,取上清。采用BCA蛋白濃度測定試劑盒測定蛋白質濃度;根據濃度測定結果對蛋白濃度進行調整,保證不同組別之間蛋白濃度一致,每孔上樣量為30 μg,與適量5×loading buffer混勻,95 ℃、5 min后進行上樣,剩余樣本于
-80 ℃保存。制備電泳膠、上樣電泳、轉膜、封閉、孵一抗[用含2% BSA的TBST稀釋相應的一抗,NF-κB(1∶2 000)、HIF-1α(1∶500)、BNIP3(1∶2 000)];孵二抗[用封閉液稀釋HRP標記二抗(1∶5 000)]、顯色曝光、膜洗脫再生,再次進行封閉。內參孵育,加入二抗,曝光。曝光結果使用Image J軟件分析灰度值。
1.11 ?統計學分析
用SPSS 26.0軟件進行統計學分析,雙側檢驗,P<0.05為差異有統計學意義。計量資料用“x±s”表示。先進行正態性及方差齊性檢驗,若數據呈正態分布,且方差齊,則進行單因素方差分析。若分析結果顯示,各組間存在差異,則采用Tukey法進行多組比較。若不滿足正態性要求,則采用非參數檢驗,若分布正態但方差不齊者,則采用單因素方差分析。
2 結果
2.1 ?含藥血清和谷氨酸加入量的確定
含藥血清中空白組細胞存活率為100%,2.5倍組為89.05%,5倍組為88.96%,10倍組為74.93%。為確保含藥量,選用5倍組作為實驗量。細胞培養24 h后,谷氨酸加入量為0 μM時細胞存活率為100%、25 μM時為95.85%、100 μM時為84.87%、200 μM時為64.20%,最終選用200 μM的谷氨酸為加入量。
2.2 ?各組細胞凋亡情況
與空白組比較,模型組凋亡細胞個數明顯增多,差異有統計學意義(P<0.01);與模型組比較,含藥血清組和阻斷劑組凋亡細胞個數明顯減少,差異均有統計學意義(P<0.01);與含藥血清組比較,阻斷劑組凋亡細胞個數減少,但差異無統計學意義(P>0.05)。見表1、圖1。
2.3 ?各組NF-κB、HIF-1α、BNIP3蛋白表達情況
與空白組比較,模型組NF-κB、HIF-1α、BNIP3蛋白的表達明顯增加,差異有統計學意義(P<0.05,P<0.01);與模型組比較,含藥血清組及阻斷劑組NF-κB、HIF-1α、BNIP3蛋白的表達明顯減少,差異有統計學意義(P<0.05,P<0.01);與含藥血清組比較,阻斷劑組NF-κB、HIF-1α、BNIP3蛋白的表達差異無統計學意義(P>0.05);但與空白組比較,阻斷劑組HIF-1α蛋白的表達量明顯增加,而BNIP3蛋白的表達量明顯減少,差異有統計學意義(P<0.01)。見表2、圖2。
2.4 ?各組SOD和MDA含量表達情況
與空白組比較,模型組SOD及MDA的含量明顯增加,差異有統計學意義(P<0.01);與模型組比較,含藥血清組SOD及MDA的含量明顯減少、阻斷劑組SOD明顯減少,差異均有統計學意義(P<0.01);與含藥血清組比較,阻斷劑組SOD含量明顯減少,差異有統計學意義(P<0.01),MDA的含量差異無統計學意義(P>0.05);但與空白組比較,阻斷劑組MDA的含量明顯增加,差異有統計學意義(P<0.01)。見表3。
3 討論
青光眼在控制眼壓后仍然可引起RGC的凋亡,目前對于視神經的挽救方式較少,神經生長因子的效果并不具有優勢[10-11],而干細胞移植仍處于實驗室階段[12-13]。中醫藥因其具有龐大的藥物組分庫,具備從中進行創新藥物挖掘的潛力,越來越受到學者的重視。彭清華教授所創制的“青光安Ⅱ號方”對RGC的Caspase-3表達有抑制作用,能有效抑制RGC的凋亡[4],但青光安Ⅱ號方抑制凋亡的具體機制并不清楚。
氧化應激可能與青光眼的視神經損傷有關[14-15],研究[7]表明活性氧的增加是小膠質細胞在高眼壓過程中死亡的主要原因,而抑制氧化應激損傷則可以保護膠質細胞[16]。目前,關于中醫藥的研究中,細胞黃素、銀杏葉提取物對于缺氧損傷的RGC具有保護作用[17-18];枸杞子、丹參、川芎、燈盞細辛等,也具有視神經保護效應[19]。所以本研究從氧化應激的相關細胞因子進行研究,來驗證青光安Ⅱ號方對于RGC的保護作用是否是通過調控氧化應激相關因子來實現的。
研究表明,HIF-1α和NF-кB均是氧化應激相關通路中的核心因子,且兩者之間還有密切聯系:HIF-1α可誘導缺氧細胞中的NF-кB的活化[20];而NF-кB也可與HIF-1α啟動子結合,上調缺氧反應中HIF-1α的表達[21]。缺氧反應發生后,細胞內氧自由基的大量生成會引發SOD的上調,其最終產物MDA也會大量生成;同時引發BNIP-3的激活,誘導RGC發生線粒體自噬[22-23]。為了觀察青光安Ⅱ號方含藥血清是否是通過調控HIF-1α發揮作用,本實驗中加入HIF-1α的阻斷劑KC7F2,它是一種選擇性HIF-1α蛋白翻譯抑制劑,可抑制HIF-1α的蛋白合成,進一步抑制BNIP-3和SOD的激活。
中醫學認為青光眼的病理機制是氣虛血瘀,脈絡阻滯,目系失養,玄府閉塞,神水瘀積[24],中醫治療宜采用益氣活血利水的治法,“青光安Ⅱ號方”在此思想指導下應運而生[25]。其組方由黃芪、枸杞子、燈盞細辛、牛膝、川芎、女貞子組成,重用枸杞子、女貞子、牛膝三味,歸肝腎經,為滋補肝腎之品,其中以枸杞子、女貞子補肝腎明目為君,另加黃芪補氣健脾,四藥補益正氣取其“正氣存內,邪不可干”之意,扶助正氣以驅邪外出。故本方以補為主,側重補肝腎之陰,同時在補益基礎上,用牛膝及燈盞細辛活血。黃芪利水,川芎行氣,一使氣行則血行、氣行亦水行,二使全方補而不滯。全方補通兼施,使目竅通暢、氣血調和,則諸癥俱解。
本次研究中,我們使用谷氨酸誘導RGC-5細胞損傷,模擬青光眼所造成的RGC凋亡[5,26-27]。本次研究結果中,模型組的NF-κB、HIF-1α均出現高表達,與空白組、含藥血清組和阻斷劑組比較,差異有統計學意義(P<0.05,P<0.01),說明當RGC-5細胞損傷出現時,會激活其中NF-κB表達,進一步激活HIF-1α表達,兩者可能形成正反饋的調節。SOD、MDA在模型組中表達升高(P<0.01),說明在視神經損傷后,細胞內活性氧增加,引發了SOD上調以及代謝產生MDA的集聚;另外,BNIP-3在模型組中高表達(P<0.01),說明在激活HIF-1α后,引發了BNIP-3途徑的線粒體自噬反應,有可能進而形成細胞凋亡。Hoechst法檢測到模型組細胞凋亡數量明顯多于其他各組(P<0.01),也驗證了這一點,且與前期研究的結果一致[4]。而與模型組相比,含藥血清組與阻斷劑組在谷氨酸致損后,其NF-κB表達均得到了一定的抑制,與模型組比較,差異有統計學意義(P<0.05);同時此兩組的HIF-1α表達也受到明顯抑制(P<0.01);而含藥血清組與阻斷劑組之間并無明顯差異(P>0.05),表明含藥血清對RGC-5細胞產生了 組的BNIP-3蛋白表達和SOD含量均明顯受到抑制,表明含藥血清在抑制NF-κB和HIF-1α蛋白表達的基礎上,進一步抑制了BNIP-3和SOD的表達,前者可以減弱RGC-5細胞的線粒體自噬,對抑制RGC的凋亡有正向作用;而后者將導致MDA的減少,與本次實驗的結果吻合,最終形成了對細胞凋亡的抑制作用,表現為含藥血清組與阻斷劑組的細胞凋亡數量明顯減少(P<0.01)。
綜上所述,青光安Ⅱ號方含藥血清對谷氨酸誘導損傷的RGC-5細胞中NF-кB具有抑制作用,進而抑制了HIF-1α通路的激活,減弱了由于氧化應激所致的細胞凋亡。
參考文獻
[1] 梁遠波,江俊宏.我國青光眼防治問題與展望[J].浙江醫學,2020, 42(22):2377-2382.
[2] 梁遠波,江俊宏,王寧利.中國青光眼流行病學調查研究回顧[J].中華眼科雜志,2019,55(8):634-640.
[3] 李銀鑫,歐 ?晨,周亞莎,等.彭清華教授采用青光安Ⅱ號方治療青光眼中晚期視神經損害[J].亞太傳統醫藥,2020,16(12):113-116.
[4] 李銀鑫,蔣鵬飛,曾志成,等.青光安Ⅱ號方有效組分對青光眼模型DBA/2J小鼠視網膜中RhoA、ROCK及Caspase-3蛋白表達的影響[J].湖南中醫藥大學學報,2020,40(6):673-678.
[5] LIU Y, LEE R K. Cell transplantation to replace retinal ganglion cells faces challenges - the Switchboard Dilemma[J]. Neural Regeneration Research, 2021, 16(6): 1138-1143.
[6] AHMAD A, AHSAN H. Biomarkers of inflammation and oxidative stress in ophthalmic disorders[J]. Journal of Immunoassay and Immunochemistry, 2020, 41(3): 257-271.
[7] AIRES I D, BOIA R, RODRIGUES-NEVES A C, et al. Blockade of microglial adenosine A2A receptor suppresses elevated pressure-induced inflammation, oxidative stress, and cell death in retinal cells[J]. Glia, 2019, 67(5): 896-914.
[8] HU X X, DAI Y, SUN X H. Parkin overexpression protects retinal ganglion cells against glutamate excitotoxicity[J]. Molecular Vision, 2017, 23: 447-456.
[9] LI J, JIANG G H, CHEN Y L, et al. Altered expression of hypoxia-Inducible factor-1α participates in the epileptogenesis in animal models[J]. Synapse, 2014, 68(9): 402-409.
[10] EFTIMIADI G, SOLIGO M, MANNI L, et al. Topical delivery of nerve growth factor for treatment of ocular and brain disorders[J]. Neural Regeneration Research, 2021, 16(9): 1740-1750.
[11] LAMBIASE A, MANTELLI F, BONINI S. Nerve growth factor eye drops to treat Glaucoma[J]. Drug News & Perspectives, 2010, 23(6): 361-367.
[12] HARADA C, NORO T, KIMURA A, et al. Suppression of oxidative stress as potential therapeutic approach for normal tension Glaucoma[J]. Antioxidants (Basel, Switzerland), 2020, 9(9): 874-886.
[13] XIONG S, KUMAR A, TIAN S, et, al. Stem cell transplantation rescued a primary open-angle glaucoma mouse model[J]. Elife. 2021, 10: e63677.
[14] LIU Y, LEE R K. Cell transplantation to replace retinal ganglion cells faces challenges-the Switchboard Dilemma[J]. Neural Regeneration Research, 2021, 16(6): 1138-1143.
[15] AHMAD A, AHSAN H. Biomarkers of inflammation and oxidative stress in ophthalmic disorders[J]. Journal of Immunoassay & Immunochemistry, 2020, 41(3): 257-271.
[16] MEANS J C, LOPEZ A A, KOULEN P. Estrogen protects optic nerve head astrocytes against oxidative stress by preventing caspase-3 activation, tau dephosphorylation at Ser422 and the formation of tau protein aggregates[J]. Cellular and Molecular Neurobiology, 2021, 41(3): 449-458.
[17] CHO H K, KIM S, LEE E J, et al. Neuroprotective effect of Ginkgo biloba extract against hypoxic retinal ganglion cell degeneration in vitro and in vivo[J]. Journal of Medicinal Food, 2019, 22(8): 771-778.
[18] MALISHEVSKAYA T N, YUSUPOV A R, SHATSKIKH S V, et al. Efficacy and safety of neuroprotection in patients with primary open-angle Glaucoma[J]. Vestnik Oftalmologii, 2019, 135(2): 83-92.
[19] 周亞莎,廖林麗,覃艮艷,等.不同中藥對青光眼小鼠視網膜TRPV4及TRAAK蛋白影響的比較研究[J].湖南中醫雜志,2020,36(12):153-157.
[20] LEE S H, LEE Y J, HAN H J. Effect of arachidonic acid on hypoxia-induced IL-6 production in mouse ES cells: Involvement of MAPKs, NF-kappaB, and HIF-1alpha[J]. Journal of Cellular Physiology, 2010, 222(3): 574-585.
[21] BELAIBA R S, BONELLO S, Z HRINGER C, et al. Hypoxia up-regulates hypoxia-inducible factor-1alpha transcription by involving phosphatidylinositol 3-kinase and nuclear factor kappaB in pulmonary artery smooth muscle cells[J]. Molecular Biology of the Cell, 2007, 18(12): 4691-4697.
[22] ZENG C, ZOU T T, QU J Y, et al. Cyclovirobuxine D induced-mitophagy through the p65/BNIP3/LC3 axis potentiates its apoptosis-inducing effects in lung cancer cells[J]. International Journal of Molecular Sciences, 2021, 22(11): 5820.
[23] HUANG Y N, WEN Q L, HUANG J F, et al. Manganese (II) chloride leads to dopaminergic neurotoxicity by promoting mitophagy through BNIP3-mediated oxidative stress in SH-SY5Y cells[J]. Cellular & Molecular Biology Letters, 2021, 26(1): 23.
[24] 秦裕輝.問目哪得清如許,唯有活血利水來——評《眼科活血利水法的研究》[J]. 湖南中醫藥大學學報,2020,40(3):381-382.
[25] 彭 ?俊,曾志成,譚涵宇,等.眼科活血利水法的基礎研究進展[J].眼科新進展,2010,30(6):585-589,593.
[26] SUCHER N J, LIPTON S A, DREYER E B. Molecular basis of glutamate toxicity in retinal ganglion cells[J]. Vision Research, 1997, 37(24): 3483-3493.
[27] KRITIS A A, STAMOULA E G, PANISKAKI K A, et al. Researching glutamate-induced cytotoxicity in different cell lines: A comparative/collective analysis/study[J]. Frontiers in Cellular Neuroscience, 2015, 9: 91.

